- 2021-08-24 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第2章 第2节 共价键与分子的空间构型 第1课时学案 鲁科版选修3
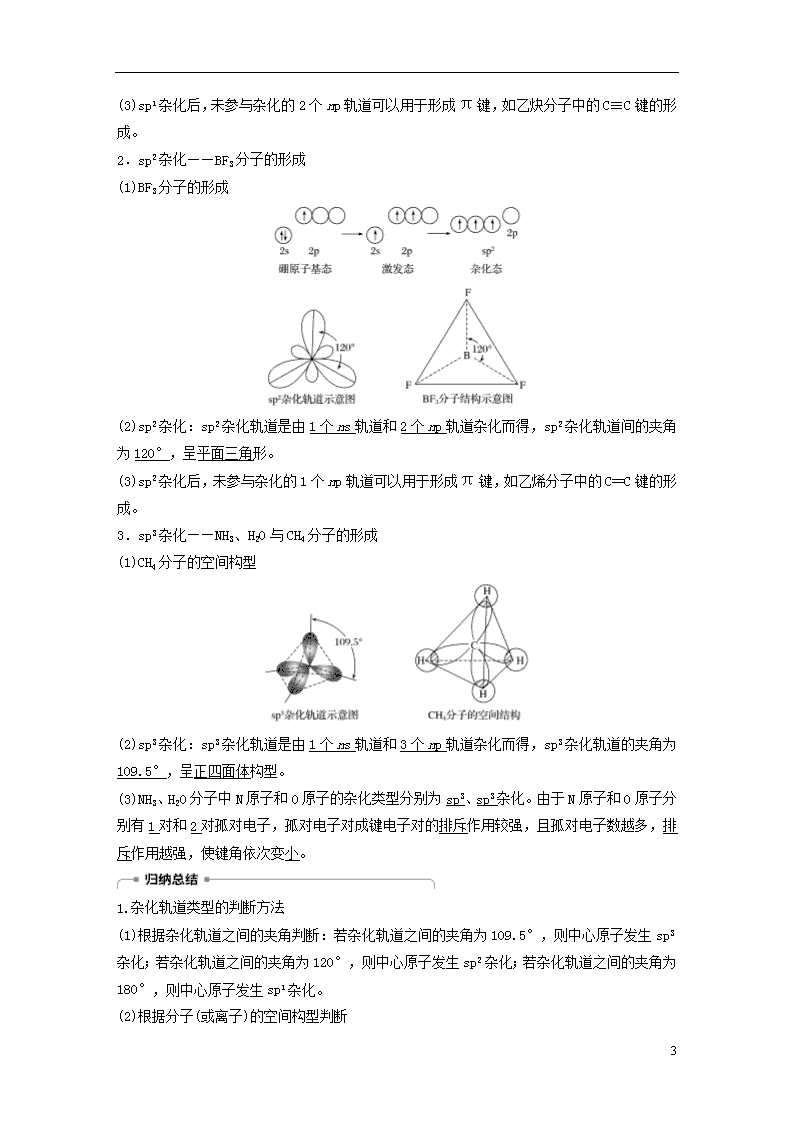
第1课时 一些典型分子的空间构型 [学习目标定位] 1.了解常见分子的空间构型。2.理解杂化轨道理论的主要内容,并能用杂化轨道理论解释或预测某些分子或离子的空间构型。 一、杂化轨道及其理论要点 1.试解释CH4分子为什么具有正四面体的空间构型? 答案 在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H是等同的。可表示为 2.轨道杂化与杂化轨道 杂化轨道理论四要点 (1)能量相近 原子在成键时,同一原子中能量相近的原子轨道可重新组合成杂化轨道。 (2)数目不变 形成的杂化轨道数与参与杂化的原子轨道数相等。 (3)成键能力增强 杂化改变原有轨道的形状和伸展方向,使原子形成的共价键更牢固。 (4)排斥力最小 杂化轨道为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向不同。 例1 下列关于杂化轨道的说法错误的是( ) 14 A.所有原子轨道都参与杂化 B.同一原子中能量相近的原子轨道参与杂化 C.杂化轨道能量集中,有利于牢固成键 D.杂化轨道中不一定有电子 答案 A 解析 只有能量相近的原子轨道才能参与杂化,1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,故A项不正确,B项正确;杂化轨道重叠程度更大,形成牢固的化学键,故C项正确;并不是所有的杂化轨道中都有电子,可以是空轨道,也可以有1对孤对电子(如NH3、H2O的形成),故D项正确。 易错警示 (1)杂化轨道只用于形成σ键或者用来容纳未参与成键的孤对电子。 (2)未参与杂化的p轨道,可用于形成π键。 例2 用鲍林的杂化轨道理论解释CH4分子的正四面体结构,下列说法不正确的是( ) A.C原子的4个杂化轨道的能量一样 B.C原子的sp3杂化轨道之间夹角一样 C.C原子的4个价电子分别占据4个sp3杂化轨道 D.C原子有1个sp3杂化轨道由孤对电子占据 答案 D 解析 甲烷中C原子采取sp3杂化,每个杂化轨道上1个电子分别与1个H原子上的电子结合形成共价键,这四个共价键完全相同,轨道间的夹角为109.5°,形成正四面体形的分子。 规律总结 1个ns轨道和3个np轨道杂化得到4个能量相等的sp3杂化轨道,且4个轨道间夹角相等。 二、杂化轨道类型和分子的空间构型 1.sp1杂化——BeCl2分子的形成 (1)BeCl2分子的形成 杂化后的2个sp1杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。 (2)sp1杂化:sp1杂化轨道是由1个ns轨道和1个np轨道杂化而得,sp1杂化轨道间的夹角为180°,呈直线形。 14 (3)sp1杂化后,未参与杂化的2个np轨道可以用于形成π键,如乙炔分子中的C≡C键的形成。 2.sp2杂化——BF3分子的形成 (1)BF3分子的形成 (2)sp2杂化:sp2杂化轨道是由1个ns轨道和2个np轨道杂化而得,sp2杂化轨道间的夹角为120°,呈平面三角形。 (3)sp2杂化后,未参与杂化的1个np轨道可以用于形成π键,如乙烯分子中的C==C键的形成。 3.sp3杂化——NH3、H2O与CH4分子的形成 (1)CH4分子的空间构型 (2)sp3杂化:sp3杂化轨道是由1个ns轨道和3个np轨道杂化而得,sp3杂化轨道的夹角为109.5°,呈正四面体构型。 (3)NH3、H2O分子中N原子和O原子的杂化类型分别为sp3、sp3杂化。由于N原子和O原子分别有1对和2对孤对电子,孤对电子对成键电子对的排斥作用较强,且孤对电子数越多,排斥作用越强,使键角依次变小。 1.杂化轨道类型的判断方法 (1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109.5°,则中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp1杂化。 (2)根据分子(或离子)的空间构型判断 14 ①正四面体形―→中心原子为sp3杂化;三角锥形―→中心原子为sp3杂化; ②平面三角形―→中心原子为sp2杂化; ③直线形―→中心原子为sp1杂化。 2.杂化轨道类型与分子空间构型的关系 (1)当杂化轨道全部用于形成σ键时 杂化类型 sp1 sp2 sp3 参与杂化的原子轨道及数目 ns 1 1 1 np 1 2 3 杂化轨道数目 2 3 4 杂化轨道间的夹角 180° 120° 109.5° 空间构型 直线形 平面三角形 正四面体形 实例 BeCl2、CO2、CS2 BCl3、BF3、BBr3 CF4、SiCl4、SiH4 (2)当杂化轨道中有未参与成键的孤对电子时,由于孤对电子的排斥作用,会使分子的空间构型与杂化轨道的形状不同,如H2O和NH3,O与N的杂化类型都为sp3杂化,孤电子对数分别为2、1,分子空间构型分别为V形、三角锥形。 例3 NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为 ( ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 D.NH3分子中有3个σ键,而CH4分子中有4个σ键 答案 C 解析 NH3和CH4的中心原子均是sp3杂化,但NH3分子中有一对孤对电子,CH4分子中没有孤对电子,由于孤对电子与成键电子对之间的排斥作用>成键电子对与成键电子对之间的排斥作用,NH3分子进一步被“压缩”成三角锥形,甲烷则呈正四面体形。 方法规律 ABm型分子(或离子)的空间构型与中心原子杂化轨道类型和孤电子对数的关系: ABm型分子或离子 中心原子杂化类型 中心原子孤电子对数 空间构型 AB4 sp3 0 正四面体形 AB3(B3A) sp3 1 三角锥形 sp2 0 平面三角形 AB2(B2A) sp2 1 V形 14 sp1 0 直线形 中心原子或离子的杂化轨道空间构型与分子或离子的空间构型不一定相同。中心原子杂化轨道类型相同的分子或离子的空间构型不一定相同。 例4 下列有关NCl3分子的叙述正确的是( ) A.NCl3分子中的N原子采取sp2杂化 B.NCl3分子为平面三角形 C.NCl3分子中Cl—N—Cl键角小于109.5° D.NCl3分子中含有非极性键 答案 C 解析 NCl3分子中心原子N原子的杂化轨道数为n=×(5+3)=4,N原子的杂化类型为sp3,其中1个杂化轨道含有1对孤对电子,对成键电子对具有排斥作用,使键角小于109.5°,NCl3分子为三角锥形,分子中N—Cl键为极性键。 方法规律——比较键角大小的方法 (1)中心原子杂化轨道类型不同时,键角按sp1、sp2、sp3顺序减小。 (2)中心原子杂化轨道类型相同时,孤电子对数越多,键角越小。 如NH3中的氮原子与CH4中的碳原子均为sp3杂化,但键角分别为107.3°、109.5°。 三、苯分子的空间构型与大π键 1.根据杂化轨道理论,形成苯分子时每个碳原子中一个2s轨道和两个2p轨道都发生了sp2杂化(如2s、2px、2py杂化),由此形成的三个sp2杂化轨道在同一平面内,还有一个未参与杂化的2p轨道(如2pz)垂直于这个平面。 2.每个碳原子的两个sp2杂化轨道上的电子分别与邻近的两个碳原子的sp2杂化轨道上的电子配对形成σ键,于是六个碳原子组成一个正六边形的碳环;每个碳原子的另一个sp2杂化轨道上的电子分别与一个氢原子的1s电子配对形成σ键。 3.6个碳原子上各有1个未参与杂化的垂直于碳环平面的p轨道,这6个轨道以“肩并肩”的方式形成含有6个电子、属于6个C原子的大π键。 例5 下列有关苯分子中的化学键描述正确的是( ) A.每个碳原子的sp2杂化轨道中的其中一个形成大π键 14 B.每个碳原子的未参加杂化的2p轨道形成大π键 C.碳原子的三个sp2杂化轨道与其他原子形成三个π键 D.碳原子的未参加杂化的2p轨道与其他原子形成σ键 答案 B 解析 苯分子中每个碳原子的三个sp2杂化轨道分别与两个碳原子和一个氢原子形成σ键。同时每个碳原子还有一个未参加杂化的2p轨道,它们均有一个未成对电子,这些2p轨道相互平行,以“肩并肩”方式相互重叠,形成一个多电子的大π键。 方法规律——有机物中碳原子的杂化类型 (1)根据碳原子形成的σ键数目判断 有机物中,碳原子杂化轨道形成σ键,未杂化轨道形成π键。 (2)由碳原子的饱和程度判断 ①饱和碳原子采取sp3杂化; ②双键上的碳原子或苯环上的碳原子采取sp2杂化; ③叁键上的碳原子采取sp1杂化。 杂化轨道类型 典型分子 空间构型 sp1 CO2 直线形 sp2 SO2 V形 sp3 H2O V形 sp2 SO3 平面三角形 sp3 NH3 三角锥形 sp3 CH4 正四面体形 1.能正确表示CH4中碳原子的成键方式的示意图为( ) A. B. C. D. 14 答案 D 解析 碳原子的2s轨道与2p轨道形成4个等性的杂化轨道,因此碳原子4个价电子分占在4个sp3杂化轨道上,且自旋状态相同。 2.s轨道和np轨道杂化的类型不可能有( ) A.sp1杂化 B.sp2杂化 C.sp3杂化 D.sp4杂化 答案 D 解析 p能级只有3个轨道,不可能有sp4杂化。 3.有关杂化轨道的说法不正确的是( ) A.杂化轨道全部参与形成化学键 B.杂化前后的轨道数不变,但轨道的形状发生了改变 C.sp3、sp2、sp1杂化轨道的夹角分别为109.5°、120°、180° D.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释 答案 A 解析 杂化轨道用于形成σ键和容纳孤电子对。 4.下列对于NH3和CO2的说法中正确的是( ) A.都是直线形结构 B.中心原子都采取sp1杂化 C.NH3为三角锥形结构,CO2为直线形结构 D.N原子和C原子上都没有孤对电子 答案 C 解析 NH3和CO2分子的中心原子分别采取sp3杂化、sp1杂化的方式成键,但NH3分子的N原子上有1对孤对电子来参与成键,根据杂化轨道理论,NH3的空间构型应为三角锥形,CO2的空间构型为直线形。 5.下列关于原子轨道的说法正确的是( ) A.凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体形 B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的1个s轨道和3个p轨道重新组合而形成的一组能量相同的新轨道 D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化成键 答案 C 解析 中心原子采取sp3杂化,空间构型是正四面体形,但如果中心原子还有孤电子对,分子的空间构型则不是正四面体;CH4分子中的sp3 14 杂化轨道是C原子的一个2s轨道与三个2p轨道杂化而成的;AB3型的共价化合物,A原子可能采取sp2杂化或sp3杂化。 6.请完成下列各小题。 (1)在SO2分子中,S原子采取________杂化,SO2的键角________(填“大于”“等于”或“小于”)120°,SO3分子中S原子采取______杂化,SO3分子的空间构型为______。 (2)OF2中氧原子的杂化方式为________,OF2分子的空间构型为________。 (3)NO的空间构型是________,N原子的杂化类型是________。 (4)SO、SO的空间构型分别为________、________,S原子的杂化轨道类型分别为________、________。 答案 (1)sp2 小于 sp2 平面三角形 (2)sp3 V形 (3)V形 sp2 (4)正四面体形 三角锥形 sp3 sp3 解析 (1)SO2分子中,S原子的杂化轨道数为=3,S原子采取sp2杂化,但有1对孤对电子,所以键角小于120°。SO3分子中S原子杂化轨道数为×(6+0)=3,S原子采取sp2杂化,SO3为平面三角形。 (2)OF2分子中,O原子的杂化轨道数=×(6+2)=4,杂化类型为sp3杂化,含有2对孤对电子,OF2为V形。 (3)N的杂化轨道数为×(5+1)=3,N原子含有1对孤对电子,故NO的空间构型为V形。 (4)SO中S原子的杂化轨道数为×(6+0+2)=4,S原子采取sp3杂化,SO的空间构型为正四面体形。SO中S原子杂化轨道数为×(6+0+2)=4,S原子采取sp3杂化,S原子含有1对孤对电子,所以该离子为三角锥形。 [对点训练] 题组1 原子轨道杂化与杂化原子轨道 1.下列关于杂化轨道的叙述正确的是( ) A.杂化轨道可用于形成σ键,也可用于形成π键 B.杂化轨道可用来容纳未参与成键的孤电子对 C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的1个s轨道杂化而成的 D.在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—H σ键 答案 B 14 解析 杂化轨道只用于形成σ键或用来容纳未参与成键的孤对电子,不能用来形成π键,故B正确,A不正确;NH3中N原子的sp3杂化轨道是由N原子的1个s轨道和3个p轨道杂化而成的,C不正确;在乙烯分子中,1个碳原子的3个sp2杂化轨道中的2个sp2杂化轨道与2个氢原子的s轨道重叠形成2个C—H σ键,剩下的1个sp2杂化轨道与另一个碳原子的sp2杂化轨道重叠形成1个C—C σ键,D不正确。 2.甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH),在这个过程中,下列描述不合理的是( ) A.碳原子的杂化类型发生了改变 B.微粒的形状发生了改变 C.微粒的稳定性发生了改变 D.微粒中的键角发生了改变 答案 A 解析 CH4为正四体结构,而CH为三角锥形结构,形状、键角、稳定性均发生改变,但杂化类型不变,仍是sp3杂化。 题组2 杂化轨道类型及其判断 3.下列分子中的碳原子采用sp2杂化的是( ) A.C2H2 B.CS2 C.HCHO D.C3H8 答案 C 解析 饱和C原子采取sp3杂化,双键C原子采取sp2杂化,叁键C原子采取sp1杂化。所以C2H2中的C原子采取sp1杂化,HCHO分子中含有碳氧双键,C原子采取sp2杂化,C3H8中的C原子采取sp3杂化。CS2中C原子的杂化轨道数为×(4+0)=2,所以C原子采取sp1杂化。 4.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是( ) A.乙醛() B.丙烯腈() C.甲醛() 14 D.丙炔() 答案 A 解析 乙醛中甲基的碳原子采取sp3杂化,醛基的碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子采取sp2杂化,另一个碳原子采取sp1杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基的碳原子采取sp3杂化,碳碳叁键的两个碳原子采取sp1杂化。 5.(2017·曹妃甸一中期末)下列分子中的中心原子杂化轨道的类型相同的是( ) A.SO3与SO2 B.BF3与NH3 C.BeCl2与SCl2 D.H2O与SO2 答案 A 解析 SO3中S原子杂化轨道数为3,采取 sp2杂化方式,SO2中S原子杂化轨道数为3,采取 sp2杂化方式, A正确; BF3中B原子杂化轨道数为3,采取 sp2杂化方式,NH3中N原子杂化轨道数为4,采取 sp3杂化方式, B错误; BeCl2中Be原子杂化轨道数为2,采取 sp1杂化方式,SCl2中S原子杂化轨道数为4,采取sp3杂化方式,C错误。 题组3 乙烯、乙炔、苯分子的结构 6.有关乙炔分子中的化学键描述不正确的是( ) A.两个碳原子采用sp1杂化方式 B.两个碳原子采用sp2杂化方式 C.每个碳原子都有两个未参与杂化的2p轨道形成π键 D.两个碳原子间形成2个π键和1个σ键 答案 B 解析 乙炔分子中C原子以1个2s轨道和1个2p轨道形成sp1杂化轨道。故乙炔分子中C原子采用sp1杂化方式,且每个C原子以2个未参与杂化的2p轨道形成2个π键,构成CC键。 7.关于乙烯分子中化学键的描述正确的是( ) A.C原子sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 B.乙烯分子中有4个σ键、2个π键 C.C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键 D.C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键 答案 A 解析 在乙烯分子中,每个碳原子的2s轨道与2个2p轨道杂化形成3个sp2杂化轨道,其中2个sp2杂化轨道分别与2个氢原子的1s轨道形成C—H σ键,另外1个sp2杂化轨道与另一个碳原子的sp2杂化轨道形成C—C 14 σ键;2个碳原子中未参与杂化的2p轨道形成1个π键。 8.下列关于苯分子的描述错误的是( ) A.苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120° B.苯分子中的碳原子采取sp3杂化 C.每个碳原子中未参与杂化的2p轨道以“肩并肩”形式形成一个大π键 D.大π键中6个电子被6个C原子共用 答案 B 解析 苯分子中的碳原子采取sp2杂化,六个碳碳键完全相同,呈平面正六边形结构,键角皆为120°;在苯分子中间形成一个较稳定的六电子大π键。 题组4 杂化轨道与分子空间构型 9.(2017·曹妃甸一中期末)已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道, 那么[ZnCl4]2-的空间构型为( ) A.直线形 B.平面正方形 C.正四面体 D.正八面体 答案 C 解析 Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,[ZnCl4]2-中的配位数是4,故空间构型为正四面体形。 10.下列说法中正确的是 ( ) A.PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果 B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道 C.中心原子采取sp3杂化的分子,其空间构型可能是四面体形或三角锥形或V形 D.AB3型的分子空间构型必为平面三角形 答案 C 解析 PCl3分子中心磷原子上的价电子对数=σ键电子对数+孤电子对数=3+=4,因此,PCl3分子中磷原子以sp3杂化,选项A错误;sp3杂化轨道是原子最外层电子上的s轨道和3个p轨道“混合”起来,形成能量相等、成分相同的4个轨道,选项B错误;一般中心原子采取sp3杂化的分子所得到的空间构型为四面体形,如甲烷分子,但如果有杂化轨道被中心原子上的孤电子对占据,则构型发生变化,如NH3、PCl3 分子是三角锥形,H2O分子是V形,选项D错误、C正确。 11.下列关于NH、NH3、NH三种微粒的说法不正确的是( ) A.三种微粒所含有的电子数相等 B.三种微粒中氮原子的杂化方式相同 C.三种微粒的空间构型相同 14 D.键角大小关系:NH>NH3>NH 答案 C 解析 NH、NH3、NH含有的电子数均为10,A正确;NH、NH3、NH三种微粒中氮原子的杂化方式均为sp3杂化,B正确;NH空间构型为正四面体形,NH3为三角锥形,NH为V形,C错误;NH、NH3、NH三种微粒的键角大小关系为NH>NH3>NH,D正确。 12.下列分子的空间构型是正四面体形的是( ) ①CH4 ②NH3 ③CF4 ④SiH4 ⑤SO ⑥NH A.①②③ B.①③④ C.②④⑤ D.①③⑤ 答案 B 解析 C与Si价电子排布式为ns2np2,在参与成键时都是形成了4个sp3杂化轨道,故它们的空间构型都是正四面体形。NH、SO中心原子的杂化轨道数分别为×(5+4-1)=4、×(6+0+2)=4,所以中心原子都是sp3杂化,NH、SO都是正四面体结构但不是分子。 [综合强化] 13.已知在水中存在平衡2H2OH3O++OH-。 (1)H2O分子中O原子轨道的杂化类型为__________,H+可与H2O形成H3O+,H3O+的中心原子采用__________杂化,H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________________________________________________________________________ ________________________________________________________________________。 (2)下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是________(填字母)。 a.AsH3中的As原子 b.NH中的N原子 c.NO中的N原子 d.NO中的N原子 答案 (1)sp3 sp3 H2O中O原子有两对孤对电子,H3O+中O原子只有一对孤对电子,排斥力较小 (2)ab 解析 (1) H2O中O原子的价电子对数=×(6+2)=4,所以O原子采用sp3杂化。H3O+中O原子的价电子对数=×(6+3-1)=4,O原子杂化类型为sp3杂化。H2O中O原子的孤电子对数为2,H3O+中O原子的孤电子对数为1,排斥作用力比H2O的小,H3O+中H—O—H键角比H2O中的大。 (2) 中心原子杂化轨道数 中心原子杂化类型 14 AsH3 ×(5+3)=4 sp3 NH ×(5+2+1)=4 sp3 NO ×(5+0+1)=3 sp2 NO ×(5+0+1)=3 sp2 14.有机物中碳原子的杂化类型具有一定规律,请回答下列问题: (1)乙炔与氢氰酸(HCN)反应可得丙烯腈(H2C==CH—C≡N)。丙烯腈分子中σ键和π键的个数之比为__________,碳原子轨道杂化类型是__________,1 mol该分子中处于同一直线上的原子数目最多为__________。 (2)HOCH2CN分子中碳原子轨道的杂化类型是______。 (3)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1 mol乙醛中含有的σ键的数目为________________,CH3COOH中碳原子的杂化轨道类型为__________。 答案 (1)2∶1 sp2、sp1 3NA (2)sp3、sp1 (3)sp2、sp3 6NA sp2、sp3 解析 (1)单键为σ键,双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键,H2C==CH—C≡N分子中σ键和π键个数之比为2∶1。H2C==CH—C≡N分子中,形成双键的C原子与其他原子形成3个σ键,所以该C原子采取sp2 杂化;形成叁键的C原子与其他原子形成2个σ键,所以C原子采取sp1杂化。碳碳双键是平面结构,而C≡N是直线形结构,丙烯腈的结构为,所以在同一直线上的原子最多为3个,即“”上的3个原子。 (2)HOCH2CN的结构式为,与羟基相连的碳原子形成4个σ键,采取sp3杂化,C≡N键中含1个σ键和2个π键,碳原子形成2个σ键,采取sp1杂化。 (3)乙醛分子的结构式为,其中—CH3的碳原子形成4个σ键,采取sp3杂化,而—CHO中的碳原子形成3个σ键,采取sp2杂化。1个CH3CHO分子中含有5个单键和1个C==O键,故1 mol乙醛分子中含有σ键的数目为6NA。CH3COOH的结构式为 14 ,其中—CH3中碳原子形成4个σ键,采取sp3杂化,而—COOH中碳原子形成3个σ键,采取sp2杂化。 15.W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。 (1)写出下列元素的元素符号: W________,X________,Y________,Z________。 (2)XW4分子中,中心原子采取________杂化,分子的空间构型为________;根据电子云重叠方式的不同,该分子里共价键的类型为________________。 (3)写出Y原子价电子的轨道表示式:____________________________。 (4)X的一种氢化物相对分子质量为26,其分子中的σ键与π键的个数之比为________。 答案 (1)H C O Na (2)sp3 正四面体形 σ键 (3) (4)3∶2 解析 W、X、Y、Z四种元素的原子序数依次增大,其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道,则Y原子核外电子排布式为1s22s22p4,则Y为氧元素;X原子的L电子层中未成对电子数与Y相同,但还有空轨道,则X原子核外电子排布式为1s22s22p2,X为碳元素;W、Z的原子序数相差10,Z的原子序数大于氧元素,则Z一定处于第3周期,且Z原子的第一电离能在同周期中最低,则Z为钠元素,故W为氢元素。 (1)由上述分析可知,W为H、X为C、Y为O、Z为Na。 (2)CH4中碳原子是sp3杂化,分子为正四面体结构,其中氢原子的1s轨道与碳原子的sp3杂化轨道形成σ键。 (4)相对分子质量为26的碳氢化合物是C2H2,其结构式为CHCH,该分子中有3个σ键和2个π键,故σ键与π键的个数之比为3∶2。 14查看更多