- 2021-08-24 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第四章电化学基础3电解池2电解原理的应用真题导思含解析 人教版选修4
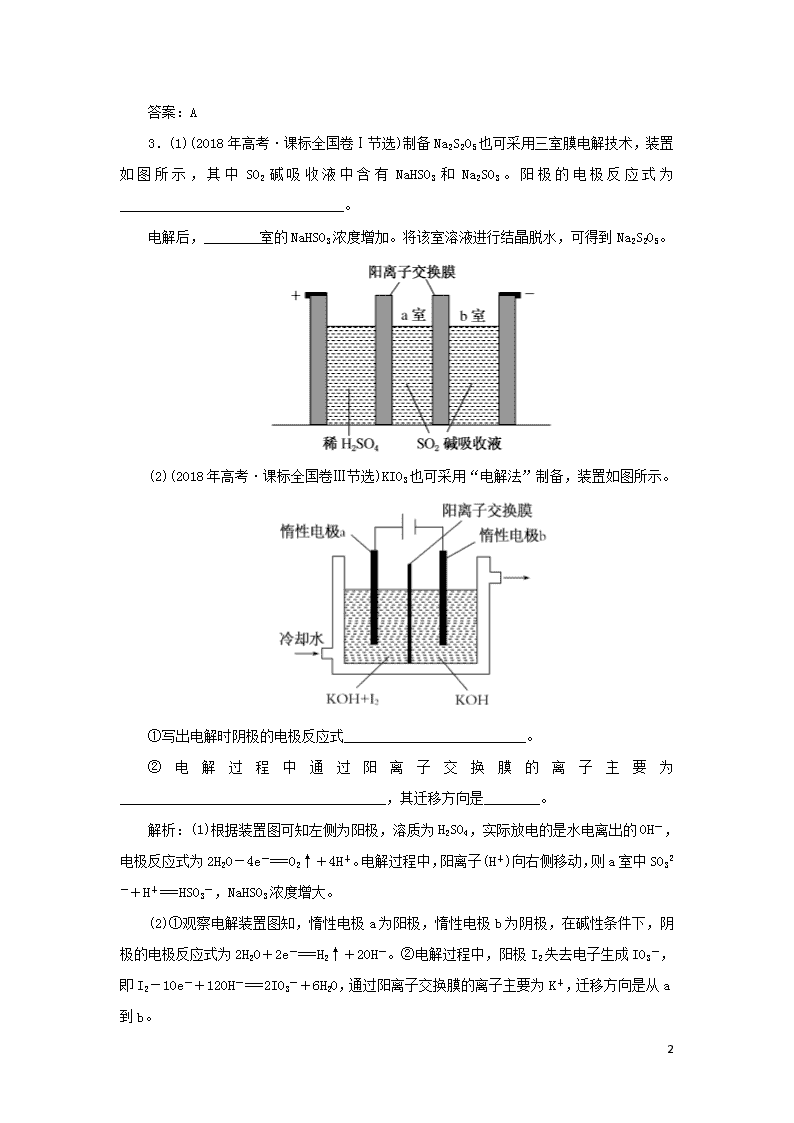
电解原理的应用 1.(2017年高考·课标全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4—H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为:Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 解析:A对:该电解池阳极发生的电极反应为2H2O-4e-===4H++O2↑,氧气将铝制品表面氧化形成致密的氧化膜,所以待加工铝质工件应为阳极;B对,C错:阴极发生的电极反应为2H++2e-===H2↑,阴极可选用不锈钢网作电极;D对:电解质溶液中的阴离子向阳极移动。 答案:C 2.(2018年高考·北京卷)下列化学用语对事实的表述不正确的是( ) A.硬脂酸与乙醇的酯化反应:C17H35COOH+ C2H518OH C17H35COOC2H5+H218O B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O NH4++OH- C.由Na和Cl形成离子键的过程:―→ D.电解精炼铜的阴极反应:Cu2++2e-===Cu 解析:羧酸与醇发生酯化反应的历程是酸脱羟基而醇脱去羟基上的氢原子生成水,所以硬脂酸与乙醇发生酯化反应生成的酯为C17H35CO18OC2H5,A项错误;0.1 mol·L-1氨水的pH为11.1而不是13,说明NH3·H2O是弱电解质,在水溶液中部分电离,即其电离方程式为NH3·H2O NH4++OH-,B项正确;氯化钠是离子化合物,其离子键的形成过程为―→,C项正确;电解时阴极发生还原反应,电解精炼铜时阴极发生的反应为Cu2++2e-===Cu,D项正确。 3 答案:A 3.(1)(2018年高考·课标全国卷Ⅰ节选)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为________________________________。 电解后,________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。 (2)(2018年高考·课标全国卷Ⅲ节选)KIO3也可采用“电解法”制备,装置如图所示。 ①写出电解时阴极的电极反应式__________________________。 ②电解过程中通过阳离子交换膜的离子主要为______________________________________,其迁移方向是________。 解析:(1)根据装置图可知左侧为阳极,溶质为H2SO4,实际放电的是水电离出的OH-,电极反应式为2H2O-4e-===O2↑+4H+。电解过程中,阳离子(H+)向右侧移动,则a室中SO32-+H+===HSO3-,NaHSO3浓度增大。 (2)①观察电解装置图知,惰性电极a为阳极,惰性电极b为阴极,在碱性条件下,阴极的电极反应式为2H2O+2e-===H2↑+2OH-。②电解过程中,阳极I2失去电子生成IO3-,即I2-10e-+12OH-===2IO3-+6H2O,通过阳离子交换膜的离子主要为K+,迁移方向是从a到b。 3 答案:(1)2H2O-4e-===O2↑+4H+ a (2)①2H2O+2e-===2OH-+H2↑ ②K+ 由a到b 3查看更多