- 2021-08-23 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第四章电化学基础3电解池1电解原理真题导思含解析 人教版选修4
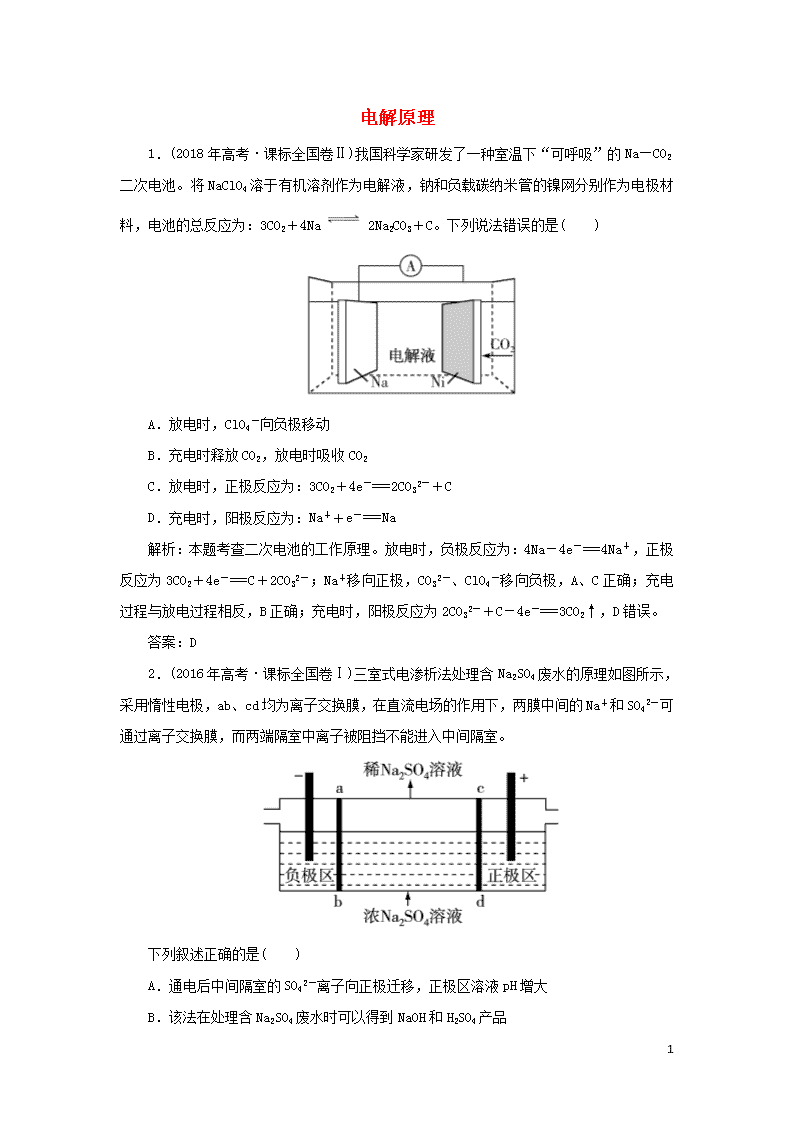
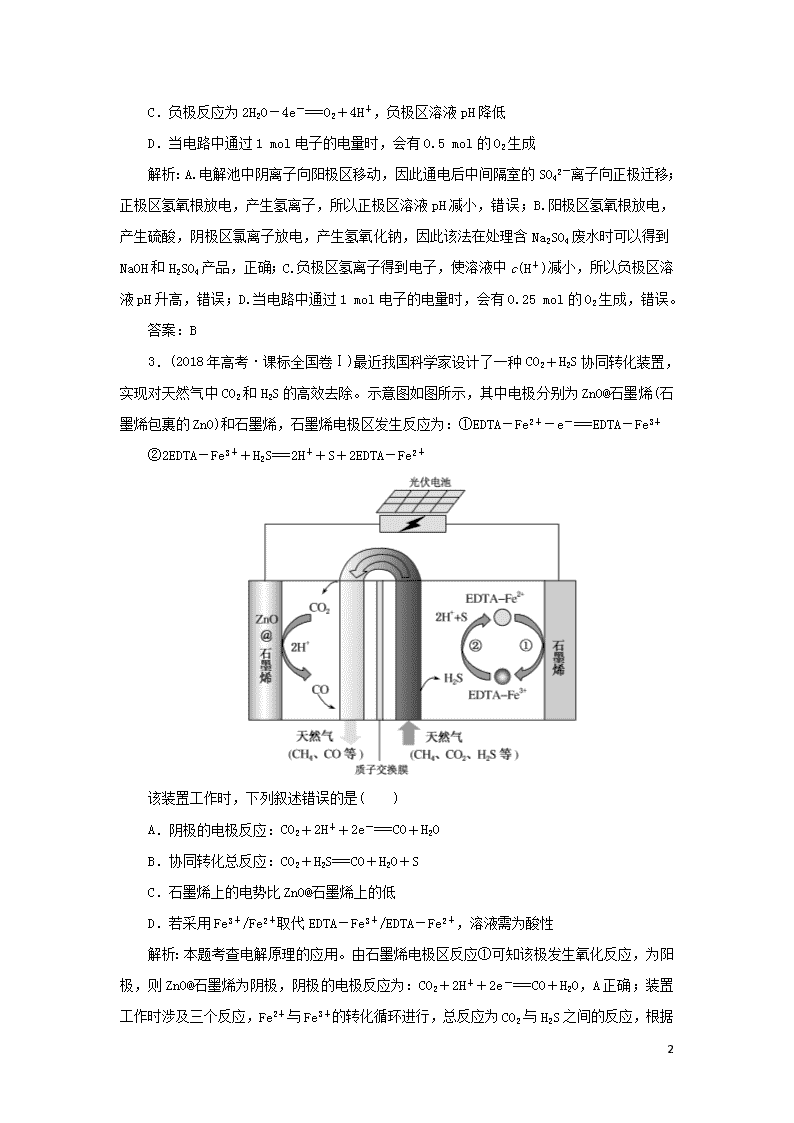
电解原理 1.(2018年高考·课标全国卷Ⅱ)我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C。下列说法错误的是( ) A.放电时,ClO4-向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e-===2CO32-+C D.充电时,阳极反应为:Na++e-===Na 解析:本题考查二次电池的工作原理。放电时,负极反应为:4Na-4e-===4Na+,正极反应为3CO2+4e-===C+2CO32-;Na+移向正极,CO32-、ClO4-移向负极,A、C正确;充电过程与放电过程相反,B正确;充电时,阳极反应为2CO32-+C-4e-===3CO2↑,D错误。 答案:D 2.(2016年高考·课标全国卷Ⅰ)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 3 C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成 解析:A.电解池中阴离子向阳极区移动,因此通电后中间隔室的SO42-离子向正极迁移;正极区氢氧根放电,产生氢离子,所以正极区溶液pH减小,错误;B.阳极区氢氧根放电,产生硫酸,阴极区氯离子放电,产生氢氧化钠,因此该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品,正确;C.负极区氢离子得到电子,使溶液中c(H+)减小,所以负极区溶液pH升高,错误;D.当电路中通过1 mol电子的电量时,会有0.25 mol的O2生成,错误。 答案:B 3.(2018年高考·课标全国卷Ⅰ)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-===EDTA-Fe3+ ②2EDTA-Fe3++H2S===2H++S+2EDTA-Fe2+ 该装置工作时,下列叙述错误的是( ) A.阴极的电极反应:CO2+2H++2e-===CO+H2O B.协同转化总反应:CO2+H2S===CO+H2O+S C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性 解析:本题考查电解原理的应用。由石墨烯电极区反应①可知该极发生氧化反应,为阳极,则ZnO@石墨烯为阴极,阴极的电极反应为:CO2+2H++2e-===CO+H2O,A正确;装置工作时涉及三个反应,Fe2+与Fe3+的转化循环进行,总反应为CO2与H2S之间的反应, 3 根据得失电子守恒可知总反应为:CO2+H2S===CO+H2O+S,B正确;石墨烯与电源正极相连,ZnO@石墨烯与电源负极相连,故石墨烯上的电势比ZnO@石墨烯上的高,C错误;Fe2+、Fe3+均在酸性环境中稳定存在,D正确。 答案:C 3查看更多