- 2021-08-24 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第四章电化学基础4金属的电化学腐蚀与防护真题导思含解析 人教版选修4
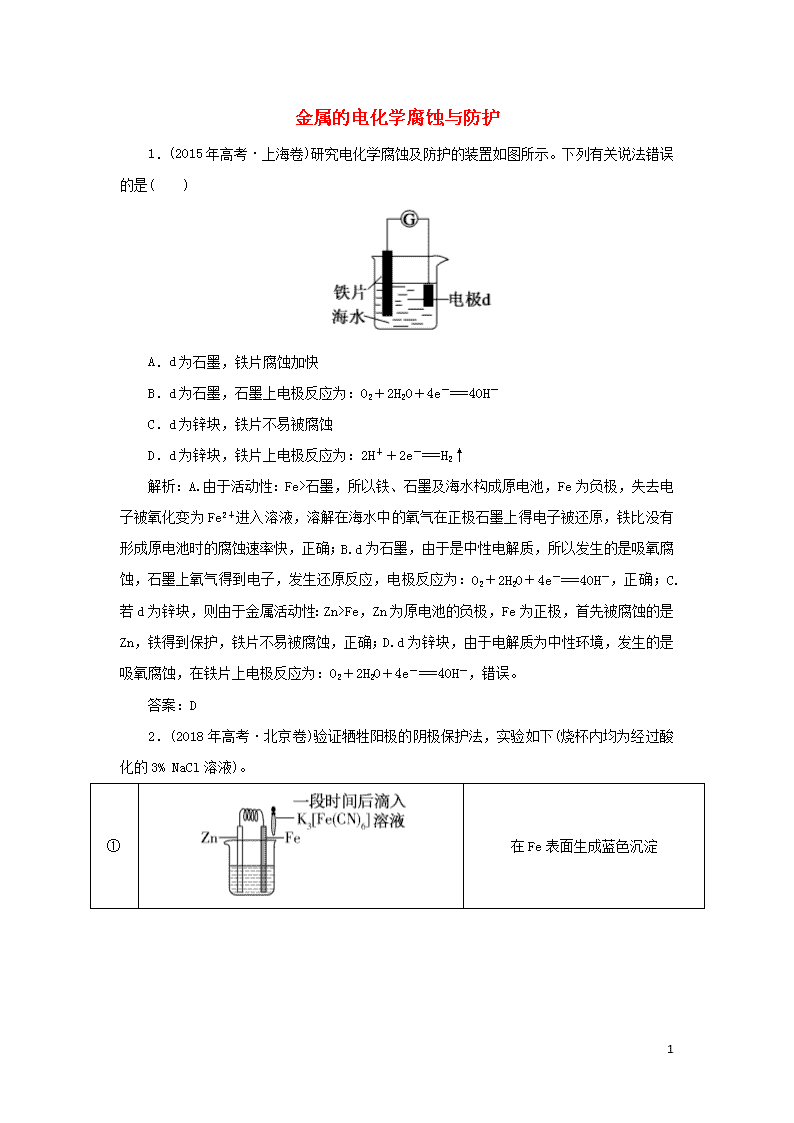
金属的电化学腐蚀与防护 1.(2015年高考·上海卷)研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( ) A.d为石墨,铁片腐蚀加快 B.d为石墨,石墨上电极反应为:O2+2H2O+4e-===4OH- C.d为锌块,铁片不易被腐蚀 D.d为锌块,铁片上电极反应为:2H++2e-===H2↑ 解析:A.由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得电子被还原,铁比没有形成原电池时的腐蚀速率快,正确;B.d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为:O2+2H2O+4e-===4OH-,正确;C.若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,正确;D.d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:O2+2H2O+4e-===4OH-,错误。 答案:D 2.(2018年高考·北京卷)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3% NaCl溶液)。 ① 在Fe表面生成蓝色沉淀 3 ② 试管内无明显变化 ③ 试管内生成蓝色沉淀 下列说法不正确的是( ) A.对比②③,可以判定Zn保护了Fe B.对比①②,K3[Fe(CN)6]可能将Fe氧化 C.验证Zn保护Fe时不能用①的方法 D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 解析:对比②③可知,连接锌片后,溶液中没有亚铁离子,A说法正确;对比①②,①中铁表面产生蓝色沉淀,说明有Fe2+生成,可能是铁被氧化产生的,B说法正确;由①中的实验现象可知,在酸性NaCl溶液中Fe与K3[Fe(CN)6]反应生成Fe2+,故不能采用①的方法验证锌保护铁,C说法正确;由前面分析可知,无法判断铁与铜是否发生原电池反应,D说法错误。 答案:D 3.(2018年高考·课标全国卷Ⅲ)化学与生活密切相关。下列说法错误的是( ) A.泡沫灭火器可用于一般的起火,也适用于电器起火 B.疫苗一般应冷藏存放,以避免蛋白质变性 C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 解析:泡沫灭火器喷出的泡沫中含有电解质,能导电,且水破坏电器,泡沫灭火器不适用于电器起火,A项错误;疫苗的主要成分是蛋白质,高温下蛋白质易变性,失去活性,故疫苗要冷藏,B项正确;水性漆以水作溶剂,相比油性油漆,更有利于健康和环境,C项正确;镁的性质活泼,易失去电子,形成原电池时镁作负极,电热水器内胆(Ag)被保护,这种方法是牺牲阳极的阴极保护法,D项正确。 答案:A 3 4.(2018年高考·天津卷)下列叙述正确的是( ) A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小 B.铁管镀锌层局部破损后,铁管仍不易生锈 C.反应活化能较高,该反应越易进行 D.不能用红外光谱区分C2H5OH和CH3OCH3 解析:本题考查弱电解质的电离、金属的腐蚀、化学反应与能量及有机物分子的结构。A项,HA的Ka越小,说明该一元酸的酸性越弱,酸根离子的水解能力越强,NaA的Kh越大;B项,镀锌层局部破损后有可能在特定的环境下形成原电池,铁电极被保护而不易生锈;C项,活化能越高,反应越不易进行;D项,C2H5OH和CH3OCH3的官能团不同,红外光谱也不同,所以用红外光谱可以区分。 答案:B 3查看更多