- 2021-08-24 发布 |
- 37.5 KB |
- 73页


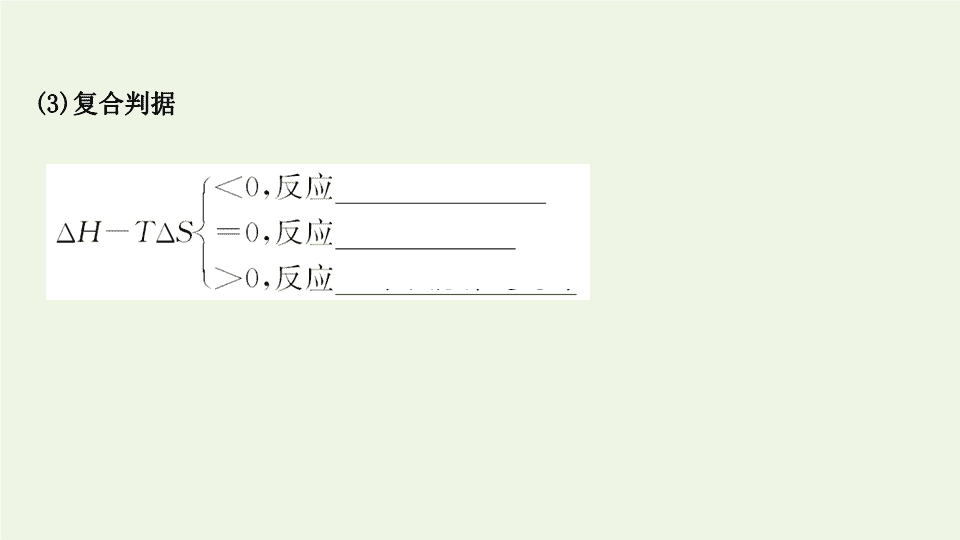
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年新教材高中化学第2章化学反应的方向限度与速率微项目课件鲁科版选择性必修1
微项目 探讨如何利用工业废气中的二氧化碳合成甲醇 —— 化学反应选择与反应条件优化 1. 化学反应方向的判据 (1) 焓判据 : 放热过程中体系能量 _____,ΔH__0, 具有自发进行的倾向 , 但有些 吸热反应也可以自发进行 , 故只用焓变判断反应方向不全面。 (2) 熵判据 : 体系的混乱度 _____, 即熵增 ,ΔS>0, 反应有自发进行的倾向 , 但有 些熵减的过程也可能自发进行 , 故只用熵变来判断反应方向也不全面。 必备知识 · 素养奠基 降低 < 增加 (3) 复合判据 2. 外界条件对化学平衡的影响 若其他条件不变 , 改变下列条件对化学平衡的影响如下 : 条件的改变 ( 其他条件不变 ) 化学平衡的移动 浓度 增大反应物浓度或减小生成物浓度 向 _______ 方向移动 减小反应物浓度或增大生成物浓度 向 _______ 方向移动 正反应 逆反应 条件的改变 ( 其他条件不变 ) 化学平衡的移动 压强 ( 对有 气体存在 的反应 ) 反应前后气体 分子数改变 增大压强 向 _____________ 的方向移动 减小压强 向 _____________ 的方向移动 反应前后气体 分子数不变 改变 压强 ___________ 温度 升高温度 向 _____ 反应方向移动 降低温度 向 _____ 反应方向移动 催化剂 使用催化剂 ___________ 气体体积减小 气体体积增大 平衡不移动 吸热 放热 平衡不移动 3. 外界因素对化学反应速率的影响 影响因素 影响结果 ( 其他条件不变 ) 浓度 固体或 纯液体 浓度为常数 , 增加反应物的量 , 反应速率 _____( 固 体物质的表面积影响反应速率 ) 气体或 溶液 增大反应物的浓度 , 反应速率 _____ 温度 升温 反应速率 _____ 降温 反应速率 _____ 催化剂 使用催化剂能同时同倍改变正、逆反应的速率 不变 加快 加快 减慢 影响因素 影响结果 ( 其他条件不变 ) 压强 加压 ( 缩小体积 ) 对有气体参加的反应 , 正、逆反应速率均 _____ 减压 ( 扩大体积 ) 对有气体参加的反应 , 正、逆反应速率均 _____ 加快 减小 【 情境 · 思考 】 自从 2019 年 6 月以来 , 北半球正在遭遇一场破纪录的高温。就连原本寒冷的北极地区也遭遇了 100 多场野火的肆虐。全球变暖的罪魁祸首是工业废气中 CO 2 的排放 , 因此有关 CO 2 的综合利用越来越受到人们的关注。而甲醇是一种重要的化工原料 , 广泛用于有机合成、医药、农药、燃料、高分子等领域。而且甲醇是一种重要的清洁燃料。 如果用 CO 2 来合成甲醇 , 从元素守恒角度分析应该需要哪种元素 ? 请你写出一个制取甲醇的化学方程式。 提示 : 需要氢元素 ,CO 2 +3H 2 ====CH 3 OH+H 2 O 。 关键能力 · 素养形成 项目活动 1: 选择合适的化学反应 利用 CO 2 合成甲醇 , 如果选取水或氢气作为氢源 , 反应如下 : ①CO 2 (g)+3H 2 (g)====CH 3 OH(g)+H 2 O(g) ②CO 2 (g)+2H 2 O(g)====CH 3 OH(g)+ O 2 (g) 上述两个反应在常温常压下的焓变和熵变如下 : 反应 ΔH/(kJ·mol -1 ) ΔS/(J·mol -1 ·K -1 ) ① -48.97 -177.16 ② +676.48 -43.87 【 活动探究 】 1. 分析判断利用 CO 2 合成甲醇的两个反应能否正向自发进行 , 应选用哪个反应合成甲醇 ? 提示 : 反应①的 ΔH<0,ΔS<0, 因此在低温时 ΔH-TΔS<0, 反应正向自发进行。 反应②的 ΔH>0,ΔS<0, 因此在任何温度下 ΔH-TΔS 均不能为负值 , 反应正向不能自发进行。 因此应选用反应①合成甲醇。 2. 在利用反应①合成甲醇时 , 可能会伴随如下副反应 : CO 2 (g)+H 2 (g)====CO(g)+H 2 O(g) ΔH=+41.17kJ·mol -1 ΔS=+42.08J·mol -1 ·K -1 。判断此反应能否正向自发进行。 提示 : 由于此反应 ΔH>0,ΔS>0, 因此在高温时 ΔH-TΔS<0, 反应正向自发进行。 【 思考讨论 】 (1) 判断反应①的正向自发进行的最高温度为多少 ? 提示 : 276.42K 。 ΔH-TΔS<0 反应才能自发进行 , 因此有 -48.97 kJ·mol -1 -T× (-177.16×10 -3 kJ·mol -1 ·K -1 )<0, 解得 T<276.42K 。因此反应在温度低于 276.42K 时反应正向自发进行。 (2) 判断反应①的副反应正向自发进行的最低温度为多少 ? 提示 : 978.37K 。 ΔH-TΔS<0 反应才能自发进行 , 因此有 +41.17kJ·mol -1 -T× (+42.08×10 -3 kJ·mol -1 ·K -1 )<0, 解得 T>978.37K 。因此反应在温度高于 978.37K 时正向自发进行。 【 探究总结 】 反应能否自发进行的判断方法 (1) 当 ΔH<0,ΔS>0 时 , 反应正向一定能自发进行。 (2) 当 ΔH>0,ΔS<0 时 , 反应正向一定不能自发进行。 (3) 当 ΔH<0,ΔS<0 时 , 在低温下反应正向能自发进行。 (4) 当 ΔH>0,ΔS>0 时 , 在高温下反应正向能自发进行。 【 迁移应用 】 1.(2020· 银川高二检测 ) 用钌的配合物作催化剂 , 一定条件下可直接光催化分 解 CO 2 发生反应 :2CO 2 (g) 2CO(g)+O 2 (g) 。下列有关焓变与熵变说法不正 确的是 ( ) A. 该反应的 ΔS>0 B. 该反应的 ΔH<0 C. 该反应的逆反应在一定条件下也能自发进行 D. 该反应的熵变效应大于焓变效应 催化剂 ==== 【 解析 】 选 B 。该反应是一个气体分子数增多的反应 , 也就是一个熵增的反应 ,A 正确。该反应是分解反应 , 且该反应的逆反应是 CO 的燃烧 , 是放热反应 , 所以该反应是吸热反应 ,B 错误。虽然该反应的逆反应是熵减反应 , 但反应放热 , 一定条件下可以自发进行 ,C 正确。该反应 ΔS>0,ΔH>0, 能自发进行说明熵变的影响大于焓变 ,D 正确。 2.(2020· 濮阳高二检测 ) 下列说法不正确的是 ( ) A.Na 与 H 2 O 的反应是熵增的放热反应 , 该反应能自发进行 B. 某吸热反应能自发进行 , 因此该反应是熵增反应 C.(NH 4 ) 2 CO 3 在室温下就能自发的分解 , 说明该反应的 ΔS<0 D.2NO(g)+2CO(g)====N 2 (g)+2CO 2 (g) 常温下能自发进行 , 说明该反应的 ΔH<0 【 解析 】 选 C 。 (NH 4 ) 2 CO 3 ====2NH 3 ↑+CO 2 ↑+H 2 O 为 ΔS>0 的反应。 3.(2020· 吴忠高二检测 ) 下列对化学反应预测正确的是 ( ) 选项 化学反应方程式 已知条件 预测 A M(s)====X(g)+Y(s) ΔH>0 它是非自发反应 B W(s)+xG(g)====2Q(g) ΔH<0, 自发 反应 x 可能等于 1 、 2 、 3 C 4X(g)+5Y(g)====4W(g)+6G(g) 能自发反应 ΔH 一定小于 0 D 4M(s)+N(g)+2W(l)====4Q(s) 常温下 , 自发 进行 ΔH>0 【 解析 】 选 B 。 A 项 ,ΔH>0,ΔS>0, 高温下该反应能自发进行 ;C 项 , 该反应 ΔS>0, 若使 ΔH-TΔS<0,ΔH 可能大于 0 也可能小于 0;D 项 , 该反应 ΔS<0, 若常温下自发进行 , 则 ΔH<0 才能使 ΔH-TΔS<0 。 项目活动 2: 选择适宜的反应条件 通过上述的分析可以通过反应①利用二氧化碳和氢气合成甲醇 , 反应如下 CO 2 (g)+3H 2 (g)====CH 3 OH(g)+H 2 O(g) ΔH=-48.97kJ·mol -1 。 【 活动探究 】 1. 利用所学知识分析如何提高反应的速率和甲醇的产率 ? 提示 : 提高 CO 2 和 H 2 的浓度、加压、升高温度 , 使用催化剂均可以加快反应的速率。从化学平衡角度提高 CO 2 和 H 2 的浓度、降低 CH 3 OH 和 H 2 O 的浓度、加压、降低温度均有利于化学平衡向右移动 , 能够提高甲醇的产率。 2. 在一定条件下测得不同的 H 2 和 CO 2 投料比体系中甲醇的产率如下 : 不同 n(H 2 )∶n(CO 2 ) 对反应的影响 注 :α 为转化率 ,φ 为产率 , 反应条件为温度 553 K 、总压 2MPa, 无催化剂。 n(H 2 )∶n(CO 2 ) 2 3 5 7 α(CO 2 )/% 11.63 13.68 15.93 18.71 φ(CH 3 OH)/% 3.04 4.12 5.26 6.93 从上述数据中你能得到什么结论 ? 提示 : 从上述表格中能够得到的结论是增大氢气的比例可以提高 CO 2 的转化率和甲醇的产率。 3. 下图分别是压强和温度对反应①中甲醇产率的影响。 (1) 在实际生产中是不是压强越大越好 ? 提示 : 不是。要考虑生产的实际 , 选择合适的压强 , 如动力和设备的承受力等方面。 (2) 请分析甲醇的产率在温度为 523K 时最高的原因。 提示 : 在 523K 之前 , 随温度的升高反应速率加快 , 使甲醇产率增大 ; 超过 523K 时 , 甲醇的产率降低的原因可能是催化剂的活性降低、副反应的发生等。 4. 下图是不同的催化剂组成对甲醇产率的影响和选择性的影响。 催化剂组成改变对甲醇产率和选择性的影响 组成 CuO/ (wt.%) ZnO/ (wt.%) Al 2 O 3 / (wt.%) ZrO 2 / (wt.%) MnO/ (wt.%) φ (CH 3 OH)/ [g·(kg- 催化 剂 ) -1 ·h -1 ] 选择性 /% CuO/ZnO/ Al 2 O 3 65.8 26.3 7.9 0 0 78 40 CuO/ZnO/ ZrO 2 62.4 25.0 0 12.6 0 96 88 CuO/ZnO/ ZrO 2 /MnO 65.8 26.6 0 3.6 4 88 100 CuO/ZnO/ ZrO 2 /MnO 65.8 26.6 0 5.6 2 138 91 注 : 反应条件为 n(H 2 )∶n(CO 2 )=3, 温度 553 K, 总压 4MPa;wt.%: 重量百分含量 ; 选择性 : 生成甲醇的二氧化碳在全部二氧化碳反应物中所占比例。 从表格中的数据能得出什么结论 ? 提示 : 改变催化剂的组成 , 可以有效地提高甲醇的产率和选择性。 【 思考讨论 】 (1) 压强的改变对反应①的副反应有何影响 ? 提示 : 从速率角度看 , 压强的改变会改变其反应速率 ; 但是由于此反应前后气体的系数相等 , 因此压强的改变对平衡没有影响。 (2) 在实际生产中适宜温度的选择原则是什么 ? 提示 : 在实际生产中温度的选择要考虑催化剂的催化活性 , 要使催化剂的活性最大。 【 探究总结 】 化工生产适宜条件选择的一般原则 条件 原则 从化学反应速率分析 既不能过快 , 又不能太慢 从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性 , 又要注意二者影响的矛盾性 从原料的利用率分析 增加易得廉价原料 , 提高难得高价原料的利用 率 , 从而降低生产成本 从实际生产能力分析 如设备承受高温、高压能力等 从催化剂的使用活性分析 注意催化剂的活性对温度的限制 【 迁移应用 】 1.(2020· 昆明高二检测 ) 低温脱硝技术可用于处理废气中的氮氧化物 , 发生的 化学反应为 2NH 3 (g)+NO(g)+NO 2 (g) 2N 2 (g)+3H 2 O(g) ΔH<0 。 在恒容的密闭容器中 , 下列有关说法正确的是 ( ) A. 平衡时 , 其他条件不变 , 升高温度可使该反应的平衡常数增大 B. 平衡时 , 其他条件不变 , 增加 NH 3 的浓度 , 废气中氮氧化物的转化率减小 C. 单位时间内消耗 NO 和 N 2 的物质的量比为 1∶2 时 , 反应达到平衡 D. 其他条件不变 , 使用高效催化剂 , 废气中氮氧化物的转化率增大 【 解析 】 选 C 。由于该反应为放热反应 , 升高温度时 , 平衡左移 , 该反应的平衡常数减小 ,A 错 ; 增大一种反应物的浓度 , 自身的转化率降低 , 而另外反应物的转化率增大 ,B 错 ; 单位时间内消耗 NO 和 N 2 的物质的量之比为 1∶2 时 , 说明 v 正 =v 逆 , 反应达到平衡 ,C 正确 ; 催化剂只能改变反应速率 , 不能使平衡发生移动 , 即不能改变转化率 ,D 错。 2.(2020· 晋江高二检测 ) 在催化剂作用下 , 用乙醇制乙烯 , 乙醇转化率和乙烯选择性 ( 生成乙烯的物质的量与乙醇转化的物质的量的比值 ) 随温度、乙醇进料量 ( 单位 :mL·min -1 ) 的关系如图所示 ( 保持其他条件相同 ) 。 在 410 ~ 440 ℃ 温度范围内 , 下列说法不正确的是 ( ) A. 当乙醇进料量一定时 , 随乙醇转化率增大 , 乙烯选择性升高 B. 当乙醇进料量一定时 , 随温度的升高 , 乙烯选择性不一定增大 C. 当温度一定时 , 随乙醇进料量增大 , 乙醇转化率减小 D. 当温度一定时 , 随乙醇进料量增大 , 乙烯选择性增大 【 解析 】 选 A 。根据图象 , 当乙醇进料量一定时 , 随乙醇转化率增大 , 乙烯选择性逐渐升高 , 但达到一定温度后 , 乙烯选择性都逐渐降低 , 故 A 项错误、 B 项正确 ; 根据题中第一个图 , 当温度一定时 , 随乙醇进料量增大 , 乙醇转化率减小 , 故 C 项正确 ; 根据题中第二个图 , 当温度一定时 , 随乙醇进料量增大 , 乙烯选择性增大 , 故 D 项正确。 3.(2020· 东城区高二检测 ) 一定条件下 , 用 Fe 2 O 3 、 NiO 或 Cr 2 O 3 作催化剂对燃煤烟气进行回收 , 使 SO 2 转化生成 S 。催化剂不同 , 相同其他条件 ( 浓度、温度、压强 ) 情况下 , 相同时间内 SO 2 的转化率随反应温度的变化如图 , 下列说法不正确的是 ( ) A. 不考虑催化剂价格因素 , 选择 Fe 2 O 3 作催化剂可以节约能源 B. 相同其他条件下 , 选择 Cr 2 O 3 作催化剂 ,SO 2 的平衡转化率最小 C.a 点后 SO 2 的转化率减小的原因可能是温度升高 , 催化剂活性降低了 D. 选择 Fe 2 O 3 作催化剂 , 最适宜温度为 340 ~ 380 ℃ 温度范围 【 解析 】 选 B 。根据图象可知 , 当温度在 340 ℃ 时 , 在 Fe 2 O 3 作催化剂条件下 , 反应先达到平衡 ,SO 2 的平衡转化率最大 ,A 正确 ; 相同其他条件下在 260 ℃ 、 300 ℃ 时 , 选择 Cr 2 O 3 作催化剂 ,SO 2 的转化率均不是最小的 ,B 错误 ; 催化剂催化能力需要维持在一定的温度下 , 温度太高 , 催化剂活性可能会降低 ,C 正确 ;340 ~ 380 ℃ 温度范围内 ,Fe 2 O 3 的催化能力最大 , 二氧化硫的转化率也是最大 , 反应速率最快 ,D 正确。 课堂检测 · 素养达标 1.(2020· 潍坊高二检测 ) 下列有关化学反应方向及其判据的说法中正确的是 ( ) A. 非自发反应就是不可能发生的反应 , 自发反应就是能较快进行的反应 B. 高温、高压下可以使石墨转化为金刚石是自发的化学反应 C. 由能量判据和熵判据组合而成的复合判据适合于所有的反应 D. 反应 NH 3 (g)+HCl(g)====NH 4 Cl(s) 在低温下能自发进行 , 说明该反应的 ΔH>0 【 解析 】 选 C 。 A 项 , 非自发反应在一定条件下也能发生 , 自发反应进行的也不一定较快 , 错误 ;B 项 , 石墨转化为金刚石 ,ΔH>0, 该反应是非自发进行的化学反应 , 错误 ;C 项 , 能量判据和熵判据组合而成的复合判据 , 只要 ΔH-TΔS<0, 反应就可以自发进行 , 若 ΔH-TΔS>0, 反应就不能自发进行 , 正确 ;D 项 , 反应 NH 3 (g)+HCl(g) ====NH 4 Cl(s) 在低温下能自发进行 ,ΔH-TΔS<0, 从化学方程式知 TΔS<0, 说明 ΔH<0, 错误。 【 补偿训练 】 (2020· 盐城高二检测 ) 将煤气化后所得的重要产品之一是甲醇。其制备反应 : CO(g) +2H 2 (g) CH 3 OH(g) ΔH<0 。为了增加甲醇的产量 , 同时保证较高的 生产效率。工厂应采取的正确措施是 ( ) A. 高温、高压 B. 适宜温度、高压、催化剂 C. 低温、低压、不断分离出甲醇 D. 低温、高压、催化剂 【 解析 】 选 B 。 ΔH<0 表明此反应为放热反应 , 不能加太高的温度但温度不能太低 , 温度太低反应速率太低 ; 正反应方向是气体体积减小的方向 , 所以可以加压使化学平衡正向移动 ; 另外选择合适的催化剂加快反应速率。 2.(2020· 佛山高二检测 ) 以甲醇为原料在一定条件下合成乙烯 ,2CH 3 OH(g) C 2 H 4 (g)+2H 2 O(g) 。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同 种催化剂 , 不同温度得到如下图象 , 则下列结论不正确的是 世纪金榜导学 号 ( ) A. 一段时间后甲醇反应率下降可能是催化剂活性下降 B. 综合图 1 、图 2 可知 , 甲醇还发生了其他反应 C. 若改变甲醇蒸气的流速 , 不会影响甲醇反应率和乙烯产率 D. 制乙烯比较适宜的温度是 450 ℃ 左右 【 解析 】 选 C 。 催化剂活性是受温度影响的 , 温度太高 , 催化剂会失去活性 , 故 A 正确 ; 根据 2CH 3 OH(g) C 2 H 4 (g)+2H 2 O(g), 由图 1 知 450 ℃ 时甲醇的反应速率 比 400 ℃ 快 , 图 2450 ℃ C 2 H 4 (g) 的产率低于 400 ℃ 的产率 , 所以有其他反应发生 , 故 B 正确 ; 若改变甲醇蒸气的流速 , 甲醇反应率和乙烯产率都将改变 , 故 C 错 ; 由 图 2 知 450 ℃ 左右制乙烯产率比较高 , 故 D 正确。 3.(2020· 宁波高二检测 ) 工业上主要利用碳热还原重晶石制得硫化钡 , 进而生产各种钡化合物。如图为不同反应温度下 , 实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是 ( ) A. 约 150 ℃, 体系中开始出现 BaS, 说明温度越高反应速率越快 B.400 ℃ 时发生的化学反应方程式 :BaSO 4 +2C BaS+2CO 2 ↑ C.CO 一定无法还原重晶石 D. 温度高于 400 ℃ 后 , 硫酸钡才能转化为 BaS △ ==== 【 解析 】 选 B 。根据图象 , 约在 150 ℃ 时 , 体系中开始出现 BaS, 说明反应在 150 ℃ 开始反应 , 不能说明温度越高反应速率越快 , 故 A 错误 ; 根据图象在 400 ℃ 时 BaSO 4 物质的量分数为 0,C 的物质的量百分数减小 ,BaS 物质的量百分数增大 , CO 2 的物质的量分数增大 , 因此 400 ℃ 时发生反应的反应物是 BaSO 4 和 C, 生成物是 CO 2 和 BaS, 反应方程式为 BaSO 4 +2C BaS+2CO 2 ↑, 故 B 正确 ; 根据图象 400 ℃ 时 , CO 的物质的量分数为 0, 结合加热时 C 与 CO 2 反应生成 CO, 则 CO 能还原 BaSO 4 , 故 C 错 误 ; 根据图象 , 在 150 ℃ 左右 BaSO 4 转化成 BaS, 故 D 错误。 △ ==== 4.(2020· 长沙高二检测 ) 在一定条件下探究二甲醚的制备反应为 2CO(g)+ 4H 2 (g) CH 3 OCH 3 (g)+H 2 O(g) ΔH, 测定结果如图所示。下列判断错误的是 ( ) A. 该反应的 ΔH<0 B. 该反应伴随着副反应的发生 C. 工业选择的较适宜温度为 280 ~ 290 ℃ D. 加入催化剂可以提高 CH 3 OCH 3 的产率 【 解析 】 选 D 。由题图知 , 随着温度升高 ,CO 的转化率降低 , 所以升高温度 , 平衡逆向移动 , 则该反应是放热反应 ,ΔH<0,A 项正确 ; 从图中可知 ,CO 的转化率降低的同时 ,CH 3 OCH 3 的产率在不同温度下差别大 , 即说明该反应伴随着副反应的发生 ,B 项正确 ; 在 280 ~ 290 ℃ 间 ,CH 3 OCH 3 的产率很高 , 工业选择的较适宜温度为 280 ~ 290 ℃,C 项正确 ; 加入催化剂可以改变反应达到平衡的时间 , 但不能提高 CH 3 OCH 3 的产率 ,D 项错误。 5.(2020· 泰安高二检测 ) 甲醇是一种重要的试剂 , 氢气和二氧化碳在一定条件 下可合成甲醇 :CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g), 在密闭容器中充入 3 mol 氢气和 1 mol 二氧化碳 , 测得混合气体中甲醇的体积分数与温度的关系如图 A 所 示 : 试回答下列问题 : 世纪金榜导学号 (1) 该反应是 ________( 填“放热”或“吸热” ) 反应。该反应平衡常数的表达式是 _______________________, 为了降低合成甲醇的成本可采用的措施是 ________________ 。 ( 任意写一条合理的建议 ) (2) 解释 0 ~ T 0 内 , 甲醇的体积分数变化趋势 :___________________________ 。 (3) 氢气在 Q 点的转化率 ________( 填“大于”“小于”或“等于” , 下同 ) 氢气在 W 点的转化率 ; 其他条件相同 , 甲醇在 Q 点的正反应速率 ________ 甲醇在 M 点的正反应速率。 (4) 图 B 表示氢气转化率 α(H 2 ) 与投料比 的关系 , 请在图 B 中画出两条 变化曲线并标出曲线对应的条件 , 两条曲线对应的条件分别为一条曲线对应的 压强是 1.01×10 5 Pa; 另一条曲线对应的压强是 3.03×10 5 Pa( 其他条件相同 ) 。 【 解析 】 (1)T 0 时 , 升高温度 , 甲醇的体积分数减小 , 平衡逆向移动 , 正反应为放热 反应 ; 该反应平衡常数的表达式为 K= , 为了降低合成甲醇 的成本 , 应该尽可能的使平衡向右移动 , 可采用的措施有增加 CO 2 的充入量等 ; (2) 温度低于 T 0 时 , 反应未达到平衡 , 反应正向进行 , 使甲醇的体积分数逐渐增大 ; (3) 温度低于 T 0 时 , 反应未达到平衡 , 反应正向进行 , 氢气在 Q 点的转化率小于平衡 时的转化率 ,W 点达到平衡 , 因此氢气在 Q 点的转化率小于 W 点的转化率 ; 平衡之前 , 甲醇的正反应速率逐渐增大 , 甲醇在 Q 点的正反应速率小于 W 点的反应速率 , 升高 温度 , 反应速率增大 , 甲醇在 M 点的正反应速率大于 W 点 , 因此甲醇在 Q 点的正反应 速率小于在 M 点的正反应速率 ; (4) 根据方程式 , 增大压强 , 平衡正向移动 , 氢气转化率 α(H 2 ) 增大 , 增大投料 比 , 氢气转化率 α(H 2 ) 减小 , 画出相应曲线。 答案 : (1) 放热 K= 增加 CO 2 的充入量 (2) 温度低于 T 0 时 , 反应未达到平衡 , 反应正向进行 , 使甲醇的体积分数逐渐增大 (3) 小于 小于 (4) 课题任务 : 丙烯腈生产条件的选择 【 情境创设 】 聚丙烯腈纤维 ( 腈纶 ) 广泛用来代替羊毛 , 或与羊毛混纺制成毛织物等 , 可代替部分羊毛制作毛毯和地毯等织物 , 因此俗称人造羊毛。合成聚丙烯腈的单体是丙烯腈 , 丙烯腈是一种重要的有机合成单体 , 是多种有机高聚物的原料。 课题探究 · 素养提升 目前 , 工业上合成丙烯腈的主要方法是丙烯氨氧化法。主要分两步进行 : (1) 丙烷脱氢制丙烯 ; (2) 丙烯氨氧化生成丙烯腈。 【 素养解读 】 1. 核心素养 : (1) 变化观念与平衡思想 : 认识化学变化有一定限度、速率 , 是可以调控的。能多角度、动态地分析化学变化 , 运用化学反应原理解决简单的实际问题。 (2) 证据推理与模型认知 : 建立观点、结论和证据之间的逻辑关系。通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系 , 建立认知模型 , 并能运用模型解释化学现象 , 揭示现象的本质和规律。 2. 素养目标 : 通过丙烯腈生产条件的选择 , 了解化学反应方向、限度、速率在化学生产中的应用。 【 素养探究 】 【 探究一 】 丙烷脱氢制丙烯反应的研究 1. 丙烷脱氢制丙烯时可能发生的反应如下 : 主反应 : ①C 3 H 8 (g)====C 3 H 6 (g)+H 2 (g) ΔH=+125 kJ·mol -1 副反应 : ②C 3 H 8 (g)====C 2 H 4 (g)+CH 4 (g) ΔH=+81 kJ·mol -1 ③C 2 H 4 (g)+H 2 (g)====C 2 H 6 (g) Δ H=-137 kJ·mol -1 ④C 3 H 8 (g)+H 2 (g)====C 2 H 6 (g)+CH 4 (g) Δ H=-56 kJ·mol -1 (1) 分析主反应和副反应正向能否自发进行。 提示 : 根据 ΔH-TΔS 可以判断 , 升高温度有利于主反应和副反应②的自发进行 , 而降温有利于副反应③和④的自发进行。 (2) 工业生产中通常采用在反应体系中通入一定量的水蒸气 , 实验测得 , 常压下丙烷脱氢的平衡转化率 y% 与温度 T 、水烃比 M 的关系如图 : ① 从图中可以得出什么结论 ? 提示 : 从图中的变化趋势 , 可以得出 : 相同温度下 , 水烃比 M 越大 , 丙烷的平衡转化率越高 ; 水烃比 M 一定时 , 温度越高 , 丙烷的平衡转化率越高。 ②在实际的工业生产中应怎样利用上述结论 ? 提示 : 可以向体系中通入高温水蒸气的方式来提高丙烷的转化率。 2. 研究发现 , 随温度的升高 , 丙烷的平衡转化率提高 , 但是丙烯的产率却降低 , 原因可能是丙烷裂解加剧 , 从而使丙烯的选择性降低 , 同时生成单质碳附着在催化剂表面而失活。通常 , 工业上采用向体系中加入氧化剂 —— 氧气或二氧化碳的方式解决此问题。 请你分析引入氧化剂 CO 2 时 , 对丙烷脱氢制丙烯有何影响 ?( 注 :CO 2 (g)+H 2 (g)==== CO(g)+H 2 O(g) ΔH=-41 kJ·mol -1 ) 提示 : (1) 通入 CO 2 后会与体系内的 H 2 发生反应 , 从而降低氢气的浓度 , 有利于提高主反应的平衡转化率 ; (2) 在高温下 CO 2 可以与催化剂表面的碳反应 , 有利于催化剂活性的保持 ; (3)CO 2 与 H 2 的反应为放热反应 , 有利于降低能耗。 【 探究二 】 探究丙烯氨氧化法制丙烯腈 工业上可用“丙烯氨氧化法”生产 , 主要副产物有丙烯醛 (CH 2 = CHCHO) 和乙腈 (CH 3 CN) 。反应如下 : ①C 3 H 6 (g)+NH 3 (g)+ O 2 (g)====C 3 H 3 N(g)+3H 2 O(g) ΔH=-515 kJ·mol -1 ②C 3 H 6 (g)+O 2 (g)====C 3 H 4 O(g)+H 2 O(g) ΔH=-353 kJ·mol -1 1. 两个反应在热力学上趋势均很大 , 分析其原因。分析有利于提高丙烯腈平衡 产率的反应条件有哪些 ? 提示 : 因为两个反应均为放热量大的反应 , 所以热力学趋势大 ; 反应①为气体体积增大的放热反应 , 所以降低温度、降低压强有利于反应正向进行 , 从而提高丙烯腈的平衡产率。 2. 下图为丙烯腈产率与反应温度的关系曲线 , 分析丙烯腈的产率随温度变化的原因。 提示 : 因为该反应为放热反应 , 平衡产率应随温度升高而降低 , 反应刚开始进行 , 尚未达到平衡状态 ,460 ℃ 以前是建立平衡的过程 , 所以随温度的升高 , 丙烯腈的产率逐渐升高 ; 高于 460 ℃ 时 , 丙烯腈产率降低。原因可能有 :① 反应放热 , 平衡产率应随温度升高而降低 ;② 催化剂在一定温度范围内活性较高 , 若温度过高 , 活性降低 ;③ 根据题意 , 副产物有丙烯醛 , 副反应增多导致产率下降。 3. 丙烯腈和丙烯醛的产率与 n( 氨 )/n( 丙烯 ) 的关系如图所示。 请分析最佳 n( 氨 )/n( 丙烯 ) 约为多少 ? 简述理由。 提示 : 根据图象可知 , 当 n( 氨 )/n( 丙烯 ) 约为 1.0 时 , 该比例下丙烯腈产率最高 , 而副产物丙烯醛产率最低。 【 探究三 】【 迁移应用 】 1. 分析丙烯腈的生产过程中提高丙烯腈反应选择性的关键因素是什么 ? 提示 : 催化剂。由于主反应①为气体体积增大的放热反应 , 副反应②为气体体积 不变的放热反应 , 因此温度和压强的改变无法对这两个反应区分 , 只能通过催化 剂来提高丙烯腈的选择性。 2. 分析工业生产丙烯腈时最佳的进料气氨、丙烯、空气的理论体积比是多少 ? 提示 : 根据化学反应 C 3 H 6 (g)+NH 3 (g)+ O 2 (g)====C 3 H 3 N(g)+3H 2 O(g), 氨、丙烯、 氧气按 2∶2∶3 的体积比加入反应达到最佳状态 , 而空气中氧气约占 20%, 所以进 料气氨、丙烯、空气的理论体积约为 2∶2∶15, 即 1∶1∶7.5 。 【 素养评价 】 1. 变化观念与平衡思想 —— 水平 1: 能根据观察和实验获得的现象和数据概括化学变化发生的条件、特征与规律。 2. 变化观念与平衡思想 —— 水平 3: 认识反应条件对化学反应速率和化学平衡的影响 , 能运用化学反应原理分析影响化学变化的因素。 3. 证据推理与模型认知 —— 水平 3: 能从定性与定量结合上收集证据 , 能通过定性分析和定量计算推出合理的结论。 4. 证据推理与模型认知 —— 水平 4: 能对复杂的化学问题情境中的关键要素进行分析以建构相应的模型 , 能选择不同模型综合解释或解决复杂的化学问题。 5. 变化观念与平衡思想 —— 水平 1: 能根据观察和实验获得的现象和数据概括化学变化发生的条件、特征与规律。 6. 变化观念与平衡思想 —— 水平 3: 认识反应条件对化学反应速率和化学平衡的影响 , 能运用化学反应原理分析影响化学变化的因素。 7. 证据推理与模型认知 —— 水平 3: 能从定性与定量结合上收集证据 , 能通过定性分析和定量计算推出合理的结论。 8. 科学态度与社会责任 —— 水平 3: 依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。查看更多