- 2021-08-24 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习电解池 金属的腐蚀与防护学案(1)
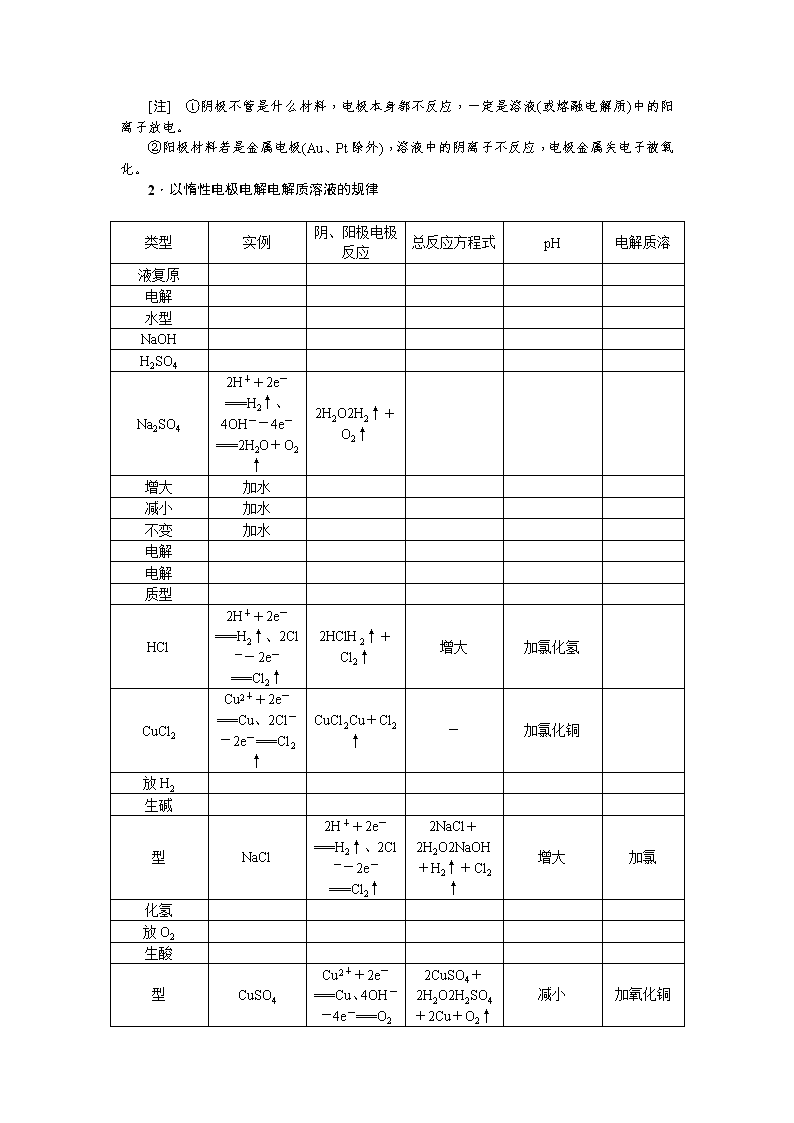
第三节 电解池 金属的腐蚀与防护 [高考备考指南] 考纲定位 1.理解电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。 2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。 核心素养 1.实验探究——发现和提出有价值的化学问题(电解实验探究)能依据目的设计并优化方案,完成实验操作。 2.社会责任——关注化学有关热点问题(电解法处理废水、冶炼金属、金属防护等),具有可持续发展的意识。 电解原理及规律 (对应复习讲义第74页) 1.电解 2.电解池 (1)定义:电解池是把电能转变为化学能的装置。 (2)电解池的构成条件: ①有外接直流电源。 ②有与电源相连的两个电极。 ③形成闭合回路。 ④电解质溶液或熔融电解质。 (3)电解池工作原理(以电解CuCl2溶液为例) (4)电解原理示意图 1.两极放电(氧化或还原)顺序 (1)阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。 (2)阳极:金属(Au、Pt除外)电极>S2->I->Br->Cl->OH->含氧酸根离子。 [注] ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。 ②阳极材料若是金属电极(Au、Pt除外),溶液中的阴离子不反应,电极金属失电子被氧化。 2.以惰性电极电解电解质溶液的规律 类型 实例 阴、阳极电极反应 总反应方程式 pH 电解质溶 液复原 电解 水型 NaOH H2SO4 Na2SO4 2H++2e-===H2↑、4OH--4e-===2H2O+O2↑ 2H2O2H2↑+O2↑ 增大 加水 减小 加水 不变 加水 电解 电解 质型 HCl 2H++2e-===H2↑、2Cl--2e-===Cl2↑ 2HClH2↑+Cl2↑ 增大 加氯化氢 CuCl2 Cu2++2e-===Cu、2Cl--2e-===Cl2↑ CuCl2Cu+Cl2↑ - 加氯化铜 放H2 生碱 型 NaCl 2H++2e-===H2↑、2Cl--2e-===Cl2↑ 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 增大 加氯 化氢 放O2 生酸 型 CuSO4 Cu2++2e-===Cu、4OH--4e-===O2 2CuSO4+2H2O2H2SO4+2Cu+O2↑ 减小 加氧化铜 ↑+2H2O 角度1 电解原理分析 1.如图所示为用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是TiO2中的氧解离进入熔融盐中而得到纯钛。下列说法中正确的是( ) A.a极是正极,石墨极是阴极 B.反应后,石墨电极的质量不发生变化 C.电解过程中,O2-、Cl-均向a极移动 D.阴极的电极反应式为TiO2+4e-===Ti+2O2- D [TiO2发生还原反应得到纯钛,故加入高纯TiO2的电极是电解池的阴极,a极是电源的负极,石墨极是阳极,A项错误;O2-在阳极发生氧化反应生成O2,高温下,石墨与O2反应生成CO、CO2,导致石墨质量减小,B项错误;电解过程中,阴离子向阳极(石墨极)移动,C项错误;TiO2中的氧解离进入熔融盐而得到纯钛,发生了还原反应,生成了Ti和O2-,D项正确。] 2.如图所示,在一定电压下用惰性电极电解由等物质的量浓度的FeCl2、HCl组成的混合溶液。已知在此电压下,阴、阳离子根据放电能力顺序,都可能在阳极放电,下列分析正确的是( ) A.C1电极上的电极反应式为2H2O+2e-===2OH-+H2↑ B.C1电极处溶液首先变黄色 C.C2电极上可依次发生的电极反应为Fe2+-e-===Fe3+、2Cl--2e-===Cl2↑ D.当C1电极上有2 g物质生成时,就会有2NA个电子通过溶液发生转移 C [C1电极与电源的负极相连,作阴极,溶液中的H+在阴极放电,电极反应式为2H++2e-===H2↑,A错误;C1电极上H+放电生成H2,C2电极与电源的正极相连,作阳极,Fe2+的还原性强于Cl-,则依次发生的电极反应为Fe2+-e-===Fe3+、2Cl--2e-===Cl2↑,故C2电极处溶液先变黄色,B错误,C正确;电子只能通过导线传递,不能通过溶液传递,D错误。] 阴、阳极的判断方法 (1)根据外接电源:正极连阳极,负极连阴极。 (2)根据电流方向:从阴极流出,从阳极流入。 (3)根据电子流向:从阳极流出,从阴极流入。 (4)根据离子流向:阴离子移向阳极,阳离子移向阴极。 (5)根据电极产物:a.阳极:电极溶解、逸出O2(或极区变酸性)或Cl2;b.阴极:析出金属、逸出H2(或极区变碱性)。 角度2 电解池中电极反应式与电解方程式的书写 3.按要求书写 (1)用惰性电极电解AgNO3溶液 阳极反应式:________________________________________________________________________; 阴极反应式:________________________________________________________________________; 总反应离子方程式________________________________________________________________________。 (2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为________________________________________________________________________; 阴极反应式为________________________________________________________________________。 (3)用惰性电极电解MgCl2溶液 阳极反应式:________________________________________________________________________; 阴极反应式:________________________________________________________________________; 总反应离子方程式:________________________________________________________________________。 (4)用铁作电极电解NaOH溶液 阳极反应式:________________________________________________________________________; 阴极反应式:________________________________________________________________________; 总反应方程式:________________________________________________________________________。 (5)惰性电极电解浓度均为0.1 mol/L的NaCl和CuSO4的等量混合液,电解过程分三个阶段,写出三个阶段的两极反应式:第一阶段:__________,__________;第二阶段:__________,__________;第三阶段:____________,__________。 [答案] (1)4OH--4e-===O2↑+2H2O 4Ag++4e-===4Ag 4Ag++2H2O4Ag+O2↑+4H+ (2)2Al-6e-+3H2O===Al2O3+6H+ 6H++6e-===3H2↑ (3)2Cl--2e-===Cl2↑ 2H++2e-===H2↑ Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑ (4)Fe-2e-+2OH-===Fe(OH)2 2H++2e-===H2↑ Fe+2H2OFe(OH)2+H2↑ (5)第一阶段: 阴极:Cu2++2e-===Cu 阳极:2Cl--2e-===Cl2↑ 第二阶段: 阴极:Cu2++2e-===Cu 阳极:4OH--4e-===2H2O+O2↑ 第三阶段: 阴极:2H++2e-===H2↑ 阳极:4OH--4e-===2H2O+O2↑ 书写电解池电极方程式的常见失分点 (1)阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。 (2)要确保两极电子转移数目相同,且总反应式注明条件“电解”。 (3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。 电解原理的应用 (对应复习讲义第75页) 1.氯碱工业 (1)电极反应 阳极反应式:2Cl--2e-===Cl2↑(氧化反应) 阴极反应式:2H++2e-===H2↑(还原反应) (2)总反应方程式 2NaCl+2H2O2NaOH+H2↑+Cl2↑ (3)氯碱工业生产流程图 2.电镀与电解精炼铜 电镀 (Fe上镀Cu) 电解精炼铜 阳极 电极 材料 Cu 粗铜(含Zn、Fe、Ni、 Ag、Au等杂质) 电极 反应 Cu-2e-===Cu2+ Cu-2e-===Cu2+(主) Zn-2e-===Zn2+ Fe-2e-===Fe2+ Ni-2e-===Ni2+ 阴极 电极材料 Fe 纯铜 电极反应 Cu2++2e-===Cu 电解质溶液 CuSO4溶液 电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 3.电冶金 利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。 (1)冶炼钠 2NaCl(熔融)2Na+Cl2↑ 电极反应: 阳极:2Cl--2e-===Cl2↑; 阴极:2Na++2e-===2Na。 (2)冶炼铝 2Al2O3(熔融)4Al+3O2↑ 电极反应: 阳极:6O2--12e-===3O2↑; 阴极:4Al3++12e-===4Al。 (1)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变。( ) (2)电解饱和食盐水时,两个电极均不能用金属材料。( ) (3)电解冶炼镁、铝通常电解熔融MgCl2和Al2O3,也可以电解熔融MgO和AlCl3。( ) (4)电解精炼时,阳极泥可以作为提炼贵重金属的原料。( ) (5)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌。( ) [提示] (1)× (2)× (3)× (4)√ (5)× 角度1 电解原理的一般应用 1.(1)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为 ________________________________________________________________________; 若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为________________________________________________________________________。 (2)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。 a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应 c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属 [答案] (1)c Cu2++2e-===Cu Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解质溶液中 (2)bd 2.利用 LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。 利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________,电解过程中Li+向__________电极迁移(填“A”或“B”)。 [解析] 根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,B极区产生H2,电极反应式为2H++2e-===H2↑,剩余OH-与Li+结合生成LiOH,所以B极区电解液应为LiOH溶液,B电极为阴极,则A电极应为阳极。阳极区电解液应为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑。根据电流方向,电解过程中Li+向B电极迁移。 [答案] LiOH 2Cl--2e-===Cl2↑ B 角度2 电解原理的创新应用 3.(2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4 H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 C [该电解池阳极发生的电极反应为2Al+3H2O-6e-===Al2O3+6H+,铝化合价升高失电子,所以待加工铝质工件应为阳极,A正确。 阴极发生的电极反应为2H++2e-===H2↑,阴极可选用不锈钢网作电极,B正确,C错误。 电解质溶液中的阴离子向阳极移动,D正确。] 4.(2016·全国卷Ⅰ)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A.通电后中间隔室的SO向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成 B [A项,正极区发生的反应为2H2O-4e-===O2↑+4H+,由于生成H+,正极区溶液中阳离子增多,故中间隔室的SO向正极迁移,正极区溶液的pH减小。B项,负极区发生的反应为2H2O+2e-===H2↑+2OH-,阴离子增多,中间隔室的Na+向负极迁移,故负极区产生NaOH,正极区产生H2SO4。C项,由B项分析可知,负极区产生OH-,负极区溶液的pH升高。D项,正极区发生的反应为2H2O-4e-===O2↑+4H+,当电路中通过1 mol电子的电量时,生成0.25 mol O2。] 5.(2018·全国卷Ⅲ,T27(3))KIO3也可采用“电解法”制备,装置如图所示。 (1)写出电解时阴极的电极反应式________________________________________________________________________ ________________________________________________________________________。 (2)电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。 (3)与“电解法”相比,“KClO3氧化法”的主要不足之处有________________________(写出一点)。 [解析] (1)电解法制备KIO3时,H2O在阴极得到电子,发生还原反应:2H2O+2e-===2OH-+H2↑。(2)电解池中阳离子向阴极移动,即由电极a向电极b迁移,阳离子交换膜只允许阳离子通过,故主要是K+通过阳离子交换膜。(3)根据工艺流程分析,KClO3氧化法生成的Cl2有毒,且在调pH时加入KOH的量不易控制,另外,生成的KIO3中杂质较多。 [答案] (1)2H2O+2e-===2OH-+H2↑ (2)K+ 由a到b (3)产生Cl2易污染环境等 常见交换膜介绍 (1)阳离子交换膜:只允许阳离子通过,阴离子不能通过; (2)阴离子交换膜:只允许阴离子通过,阳离子不能通过; (3)质子交换膜:只允许H+通过,其他离子不能通过。 金属的腐蚀与防护 (对应复习讲义第77页) 1.金属腐蚀的本质 金属原子失去电子变为金属阳离子,金属发生氧化反应。 2.化学腐蚀与电化学腐蚀 类型 化学腐蚀 电化学腐蚀 定义 金属与接触到的干燥气体(如O2、Cl2等)或非电解质液体等直接发生化学反应引起的腐蚀 不纯金属与电解质溶液接触,会形成原电池, 较活泼的金属失去电子被氧化腐蚀 特点 无电流产生 有微弱电流产生 普遍性 金属的电化学腐蚀比较普遍,而且危害性大,腐蚀速率大 3.钢铁的析氢腐蚀与吸氧腐蚀 类型 析氢腐蚀 吸氧腐蚀 水膜酸性 较强 较弱或中性 负极反应 Fe-2e-===Fe2+ 正极反应 2H++2e- ===H2↑ O2+2H2O+4e- ===4OH- 总反应 Fe+2H+===Fe2++H2↑ 2Fe+O2+2H2O ===2Fe(OH)2 其他反应 4Fe(OH)2+O2+2H2O===4Fe(OH)3、 Fe(OH)3→Fe2O3·xH2O(铁锈) 普遍性 吸氧腐蚀更普遍 4.金属的防护 (1)电化学防护 ①牺牲阳极的阴极保护法—原电池原理 a.负极:比被保护金属活泼的金属; b.正极:被保护的金属设备。 ②外加电流的阴极保护法—电解原理 a.阴极:被保护的金属设备; b.阳极:惰性金属。 (2)改变金属的内部结构,如制成合金、不锈钢等。 (3)加保护层,如电镀、喷漆、覆膜等。 (1)钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀。( ) (2)钢铁发生电化学腐蚀的负极反应式为Fe-3e-===Fe3+。( ) (3)镀铜铁制品镀层受损后,铁制品比受损前更容易生锈。( ) (4)在潮湿空气中,钢铁表面形成水膜,金属发生的一定是吸氧腐蚀。( ) (5)铜合金中铜在酸性较强的环境中可发生析氢腐蚀。( ) [提示] (1)√ (2)× (3)√ (4)× (5)× 角度1 金属腐蚀快慢分析 1.(2019·海淀月考)下列铁制品(铁钉或钢铁管道)易被腐蚀的是( ) D [A项,Fe被电源保护;B项,钢铁输水管被Mg保护;C项,铁管道被Zn保护;D项,Cu使Fe发生电化学腐蚀。] 2.如图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( ) A.②①③④⑤⑥ B.⑤④③①②⑥ C.⑤④②①③⑥ D.⑤③②④①⑥ C [①②③④是原电池,⑤⑥是电解池,金属被腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池的正极>电解池的阴极。] 判断金属腐蚀快慢的方法 (1)对同一电解质溶液来说,腐蚀的快慢:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。 (2)对同一金属来说,腐蚀的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。 (3)活泼性不同的两种金属,活泼性差异越大,腐蚀越快。 (4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀速率越快。 角度2 金属的电化学腐蚀与防护 3.(2017·全国卷Ⅰ) 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 C [A项,外加强大的电流可以抑制金属电化学腐蚀产生的电流。 B项,被保护的钢管桩作阴极,高硅铸铁作阳极,电解池中外电路电子由阳极流向阴极,即从高硅铸铁流向钢管桩。 C项,高硅铸铁为惰性辅助阳极,其主要作用是传递电流,而不是作为损耗阳极。 D项,保护电流要抑制金属电化学腐蚀产生的电流,应根据环境条件变化进行调整。] 4.利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( ) A.a处溶液的pH增大,b处溶液的pH减小 B.一段时间后,a管液面高于b管液面 C.a管发生吸氧腐蚀,b管发生析氢腐蚀 D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+ A [左边是发生吸氧腐蚀,右边发生析氢腐蚀。a处氧气得电子和水反应生成氢氧根离子,铁失电子生成二价铁离子,氢氧根离子和二价铁离子反应生成氢氧化亚铁沉淀,所以溶液的pH变化不大,b处氢离子发生还原反应生成氢气,溶液的pH增大,故A错误。]查看更多