2018届一轮复习鲁科版水溶液中的四大常数及其应用教案
专题讲座(四)
水溶液中的四大常数及其应用
类型1 电离常数
1.概念:在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的幂乘积与溶液中未电离的分子的浓度之比是一个常数。
2.表达式:(1)对于一元弱酸HA:HAH++A-,电离常数Ka=。
(2)对于一元弱碱BOH:BOHB++OH-,电离常数Kb=。
3.影响因素:温度(升温,Ka、Kb增大)。
4.常考题型
(1)由电离常数判断酸、碱的强弱、判断某些反应能否发生。
(2)有关计算(计算电离常数、弱酸或弱碱的浓度、pH)。
[对点训练]
1.硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是( )
化学式
电离常数(298 K)
硼酸
K=5.7×10-10 mol·L-1
碳酸
K1=4.4×10-7 mol·L-1 K2=4.7×10-11 mol·L-1
醋酸
K=1.75×10-5 mol·L-1
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
D [由电离常数可知酸性:CH3COOH>H2CO3>H3BO3>HCO。A项中应生成HCO;B项中CH3COOH少量,也只生成HCO
;C项中碳酸溶液pH小;D项中CH3COOH比H2CO3易电离,故醋酸溶液pH小。]
2.已知,25 ℃时几种弱酸的电离常数如表所示:
弱酸
电离常数
弱酸
电离常数
H2CO3
Ka1=4.3×10-7
mol·L-1
Ka2=5.6×10-11
mol·L-1
H2C2O4
(草酸)
Ka1=5.9×10-2
mol·L-1
Ka2=6.4×10-5
mol·L-1
H3PO4
Ka1=7.1×10-3
mol·L-1
Ka2=6.3×10-8
mol·L-1
Ka3=4.2×10-13
mol·L-1
H3C6H5O7
(柠檬酸)
Ka1=7.4×10-4
mol·L-1
Ka2=1.7×10-5
mol·L-1
Ka3=4.0×10-7
mol·L-1
下列有关推断正确的是( )
A.溶液pH的大小关系为K3PO4>K2HPO4>KH2PO4
B.草酸溶液中存在:[HC2O]>[H+]>[C2O]>[OH-]
C.等浓度的NaHCO3、NaHC2O4溶液中前者pH较大
D.H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O
C [A项,未说明溶液的浓度,无法比较,错误;B项,H2C2O4H++HC2O,HC2OH++C2O,离子浓度大小关系为[H+]>[HC2O]>[C2O]>[OH-],错误;C项,由电离常数知,H2CO3的酸性比H2C2O4的弱,故NaHCO3的水解程度比NaHC2O4的大,则NaHCO3溶液的pH较大,正确;D项,由电离常数知,酸性H3C6H5O7>H2C6H5O>H2CO3>HC6H5O>HCO,故H3C6H5O7与Na2CO3溶液反应的产物中没有Na3C6H5O7,错误。]
3.(1)常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2[Ba2+]=[CH3COO-],则该混合溶液中醋酸的电离常数Ka=______________(用含a和b的代数式表示)。
(2)25 ℃时,H2SO3HSO+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下pH=3、c(HSO)=0.1 mol·L-1的NaHSO3溶液中[H2SO3]=________。
[解析] (1)2[Ba2+]=[CH3COO-]可知[H+]=[OH-],[CH3COO-]=2×b× mol·L-1,
Ka= mol·L-1= mol·L-1。
(2)根据Ka=知
[H2SO3]= mol·L-1=10-2 mol·L-1。
[答案] (1) mol·L-1 (2)0.01 mol·L-1
类型2 水的浓度商常数(KW)
1.概念:水或稀溶液中[H+]与[OH-]的乘积。
2.表达式:KW=[H+][OH-]。
3.影响因素:温度(升温,KW增大)
4.常见题型
(1)计算{计算KW、[H+]、[OH-]、pH}。
(2)通过KW的大小比较,判断相应温度的高低。
[对点训练]
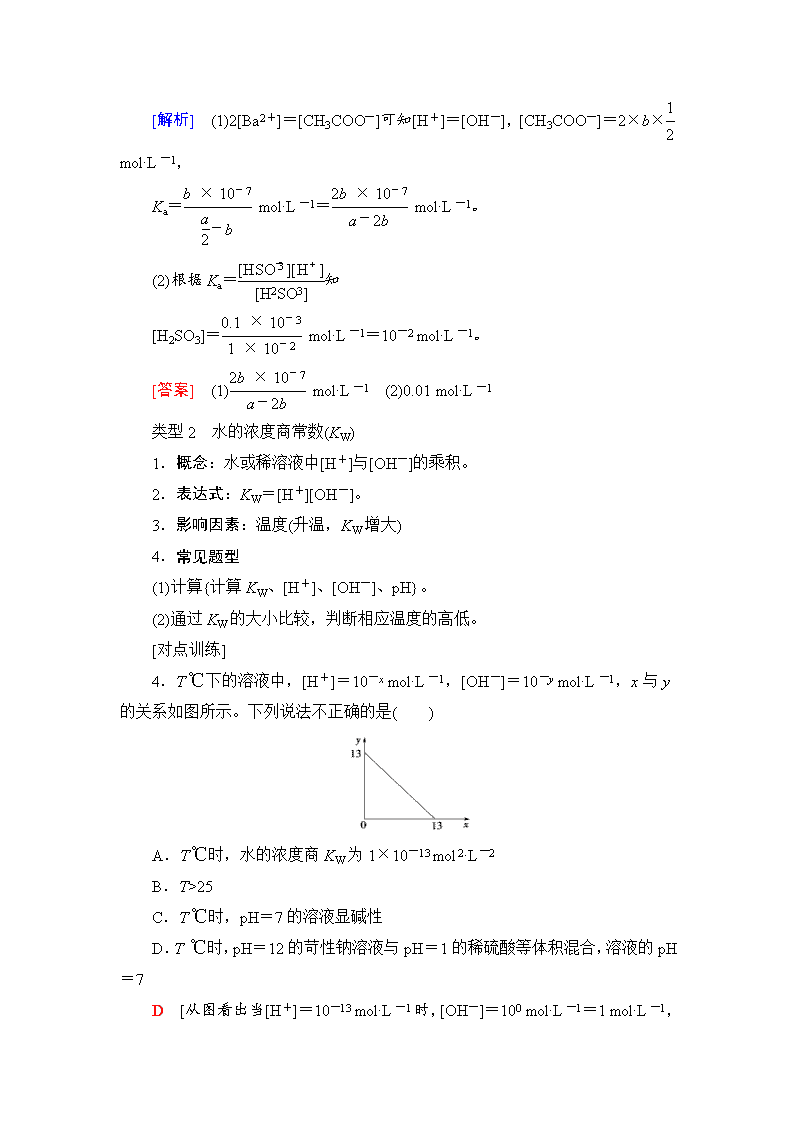
4.T ℃下的溶液中,[H+]=10-x mol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示。下列说法不正确的是( )
A.T ℃时,水的浓度商KW为1×10-13 mol2·L-2
B.T>25
C.T ℃时,pH=7的溶液显碱性
D.T ℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7
D [从图看出当[H+]=10-13 mol·L-1时,[OH-]=100 mol·L-1=1 mol·L-1
,故T ℃时,KW=1×10-13 mol2·L-2,A正确;T ℃时,KW大于1×10-14 mol2·L-2,则T ℃一定高于常温,B正确;T ℃时,pH=6.5的溶液呈中性,显然pH=7的溶液显碱性,C正确;pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,二者恰好完全中和,但注意该温度下,pH=7的溶液不是中性溶液,D错误。]
5.水的电离平衡曲线如图所示。下列说法正确的是( )
A.a点对应温度条件下,将pH=x的氨水稀释10倍后,其pH=y,则x=y+1
B.纯水仅升高温度,可从d点变到b点
C.c点对应温度条件下醋酸的电离常数比a点对应温度条件下醋酸的电离常数大
D.b点对应温度条件下,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,充分反应后,所得溶液的[H+]=10-7 mol·L-1
C [A项,NH3·H2O是弱电解质,加水稀释促进NH3·H2O的电离,将pH=x的氨水稀释10倍后,溶液中的OH-浓度大于原来的,则x
c>a=d,温度关系为b>c>a=d,而醋酸的电离也是吸热反应,温度越高,电离常数越大,正确;D项,b点的KW=1.0×10-12 mol2·L-2,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,充分反应后所得溶液呈中性,此时[H+]=1.0×10-6 mol·L-1,错误。]
类型3 溶度积常数(Ksp)
1.概念:一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积。
2.表达式:MmAn的饱和溶液中Ksp=[Mn+]m[Am-]n。
3.影响因素:难溶电解质的性质和温度。
4.常考题型
(1)Ksp的基本计算。
(2)利用Ksp进行分离提纯。
(3)有关计算(沉淀顺序、沉淀转化、沉淀生成)。
[对点训练]
6.(2017·威海质检)已知常温下:Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3;Ksp(AgCl)=1.8×10-10 mol2·L-2;Ksp(Ag2S)=6.3×10-50 mol3·L-3;Ksp(CH3COOAg)=2.3×10-3 mol2·L-2。下列叙述不正确的是( )
A.常温下,浓度均为0.02 mol·L-1的AgNO3溶液和CH3COONa溶液混合一定产生CH3COOAg沉淀
B.常温下,将0.001 mol·L-1的AgNO3溶液加入到浓度均为0.001 mol·L-1的KCl和K2S的混合溶液中,先产生Ag2S沉淀
C.常温下,调节溶液的pH>9,能使Mg2+浓度为0.12 mol·L-1的溶液中产生Mg(OH)2沉淀
D.常温下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变
A [选项A中没有说明两者按什么样的体积比混合,若按体积比1∶1混合,则c(Ag+)·c(CH3COO-)=0.01 mol·L-1×0.01 mol·L-1=10-4 mol2·L-29,则c(OH-)>1×10-5 mol·L-1,c(Mg2+)·c2(OH-)>1.2×10-11 mol·L-3,即c(Mg2+)·c2(OH-)>Ksp[Mg(OH)2],故产生Mg(OH)2沉淀,C正确;Ksp只与温度有关,D正确。]
7.已知:Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3,Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3。向浓度均为0.01 mol·L-1的Cu2+和Mg2+的混合溶液中逐滴加入NaOH溶液至过量,下列说法正确的是( )
A.较先出现的沉淀是Mg(OH)2
B.两种离子开始沉淀时,Cu2+所需溶液的pH较大
C.当两种沉淀共存时,说明溶液中完全不存在[Cu2+]、[Mg2+]
D.当两种沉淀共存时,溶液中≈8.2×108
D [由于Ksp[Cu(OH)2]比Ksp[Mg(OH)2]小,所以Cu2+先沉淀,其所需OH-的浓度较小,即溶液的pH较小,故A、B错误;绝对不溶的物质是不存在的,故C错误;当两种沉淀共存时,由于Ksp[Mg(OH)2]=[Mg2+][OH-]2,Ksp[Cu(OH)2]=[Cu2+][OH-]2,所以=≈8.2×108,D正确。]
8.室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a mol3·L-3,[M2+]=b mol·L-1时,溶液的pH等于( )
A.lg() B.lg()
C.14+lg() D.14+lg()
C [Ksp[M(OH)2]=[M2+][OH-]2=a mol3·L-3,[M2+]=b mol·L-1,则有[OH-]=() mol·L-1,结合水的浓度商常数可知,[H+]===10-14· mol·L-1,那么pH=14+lg()。]
9.(2015·江苏高考节选)已知:Ksp[Al(OH)3]=1×10-33 mol4·L-4,Ksp[Fe(OH)3]=3×10-39 mol4·L-4,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为________。
[解析] Fe3+全部转化为Fe(OH)3时,[OH-]== =×10-11 mol·L-1;Al3+全部转化为Al(OH)3时,[OH-]===1×10-9mol·L-1,故Al3+、Fe3+完全沉淀时,溶液中OH-的最小浓度应为1×10-9 mol·L-1,即pH最小应为5.0,因为Mn(OH)2沉淀时的最小pH为7.1,故除去MnSO4溶液中的Fe3+、Al3+,应调节溶液至5.0<pH<7.1。
[答案] 5.0<pH<7.1
类型4 水解平衡常数
1.概念:水解平衡也是一种化学平衡,其平衡常数即水解常数。
2.表达式:如醋酸钠溶液中,CH3COO-(aq)+H2O(l)CH3COOH(aq)+OH-(aq)
Kh==KW/Ka。
3.影响因素:温度(升温,Kh增大)。
4.Kh与KW、Ka、Kb、Ksp之间的关系
(1)一元弱酸一元强碱盐:Kh=KW/Ka;
(2)一元强酸一元弱碱盐:Kh=KW/Kb;
(3)一元弱酸一元弱碱盐,如醋酸铵:Kh=KW/(Ka×Kb);
(4)多元弱碱一元强酸盐,如氯化铁:
Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)
水是纯液体,Fe(OH)3是固体物质不列入平衡常数。
Kh=[H+]3/[Fe3+]。
将K=[H+]3[OH-]3与Ksp=[Fe3+][OH-]3两式相比消去[OH-]3,所以,Kh=K/Ksp。
5.常考题型
(1)考查盐溶液的性质(酸、碱性等)。
(2)考查对应弱酸的相对强弱。
(3)有关计算(计算Kh、浓度、pH等)。
[对点训练]
10.已知:25 ℃时醋酸的电离平衡常数:
Ka(CH3COOH)=1.8×10-5 mol·L-1,水的浓度商常数:KW=[H+][c(OH-]=1×10-14 mol2·L-2。则25 ℃时,0.1 mol·L-1 CH3COONa水溶液中,[OH-]约为(已知:≈1.34)( )
A.1×10-7 mol/L B.1.8×10-6 mol/L
C.7.5×10-6 mol/L D.7.5×10-5 mol/L
C [本题设计的意图是利用数学关系巧妙代换求出水解平衡常数,灵活地考查了水解平衡常数与电离平衡常数、水的浓度商常数之间的关系。分析如下:
CH3COO-+H2OCH3COOH+OH-
起始: 0.1 0 0
改变: x x x
平衡: (0.1-x) x x
Kh=
=
即:=
因CH3COONa的水解程度很小,则(0.1-x)≈0.1,上式可变为:
=
解得:x=≈7.5×10-6 mol/L。]
11.25 ℃时,H2SO3HSO+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________ mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中将________(填“增大”“减小”或“不变”)。
[解析] H2SO3的电离常数Ka==1×10-2 mol·L-2,水的浓度商常数KW=[H+][OH-]=1×10-14 mol2·L-2,综上可得Ka=。NaHSO3溶液中HSO的水解反应为HSO+H2OH2SO3+OH-,则水解平衡常数Kh=== mol·L-1=1×10-12 mol·L-1。NaHSO3溶液中加入少量I2,二者反应HSO+I2+H2O===3H++SO+2I-,[H+]增大,使==增大。
[答案] 1×10-12 增大
12.(1)已知25 ℃时,Na2CO3溶液的水解平衡常数为Kh=5×10-5 mol·L-1,则当溶液中[HCO]∶[CO]=1∶2时,试求溶液的pH=________。
(2)已知25 ℃时,Fe(OH)3的Ksp=2.6×10-39 mol4·L-4,则Fe3+(aq)+3H2OFe(OH)3(s)+3H+的Kh≈________ mol2·L-2。
[解析] (1)Kh==5×10-5 mol·L-1,又[HCO]∶[CO]=1∶2,得[OH-]=10-4 mol/L,故pH=10。
(2)Kh==== mol2·L-2≈3.8×10-4 mol2·L-2。
[答案] (1)10 (2)3.8×10-4