2021届高考化学一轮复习第5章物质结构元素周期律高考热点课4“位_构_性”的综合推断教学案新人教版
“位构性”的综合推断
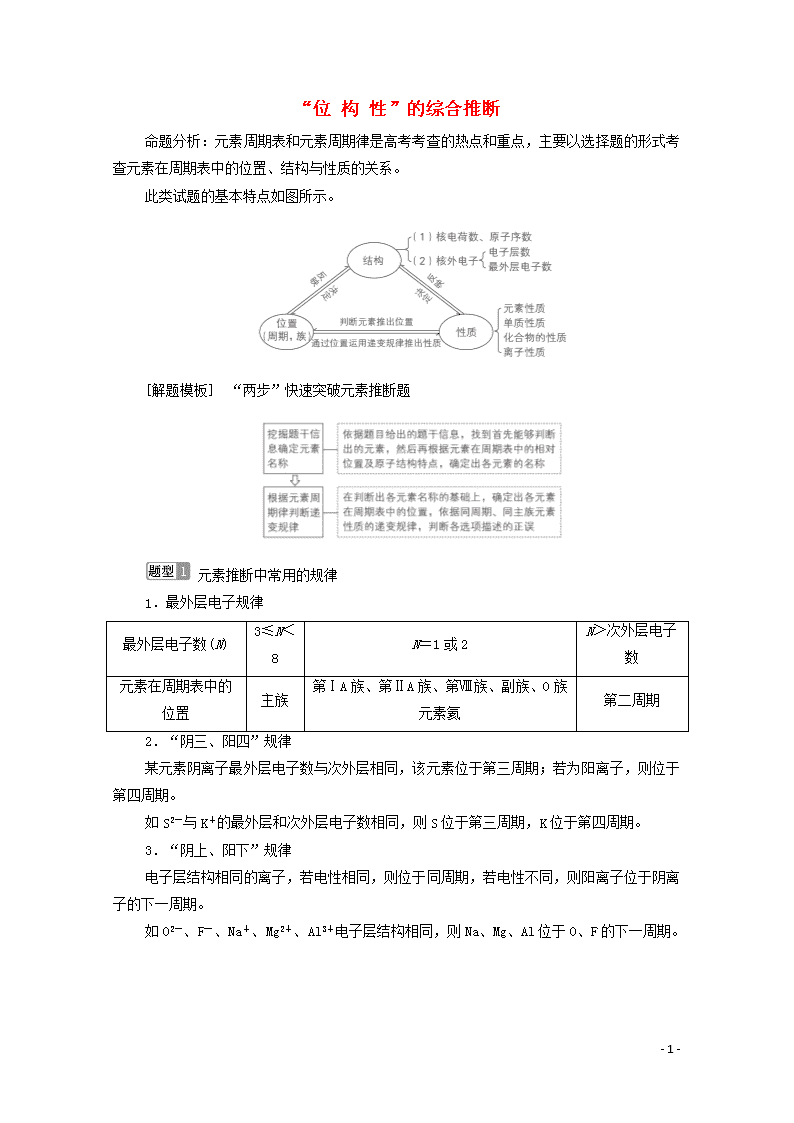
命题分析:元素周期表和元素周期律是高考考查的热点和重点,主要以选择题的形式考查元素在周期表中的位置、结构与性质的关系。
此类试题的基本特点如图所示。
[解题模板] “两步”快速突破元素推断题
元素推断中常用的规律
1.最外层电子规律
最外层电子数(N)
3≤N<8
N=1或2
N>次外层电子数
元素在周期表中的位置
主族
第ⅠA族、第ⅡA族、第Ⅷ族、副族、0族元素氦
第二周期
2.“阴三、阳四”规律
某元素阴离子最外层电子数与次外层相同,该元素位于第三周期;若为阳离子,则位于第四周期。
如S2-与K+的最外层和次外层电子数相同,则S位于第三周期,K位于第四周期。
3.“阴上、阳下”规律
电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期。
- 13 -
[解析] W、X、Y、Z为同一短周期元素,可能同处于第二或第三周期,观察新化合物的结构示意图可知,X为四价,X可能为C或Si。若X为C,则Z核外最外层电子数为C原子核外电子数的一半,即为3,对应B元素,不符合成键要求,不符合题意,故X为Si,W能形成+1价阳离子,可推出W为Na元素,Z核外最外层电子数为Si原子核外电子数的一半,即为7,可推出Z为Cl元素。Y能与2个Si原子形成共价键,另外得到1个电子达到8电子稳定结构,说明Y原子最外层有5个电子,进一步推出Y为P元素,即W、X、Y、Z分别为Na、Si、P、Cl元素。WZ为NaCl,其水溶液呈中性,A错误;元素非金属性:Cl>P>Si,B错误;P的最高价氧化物的水化物为H3PO4,是中强酸,C正确;P原子最外层有5个电子,与2个Si原子形成共价键,另外得到1个电子,在该化合物中P元素满足8电子稳定结构,D错误。
[答案] C
(2019·哈尔滨六中高三期末考试)四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,Y、W质子数之和是Z质子数的2倍。则下列说法中正确的是( )
A.X的氢化物的沸点可能高于Y的氢化物的沸点
B.原子半径比较:X<Y<Z<W
C.X2H4与H2W都能使溴水褪色,且褪色原理相同
D.短周期所有元素中,Z的最高价氧化物的水化物碱性最强
答案 A
解析 四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,是碳元素,Y、W同主族且能形成两种常见的化合物,Y为氧元素,W为硫元素,Y、W质子数之和是Z质子数的2倍,说明Z为镁。X的氢化物为烃,Y的氢化物为水,烃常温下有气体或液体或固体,所以沸点可能高于水,故A正确;电子层数越多,原子半径越大,同电子层数的原子,核电荷数越大,原子半径越小,四种原子的半径顺序为Y
Y>X>W
B.Z的简单氢化物的热稳定性比W的强
C.Y的氧化物既可溶于R的最高价氧化物对应水化物的水溶液,也可溶于R的氢化物的水溶液
D.X与W、Z形成的化合物不少于三种
答案 D
解析 NH3
- 13 -
可用作制冷剂,所以R为N;短周期中金属性最强的元素是Na,则X为Na;Y应为第三周期元素,第三周期元素的简单离子半径最小的元素为Al,则Y为Al;常见单质为黄色沉淀的元素为S,由此可知由W、X和Z三种元素组成的盐为Na2S2O3,与稀盐酸反应生成S单质和SO2,因此W为O,Z为S。原子半径:Na>Al>S>O,A错误;非金属性:SY>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
答案 D
解析 根据题意,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z元素的原子序数大于Y元素的原子序数。由此得出三种元素原子序数的关系为Z>Y>X。
4.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A.最高正化合价:Z>X
B.X、Y、Z的单质中,Z的熔点最高
C.若X为非金属元素,则离子半径:Xn->Ym->Zm-
D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
答案 C
解析 一般情况下,元素的最高正化合价与其族序数相等,但O、F无正化合价,Z为O或F时不符合题意,A错误;若X为Si,则三者的单质中,Si的熔点最高,B错误;若X为非金属元素,则Xn-、Ym-具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:Xn->Ym-,而Y与Z同主族,离子半径:Ym->Zm-,C正确;X、Y、Z中X的金属性最强,故X的最高价氧化物对应水化物的碱性最强,D错误。
5.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;Z与W位于同周期,它们能形成ZW型离子化合物,下列判断正确的是( )
A.氢化物的稳定性:HnXY>Z>X
C.离子的还原性:X>W
D.原子半径:Y>Z>X
答案 B
解析 依题意知,W为Cl;X与W同主族,则X为F;F与Cl的原子序数之和为26,则Y为Al,Z与W(Cl)都在第三周期,且它们形成ZW型离子化合物,则Z为Na。即它们在周期表的相对位置为:
- 13 -
F(X)
Na(Z)
Al(Y)
……
Cl(W)
逐项分析:A应为HnX>HnW,错误;B正确;C应为XY>X,错误。
6.(2019·百师联盟高三调研)置换反应可表示为
下列说法不正确的是( )
A.若A、B都是短周期元素,则B的原子序数可能是A的两倍
B.若乙是一种常见的半导体材料,则通过该反应说明A的非金属性一定比B强
C.若A、B均为非金属元素,则该反应过程中可能会产生白烟
D.该反应可用于某些金属的冶炼
答案 B
解析 A、B为短周期元素,该反应为置换反应,可以是H2S+O2===H2O+S,O元素原子序数为8,S元素原子序数为16,S的原子序数是O的两倍,故A正确;乙为常见的半导体材料,即乙为Si,工业上制备Si,反应方程式为2C+SiO22CO+Si,该反应中C为还原剂,SiO2为氧化剂,因此通过该反应不能说明C的非金属性强于Si,故B错误;A、B均为非金属元素,该反应为置换反应,可以是3Cl2+8NH3===6NH4Cl+N2,NH4Cl为固体,其余为气体,则该过程中产生白烟,故C正确;该反应可用于某些金属的冶炼,如铝热反应,故D正确。
7.(2019·成都市高三诊断)短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。25 ℃时,由这些元素组成的化合物甲、乙、丙、丁的0.1 mol·L-1水溶液的pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是( )
0.1 mol·L-1水溶液
甲
乙
丙
丁
pH
13
11
5
1
A.W和Q形成的化合物只含有离子键
B.Y和Z的氢化物沸点:Yr(R)>r(Z)
D.Y和Q的氧化物对应水化物的酸性:Q>Y
答案 A
解析 根据以上分析,知甲为NaOH,乙为Na2CO3,丙为AlCl3
- 13 -
,丁为HCl,则X为H,Y为C,Z为O,W为Na,R为Al,Q为Cl。Na和Cl形成的化合物NaCl只含离子键,A正确;C的氢化物为烃,有许多种,常温常压下可以为气态、液态或固态,故C的氢化物沸点不一定小于氧的氢化物沸点,B错误;Cl-核外有3个电子层,Al3+、O2-核外有两个电子层,且电子层结构相同,结合Al的原子序数大于O,可知离子半径大小为r(Cl-)>r(O2-)>r(Al3+),C错误;C的氧化物对应的水化物为H2CO3,Cl的氧化物对应的水化物有HClO、HClO2、HClO3、HClO4,H2CO3的酸性比HClO强,比HClO4弱,D错误。
8.(2019·资阳市高三第二次诊断性考试)A、B、C为短周期元素,在周期表中所处的相对位置如图所示,B的气态氢化物是工业上合成硝酸的重要原料。下列有关说法正确的是( )
A.B和C两原子间可以形成离子键
B.A的氧化物电子式为
C.原子半径:A>B>C
D.最高价氧化物对应的水化物的酸性:B>A
答案 D
解析 依题意,A、B、C为短周期元素,B的气态氢化物是工业上合成硝酸的重要原料,则B为N元素,从A、B、C的相对位置看,A为Si元素、C为S元素。N元素和S元素均为非金属元素,两原子间不可能形成离子键,故A错误;A的氧化物是二氧化硅,每个硅原子与周围4个氧原子形成共价键,晶体中只有单键,没有双键,故B错误;一般而言,电子层数越多,原子半径越大,且同周期主族元素从左到右,原子半径依次减小,原子半径的大小顺序为Si>S>N,故C错误;同周期主族元素,从左到右非金属性依次增强,同主族元素,从上到下非金属性依次减弱,则非金属性的强弱顺序为N>P>Si,故最高价氧化物对应的水化物的酸性HNO3>H2SiO3,故D正确。
9.(2019·佛山市高三教学质量检测)已知W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20。Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。W、X、Y均能与Z形成离子化合物。下列说法错误的是( )
A.X、Z两元素的简单离子电子层结构相同
B.X与Z形成的离子化合物一定只含有离子键
C.Y的氢化物比X的氢化物稳定
D.W与Y形成的化合物WY可刻蚀玻璃
答案 B
解析 由题意可知,W、X、Y、Z分别为H、O、F、Na。O2-、Na+两简单离子电子层结构相同,故A正确;X与Z形成的离子化合物Na2O、Na2O2一定含有离子键,Na2O2
- 13 -
还含有共价键,故B错误;非金属性F>O,则气态氢化物的稳定性:HF>H2O,故C正确;SiO2+4HF===SiF4↑+2H2O,W与Y形成的化合物HF可刻蚀玻璃,故D正确。
10.(2019·安徽池州高三期末)a、b、c、d原子序数依次增大,且均不大于20。c的单质在常温下为有色气体,在工业上常与d的最高价氧化物对应的水化物反应生产漂白粉;同时该气体与a、b形成的一种化合物反应生成两种酸。下列说法正确的是( )
A.原子半径大小为:aCl,A错误;CaH2为离子化合物,B错误;在酸性条件下,氯化钙和次氯酸钙能够反应生成氯气,C正确;氢化钙溶于水反应生成氢氧化钙,溶液呈碱性,氯化氢水溶液呈酸性,D错误。
11.(2019·安徽五校联盟高三质检)R、X、Y、Z是原子序数依次增大的四种主族元素,且原子序数均不超过20。R的一种氧化物在常温下能形成二聚物,使气体颜色变浅。X的氢化物的水溶液能刻蚀玻璃容器,对Z的化合物作焰色反应实验,透过蓝色钴玻璃片可观察到紫色。向Y的含氧酸钠盐溶液中通入CO2,观察到沉淀质量(m)与CO2体积(V)的关系如图所示。下列说法不正确的是( )
A.Y的单质的熔点一定高于Z的单质
B.R的氧化物对应的水化物一定是强酸
C.X的简单气态氢化物的热稳定性比R的强
D.化合物ZX一定能破坏水的电离平衡
答案 B
解析 由题意可推出R、X、Y、Z元素分别为N、F、Al或Si、K。Y的单质可以为Al或Si,二者的熔点均高于K的熔点,A正确;N的氧化物对应的水化物HNO2为弱酸,B错误;非金属性:F>N,因此简单气态氢化物的热稳定性:HF>NH3,C正确;KF中由于F-水解,可促进水的电离,D正确。
- 13 -
12.(2019·广州高三调研测试)短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,W与X可形成一种红棕色有刺激性气味的气体,Y的原子半径是所有短周期主族元素中最大的,Z原子最外层电子数与W原子的电子总数相同。下列说法正确的是( )
A.W的氧化物对应的水化物均为强酸
B.简单离子半径:Wr(O2-)>r(Na+),B错误;由于NH3分子间形成氢键,故NH3的沸点比HCl的沸点高,C正确;NaCl溶液呈中性,D错误。
13.(2019·昆明市高三复习诊断)短周期元素X、Y、Z、W原子序数依次增大,Y是同周期主族元素中原子半径最大的,W原子最外层电子数是电子层数的2倍,工业上电解熔融Z2X3制备单质Z。下列说法正确的是( )
A.气态氢化物的稳定性:XZ>X
C.含Z元素的盐,其水溶液可能显酸性,也可能显碱性
D.X与Y形成的所有化合物中均只含一种化学键
答案 C
解析 由题意可推出Y是Na,W是S,Z是Al,X是O。氧元素的非金属性强于硫元素,非金属性越强,气态氢化物越稳定,故A错误;电子层结构相同的离子,核电荷数大,半径小,所以离子半径是X>Y>Z,故B错误;NaAlO2溶液显碱性,AlCl3溶液显酸性,故C正确;Na2O2中既含离子键又含共价键,故D错误。
14.(2019·湖北省鄂州市、黄冈市高三调研)短周期主族元素X、Y、Z、W原子序数依次增大,X与Y能形成Y2X和Y2X2两种常见的化合物,Z原子的电子总数为最外层电子数的3倍,W与X同主族。以下说法正确的是( )
A.简单氢化物的稳定性比较:X>Z>W
B.简单离子的半径比较:W>Y>X
C.简单氢化物的沸点比较:W>Z>X
D.Y2X和Y2X2两种化合物中,Y与X的最外电子层均达到8电子稳定结构
答案 D
解析 Z原子的电子总数为最外层电子数的3倍,则Z为磷元素,Y2X和Y2X2
- 13 -
结合题意这里为氧化钠和过氧化钠,则Y为钠元素,X为氧元素,W与X同族,则W为硫元素。元素非金属性越强,简单氢化物稳定性越好,因非金属性:O(X)>S(W)>P(Z),所以简单氢化物的稳定性X>W>Z,故A错误。电子层数越多,离子半径越大;电子层结构相同时,随着核电荷数的增大,离子半径减小,所以离子的半径比较:W>X>Y,故B错误。因H2O分子间存在氢键,故其沸点最高,故C错误。Y2X为Na2O,Y2X2为Na2O2,Y与X的最外电子层均达到8电子稳定结构,故D正确。
15.(2019·湖北八校高三联考)短周期主族元素W、M、X、Y、Z的原子序数依次增大。W的族序数是周期数的3倍,X原子的最外层只有一个电子,Y是地壳中含量最多的金属元素,Z在同周期中原子半径最小。下列说法错误的是( )
A.X2W2和X2W中阴、阳离子个数之比均为1∶2
B.M、Z两种元素的气态氢化物的稳定性:MW
答案 B
解析 由题意可知:W、M、X、Y、Z分别为O、F、Na、Al、Cl。X2W2(Na2O2)和X2W(Na2O)中的阴离子分别为O和O2-,阳离子均为Na+,则阴、阳离子个数比均为1∶2,A正确;非金属性越强,形成的气态氢化物越稳定,M(F)的非金属性强于Z(Cl),稳定性:HF>HCl,B错误;XZW为NaClO,与浓盐酸反应生成Cl2,Cl2与冷烧碱溶液作用可得到含NaClO的溶液,C正确;M的单质为F2,W的氢化物为H2O,2F2+2H2O===4HF+O2,根据氧化剂的氧化性大于氧化产物的氧化性,可知氧化性:F2>O2,则非金属性:M(F)>W(O),D正确。
16.(2019·河南南阳市高三期末质量评估)已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的主族元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子的最外层电子数之和。下列有关说法正确的是( )
A.Y、Z分别与X形成化合物的稳定性前者大于后者
B.由以上元素两两形成的化合物中,溶于水显碱性的只有两种
C.由X、Y、Z三种元素所形成的化合物只含共价键
D.Z、W所形成的简单离子半径前者比后者大
答案 D
解析 X、Y、Z、W是三个连续短周期中原子序数依次增大的主族元素,可确定X是氢元素,因X和W同主族,所以W是钠元素。Y、Z应该在第二周期,因Y和Z相邻,它们最外层电子数相差1个且最外层电子数之和为11(钠元素的质子数),则Y、Z最外层电子数分别为5、6,由此推知Y是氮元素,Z是氧元素。因为非金属性NNa+,D正确。
- 13 -
17.中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q。取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与加入氢氧化钠溶液体积的关系如图所示。下列说法不正确的是( )
A.简单离子半径:M>Y>Z
B.气态氢化物的热稳定性:Y>X
C.最高价氧化物对应水化物的酸性:M>Z
D.由R、X、Y、M四种元素组成的盐只有一种
答案 D
解析 依题意,题述五种主族元素占据三个短周期,R的原子序数最小,则R为H。Y原子最外层电子数是电子层数的3倍,则Y为O。Y和M同主族,M为S。观察题图知,Q含有金属阳离子,且该金属阳离子与碱反应生成的氢氧化物难溶于水,而该氢氧化物又能与碱反应,所以,Q含有铝离子。分析题图,当加入氢氧化钠溶液的体积由3 mL→4 mL时,生成沉淀的物质的量不变,说明铵根离子与碱反应。由原子序数大小知,X为N,Z为Al。S2-、O2-、Al3+的半径依次减小,A正确;热稳定性:H2O>NH3,B正确;酸性:H2SO4>Al(OH)3,C正确;H、N、O、S四种元素组成的盐有NH4HSO4、(NH4)2SO4、NH4HSO3、(NH4)2SO3、(NH4)2S2O3等,D错误。
- 13 -