- 2021-08-24 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第三章水溶液中的离子平衡2水的电离和溶液的酸碱性1水的电离和溶液的酸碱性真题导思含解析 人教版选修4
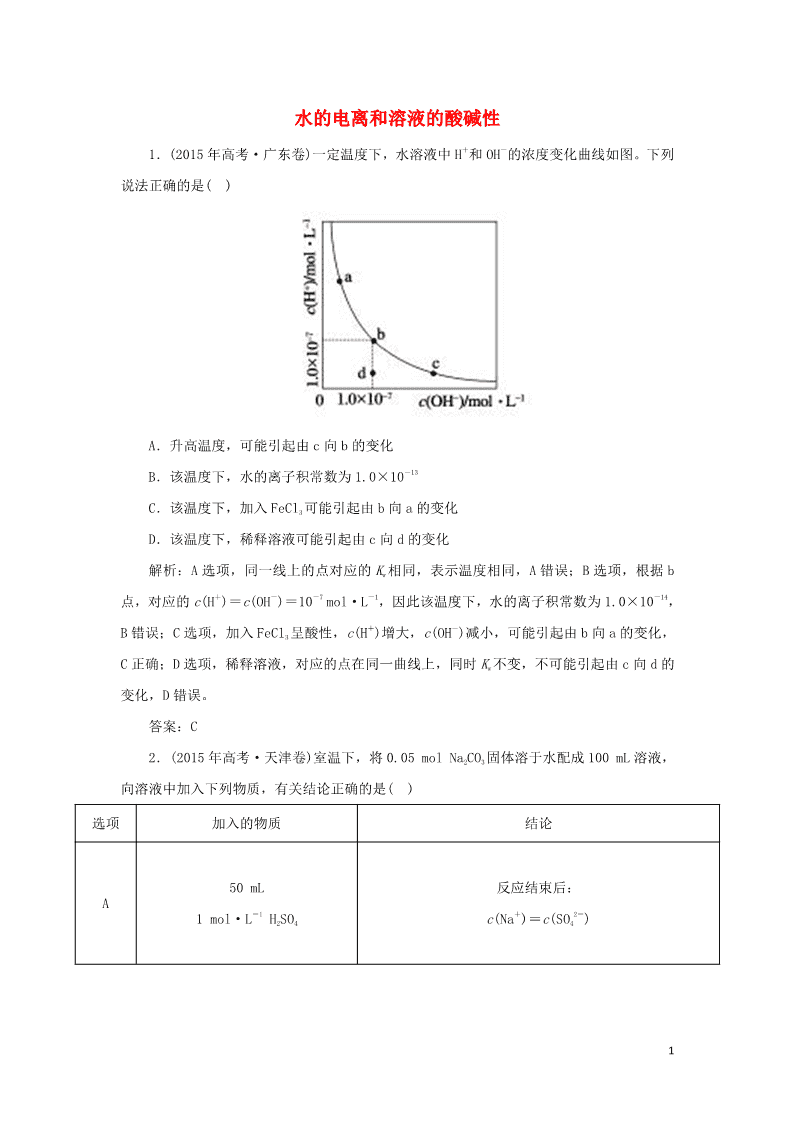
1 水的电离和溶液的酸碱性 1.(2015 年高考·广东卷)一定温度下,水溶液中 H+和 OH-的浓度变化曲线如图。下列 说法正确的是( ) A.升高温度,可能引起由 c 向 b 的变化 B.该温度下,水的离子积常数为 1.0×10-13 C.该温度下,加入 FeCl3 可能引起由 b 向 a 的变化 D.该温度下,稀释溶液可能引起由 c 向 d 的变化 解析:A 选项,同一线上的点对应的 Kw 相同,表示温度相同,A 错误;B 选项,根据 b 点,对应的 c(H+)=c(OH-)=10-7 mol·L-1,因此该温度下,水的离子积常数为 1.0×10-14, B 错误;C 选项,加入 FeCl3 呈酸性,c(H+)增大,c(OH-)减小,可能引起由 b 向 a 的变化, C 正确;D 选项,稀释溶液,对应的点在同一曲线上,同时 Kw 不变,不可能引起由 c 向 d 的 变化,D 错误。 答案:C 2.(2015 年高考·天津卷)室温下,将 0.05 mol Na2CO3 固体溶于水配成 100 mL 溶液, 向溶液中加入下列物质,有关结论正确的是( ) 选项 加入的物质 结论 A 50 mL 1 mol·L-1 H2SO4 反应结束后: c(Na+)=c(SO4 2-) 2 B 0.05 mol CaO C 50 mL H2O 由水电离出的 c(H+)·c(OH-)不变 D 0.1 mol NaHSO4 固体 反应完全后,溶液 pH 减小,c(Na+)不变 解析:0.05 mol Na2CO3 与 0.05 mol H2SO4 完全反应:Na2CO3+H2SO4===Na2SO4+CO2↑+H2O, 反应后溶质为 Na2SO4,根据物料守恒反应结束后 c(Na+)=2c(SO4 2-),A 项错误;向溶液中加 入 0.05 mol CaO,则 CaO+H2O===Ca(OH)2,则 c(OH-)增大,且 Ca2++CO3 2-===CaCO3↓,使 CO3 2 -+H2O HCO3 -+OH-平衡向左移,c(HCO3 -)减小,故 c(OH-) c(HCO3-)增大,B 项正确;加水 稀释有利于水解,CO3 2-+H2O HCO3 -+OH-水解平衡向右移动,水电离出的 n(H+),n(OH -)均增大,但稀释后 c(H+),c(OH-)均降低,C 项错误;加入 0.1 mol NaHSO4 固体,NaHSO4===Na ++H++SO4 2-,CO3 2-+2H+===CO2↑+H2O,则反应后溶液为 Na2SO4 溶液,溶液呈中性,故溶液 的 pH 减小,但引入了 Na+,故 c(Na+)增大,D 项错误。 答案:B 3.(2013 年高考·大纲全国卷)如图表示水中 c(H+)和 c(OH-)的关系,下列判断错误的 是( ) A.两条曲线上任意点均有 c(H+)×c(OH-)=Kw B.M 区域内任意点均有 c(H+)查看更多
相关文章
- 当前文档收益归属上传用户