- 2021-08-23 发布 |
- 37.5 KB |
- 35页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省2021高考化学一轮复习专题六化学能与电能的转化课件
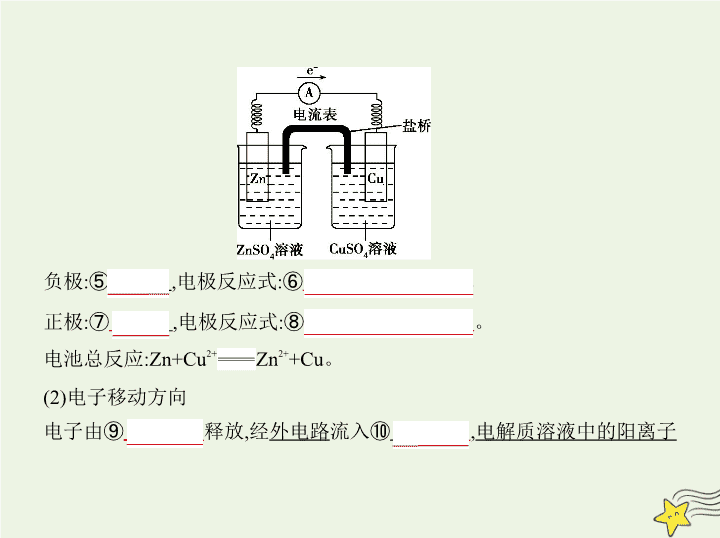
考点清单 考点一 原电池原理及应用 一、原电池的工作原理 1.原电池 将① 化学 能转化为② 电 能的装置。 2.构成条件 (1)具有两个 活泼性不同 的电极(金属和金属或金属和导电的非金属)。 (2)电解质溶液。 (3)形成闭合回路。 3.原电池的两极 负极:活泼性较强的金属,发生③ 氧化 反应。 正极:活泼性较弱的金属或能导电的非金属,发生④ 还原 反应。 4.电极反应式的书写和电子移动方向 (1)电极反应式的书写(以Zn-Cu原电池为例,如下图) 负极:⑤ Zn ,电极反应式:⑥ Zn-2e - Zn 2+ 。 正极:⑦ Cu ,电极反应式:⑧ Cu 2+ +2e - Cu 。 电池总反应:Zn+Cu 2+ Zn 2+ +Cu。 (2)电子移动方向 电子由⑨ 负极 释放,经 外电路 流入⑩ 正极 , 电解质溶液中的阳离子 移向正极 ,某些阳离子在正极上得电子被 还原 ,形成一个闭合回 路。 二、化学电源 一次电池又称为干电池,二次电池又称为充电电池或蓄电池。 三、原电池原理的应用 1.设计化学电源 利用原电池的原理,结合现代生活、生产和科学研究的实际需求,制作了多 种电池,如碱性锌锰干电池、铅蓄电池、锂离子电池以及航空航天电池。 2.比较金属活动性强弱 一般来说,原电池负极材料比正极材料活泼。通常情况下,发生溶解的电极 为 负 极,有气体或固体生成的电极为 正 极。 3.加快氧化还原反应的速率 对于自发的氧化还原反应,将其设计成原电池时反应速率 加快 ,如 实验室用Zn和稀硫酸反应制取氢气,往稀硫酸中加入少量CuSO 4 溶液,可使 产生H 2 的速率加快。 4.用于金属的防护 被保护的金属与更活泼的金属相连接组成原电池,实现金属的防护。 考点二 电解原理及应用 一、电解原理 1.电解 使 电流通过电解质溶液(或熔融的电解质) 而在阴、阳两极引起氧化还原 反应的过程。 2.电解池 (1)装置特点 电 能转化为 化学 能。 (2)形成条件 a.与直流电源相连的两个电极。 b.电解质溶液(或熔融态电解质)。 c.形成闭合回路。 3.电极反应规律 (1)阴极 与电源 负 极相连, 得到 电子发生 还原 反应。 (2)阳极 与电源 正 极相连, 失去 电子发生 氧化 反应。 二、电解原理的应用 1.氯碱工业 (1)食盐水的精制 说明 阳离子交换膜(以电解饱和NaCl溶液为例)只允许阳离子(Na + )通过 , 而阻止阴离子(Cl - 、OH - )和分子(Cl 2 )通过,这样既能阻止H 2 和Cl 2 混合爆炸, 又能避免Cl 2 和NaOH溶液反应生成NaClO影响烧碱质量。 (3)电极反应及总反应 阳极: 2Cl - -2e - Cl 2 ↑ 。 阴极: 2H 2 O+2e - H 2 ↑+2OH - 。 总反应(离子方程式): 2Cl - +2H 2 O 2OH - +Cl 2 ↑+H 2 ↑ 。 2.电镀 (1)电镀的特点 电镀时,阳极是 镀层金属 ,阴极是 镀件 ,一般用 含有镀层金属 离子的溶液作电镀液 ;电镀池工作时,阳极质量 减小 ,阴极质量 增大 ,电解质溶液浓度 基本不变 。 (2)铜的电解精炼 阳极(用 粗铜 ): Cu-2e - Cu 2+ 。 粗铜中的 金、银 等金属杂质,因失电子能力比铜弱,难以在阳极失去电子变 成阳离子,以 阳极泥 的形式沉积下来。 阴极(用 纯铜 ): Cu 2+ +2e - Cu 。 3.电冶金 金属冶炼就是使矿石中的金属离子获得电子,从其化合物中还原出来。通 式为 M n + + n e - M 。 钠的冶炼:NaCl在熔融状态下发生电离,通直流电,阴极反应式为 2Na + + 2e - 2Na ,阳极反应式为 2Cl - -2e - Cl 2 ↑ 。 三、原电池、电解池及电镀池的区别 原电池 电解池 电镀池 定 义 将化学能转变成电能 的装置 将电能转变成化学能 的装置 应用电解原理在某些 金属表面镀上一层其 他金属或合金的装置 装 置 举 例 形 成 条 件 ①活泼性不同的两电 极 ②电解质溶液(电极插 入其中,并能与电极发 生自发反应) ③形成闭合回路 ①两电极接直流电源 ②两电极插入电解质 溶液(或熔融电解质)中 ③形成闭合回路 ①镀层金属接电源正 极,待镀金属接电源负 极 ②电镀液必须含有镀 层金属的离子(电镀过 程中电镀液浓度不变) 电 极 名 称 负极:氧化反应,金属失 电子或者氢气等还原 性物质失电子 正极:还原反应,溶液中 的阳离子得电子或者 氧气等得电子 阳极:氧化反应,溶液中 的阴离子失电子,或金 属电极失电子 阴极:还原反应,溶液中 的阳离子得电子 阳极:金属电极失电子 阴极:电镀液中镀层金 属阳离子得电子(在电 镀控制的条件下,水电 离产生的H + 及OH - 一般 不放电) 负极 正极 电源负极 阴极 电源正极 阳极 同电解池 (1)同一原电池的正、负极的电极反应中得失电子数相等。(2)同一电解池的阴、阳极的电极反应 中得失电子数相等。(3)串联电路中的各个电极反应得失电子数相等。上述三种情况下,在计算电 解产物的量时,应按得失电子数相等计算 考点三 金属的腐蚀与防护 一、金属的腐蚀 (1)化学腐蚀:金属跟接触到的干燥气体(如O 2 、Cl 2 、SO 2 等)或非电解质液 体(如石油)等直接发生化学反应而引起的腐蚀。 (2)电化学腐蚀 a.定义:不纯的金属与电解质溶液接触时,会发生原电池反应, 比较活泼的金 属失去电子而被氧化 ,这种腐蚀叫电化学腐蚀。 注意 金属的腐蚀主要是发生电化学腐蚀。 b.吸氧腐蚀与析氢腐蚀(以钢铁的电化学腐蚀为例) (3)金属腐蚀快慢的比较 不纯的金属在潮湿的空气中形成原电池发生电化学腐蚀,活泼金属因被腐 蚀而损耗。金属腐蚀的快慢与下列两种因素有关: 1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,进 类型 吸氧腐蚀 析氢腐蚀 条件 水膜酸性很弱或呈中性 水膜呈酸性 正极反应(C) O 2 +2H 2 O+4e - 4OH - 2H + +2e - H 2 ↑ 负极反应(Fe) Fe-2e - Fe 2+ 其他反应 Fe 2+ +2OH - Fe(OH) 2 ↓ 4Fe(OH) 2 +2H 2 O+O 2 4Fe(OH) 3 Fe(OH) 3 失去部分水转化为铁锈 行氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。 2)与金属所接触的介质有关,通常活泼金属在电解质溶液中的腐蚀快于在 非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中 的腐蚀。 一般来说,可用下列原则判断金属腐蚀的快慢: 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的 腐蚀 二、金属的防护 (1)改变金属的内部结构。例如把Ni、Cr等加入普通钢中制成不锈钢。 (2)覆盖保护层:a.涂油脂、喷油漆、搪瓷、覆盖塑料等;b.电镀耐腐蚀的金 属(Zn、Sn、Cr、Ni等)。 (3)电化学保护法:通常采用如下两种方法。a. 牺牲阳极的阴极保护法 。这 种方法通常是在被保护的钢铁设备上(如锅炉的内壁、船舶的外壳等)装 上若干镁合金或锌块。b. 外加电流的阴极保护法 。这种方法是把被保护 的钢铁设备(如钢闸门)作为 阴 极,用惰性电极作为 阳 极,两者 均存在于电解质溶液(如海水)里,外接直流电源。通电后,电子被强制流向 被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近于零,从而起到保护 作用。 知能拓展 一、原电池正、负极的判断及电极反应式的书写 1.原电池正、负极的判断 判断角度 负极 正极 电极材料 一般是活动性较强的金属 一般是活动性较弱的金属或能 导电的非金属 电子流向 电子流出的一极 电子流入的一极 离子移动方向 阴离子移向的一极 阳离子移向的一极 发生的反应 氧化反应 还原反应 反应现象 一般质量减小 质量增加或不变 注意 原电池的正、负极不仅跟电极材料有关,还与电解质溶液的性质有 关,如Mg、Al在稀硫酸中构成原电池时,Mg作负极,Al作正极,但若以NaOH 溶液为电解质溶液,则Al为负极,Mg为正极。 2.原电池电极反应式的书写 (1)一般电极反应式的书写 (2)复杂电极反应式的书写 总体思路: 例1 LiFePO 4 电池的反应原理为FePO 4 +Li LiFePO 4 ,电池的正极材料是 LiFePO 4 ,负极材料是石墨,用含Li + 导电固体作为电解质。下列有关LiFePO 4 电池的说法正确的是 ( ) A.可加入硫酸以提高电解质的导电性 B.放电时电池正极反应为:FePO 4 +Li + +e - LiFePO 4 C.充电时LiFePO 4 只发生氧化反应 D.充电过程中,电池正极材料的质量增大 解题导引 根据LiFePO 4 电池的反应原理分析各元素的化合价变化可知, 放电时Li为负极,FePO 4 为正极,据此写出电极反应式,进而分析选项,需注意 的是Li为活泼金属,能与水、酸发生反应。 解析 硫酸可以与Li发生反应,故不能用加入硫酸的方式来提高电解质的 导电性,A项错误;放电时FePO 4 在正极发生还原反应,其电极反应为FePO 4 + Li + +e - LiFePO 4 ,B项正确;充电时,LiFePO 4 发生氧化反应生成FePO 4 , LiFePO 4 发生还原反应生成Li,C项错误;充电过程中,LiFePO 4 转化成FePO 4 , 正极材料质量减小,D项错误。 答案 B 二、惰性电极电解电解质溶液的规律 阴极放电顺序:K +查看更多