- 2021-08-23 发布 |
- 37.5 KB |
- 153页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习专题4非金属及其化合物4生产生活中的含氮化合物课件苏教版
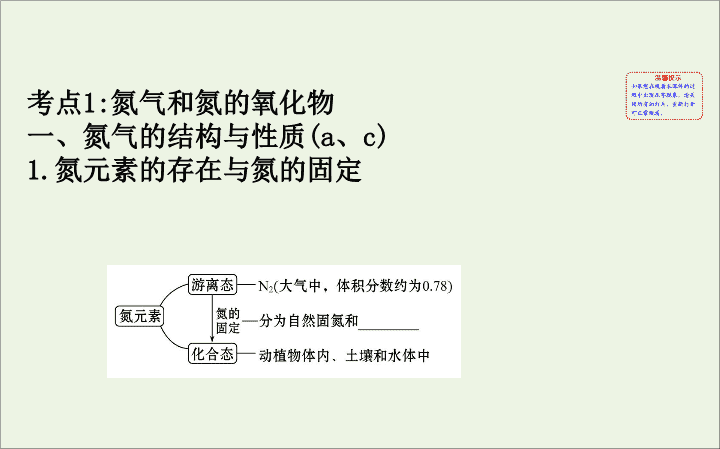
第四单元 生产生活中的含氮化合物 考点 1: 氮气和氮的氧化物 一、氮气的结构与性质 (a 、 c) 1. 氮元素的存在与氮的固定 2.N 2 的结构及性质 写出有关反应的化学方程式 : ①________________; ②_____________________; ③_____________ 。 3Mg+N 2 Mg 3 N 2 N 2 +3H 2 2NH 3 N 2 +O 2 2NO △ ==== 高温、高压 催化剂 放电 ==== 二、氮的氧化物 (a) (1) 氮有多种价态的氧化物 , 如 ___ 、 ___ 、 ___ 、 ____ 、 N 2 O 3 、 N 2 O 5 等 , 其中属于酸性氧化物的是 _________;NO 2 与 N 2 O 4 相互转化的化学方程式 :_____________ 。 N 2 O NO NO 2 N 2 O 4 N 2 O 3 、 N 2 O 5 2NO 2 N 2 O 4 (2)NO 和 NO 2 的比较 : NO NO 2 颜色、毒性 ___ 色 ,_____ _____ 色 ,_____ 溶解性 _____ 于水 易溶于水 与 O 2 或与 H 2 O 反应 2NO+O 2 ==== 2NO 2 3NO 2 +H 2 O====________ 无 有毒 红棕 有毒 难溶 2HNO 3 +NO NO NO 2 制备 Cu 与稀硝酸反应 Cu 与浓硝酸反应 收集方法 _______ _____________ 与人体、环 境的关系 ① 与 _________ 结 合 , 使人中毒 ②转化成 NO 2 , 形 成酸雨、光化学 烟雾 形成酸雨、 _____ _______ 排水法 向上排空气法 血红蛋白 光化 学烟雾 (3) 常见 NO x 的尾气处理方法 : ① 碱液吸收法 2NO 2 +2NaOH====NaNO 3 +NaNO 2 +H 2 O NO 2 +NO+2NaOH====2NaNO 2 +H 2 O ② 催化转化 : 在催化剂、加热条件下 , 氨将氮氧化物转化为无毒气体 (N 2 ) 或 NO x 与 CO 在一定温度下催化转化为无毒气体 (N 2 和 CO 2 ) 。一般适用汽车尾气的处理。 【 典例精析 】 【 典例 】 足量铜与一定量浓硝酸反应 , 得到硝酸铜溶液和 NO 2 、 N 2 O 4 、 NO 的混合气体 , 这些气体与 1.68 L O 2 ( 标准状况 ) 混合后通入水中 , 所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 5 mol·L -1 NaOH 溶液至 Cu 2+ 恰好完全沉淀 , 则消耗 NaOH 溶液的体积是 ( ) A.60 mL B.45 mL C.30 mL D.15 mL 【 解析 】 选 A 。 NO 2 、 N 2 O 4 、 NO 的混合气体 , 这些气体与 1.68 L O 2 ( 标准状况 ) 混合后通入水中 , 完全生成 HNO 3 , 则整个过程中 HNO 3 反应前后没有变化 , 即 Cu 失去的电子都被 O 2 得到了 , 根据得失电子守恒 : n (Cu) × 2= n (O 2 ) × 4= 解得 : n (Cu)=0.15 mol, 所以 Cu(NO 3 ) 2 为 0.15 mol, 根据 Cu 2+ ~ 2OH - 0.15 mol n (OH - ) 则 NaOH 为 0.15 mol × 2=0.3 mol, 则 NaOH 体积 V = =0.06 L, 即 60 mL 。 【 强化训练 】 1. 思维诊断 ( 正确的打“√” , 错误的打“ ×”) (1) 食品袋中充氮气可用来防腐。 ( ) 提示 : √ 。氮气的化学性质稳定 , 可用来防腐。 (2) 氮的氧化物和硫的氧化物既是形成光化学烟雾 , 又是形成酸雨的主要物质。 ( ) 提示 : × 。硫的氧化物不能形成光化学烟雾。 (3)CO 、 NO 、 NO 2 都是大气污染气体 , 在空气中都能稳定存在。 ( ) 提示 : × 。 NO 能与空气中的氧气反应。 (4) 在实验室里 ,NO 和 NO 2 均用排水法收集。 ( ) 提示 : × 。 NO 不溶于水 , 用排水法收集 ,NO 2 可与水反应 , 不可用排水法收集。 (5) 可用 NO 2 与水反应制取硝酸 , 故 NO 2 是酸性氧化物。 ( ) 提示 : × 。 NO 2 与水反应时除生成硝酸 , 还有 NO 生成 , 故 NO 2 不是酸性氧化物。 (6)NO 2 溶于水时 ,NO 2 是氧化剂 , 水是还原剂。 ( ) 提示 : × 。 3NO 2 +H 2 O====2HNO 3 +NO,NO 2 既是氧化剂 , 又是还原剂。 2. 常温常压下 , 注射器甲中装有 NO 2 气体 , 注射器乙中装有相同体积的空气 , 注射器与 U 形管连通 , 固定活塞。如图所示 , 打开两个止水夹 , 足够时间后 , 将会看到 U 形管中液面 世纪金榜导学号 ( ) A.a 端上升 ,b 端下降 B.a 端下降 ,b 端上升 C.U 形管中液面无变化 D. 无法判断 【 解析 】 选 A 。打开两个止水夹后 , 甲中 NO 2 与水反应生成 HNO 3 和 NO,U 形管中左侧气体压强减小 ,a 端液面上升 ,b 端下降。 3. 同温同压下 , 在 3 支相同体积的试管中分别充有等体积混合的 2 种气体 , 它们是① NO 和 NO 2 ,②NO 2 和 O 2 ,③NH 3 和 N 2 。将 3 支试管均倒置于盛水的水槽中 , 充分反应后 , 试管中剩余气体的体积分别为 V 1 、 V 2 、 V 3 , 则下列关系正确的是 ( ) A. V 1 > V 2 > V 3 B. V 1 > V 3 > V 2 C. V 2 > V 3 > V 1 D. V 3 > V 1 > V 2 【 解析 】 选 B 。设各种气体的体积都为 1 。①根据 3NO 2 +H 2 O====2HNO 3 +NO, 即剩余 NO 的体积 V 1 =(1+ ) 体 积。②根据 4NO 2 +O 2 +2H 2 O====4HNO 3 , 即剩余 O 2 的体积 V 2 = (1- ) 体积。③剩余 N 2 的体积 V 3 =1 体积。即 B 项符合 题意。 4. 将充有 m mL NO 和 n mL NO 2 气体的试管倒立于水槽中 , 然后通入 m mL O 2 , 若已知 n > m , 则充分反应后 , 试管中的气体在同温同压下的体积为 ( ) A. B. C. D.3( n - m ) mL 【 解析 】 选 B 。根据 3NO 2 +H 2 O====2HNO 3 +NO 知 , n mL NO 2 气体反应后生成 mL NO 气体 , 再根据 4NO+3O 2 +2H 2 O ====4HNO 3 得 ,( m + )∶ m >4∶3, 可知 NO 过量 , 故剩余的 体积为 ( m + ) mL- mL= mL 。 5. 汽车尾气主要含有 CO 2 、 CO 、 SO 2 、 NO x 等物质 , 这种尾气逐渐成为城市空气污染的主要来源之一。 (1) 汽车尾气中的 CO 来自 ________,NO 来自 ________ 。汽车尾气对环境的危害主要有 _________( 至少填两种 ) 。 (2)NO x 能形成酸雨 , 写出 NO 2 转化为 HNO 3 的化学方程式 : ____________________ 。 (3) 汽车尾气中的 CO 、 NO x 在适宜温度下采用催化转化法处理 , 使它们相互反应生成参与大气循环的无毒气体。写出 NO 被 CO 还原的化学方程式 :______________ 。 【 解析 】 (1) 汽车汽缸内不断进行着汽油的燃烧反应 , 当空气不足时 , 汽油不完全燃烧 , 会产生 CO; 当空气过量时 ,N 2 和 O 2 在放电或高温条件下反应生成 NO 。汽车尾气对环境的危害很大 , 可以形成硝酸型酸雨 , 导致光化学烟雾 , 产生温室效应。 (3)CO 、 NO 反应后生成的无毒气体为 CO 2 和 N 2 。 答案 : (1) 汽油的不完全燃烧 N 2 与 O 2 在汽车汽缸内的高 温环境下的反应 形成硝酸型酸雨、导致光化学烟雾、 产生温室效应 ( 任填两种即可 ) (2)3NO 2 +H 2 O==== 2HNO 3 +NO (3)2CO+2NO N 2 +2CO 2 催化剂 ===== 【 加固训练 】 N 2 O 俗称“笑气” , 医疗上曾用作可吸入性麻醉剂 , 以下反应能产生 N 2 O:3CO+2NO 2 3CO 2 +N 2 O 。下列 关于 N 2 O 的说法一定正确的是 ( ) A. 上述反应中 , 每消耗 2 mol NO 2 , 就会生成 22.4 L N 2 O B.N 2 O 有氧化性 , 且为 HNO 2 的酸酐 C. 等质量的 N 2 O 和 CO 2 含有相等的电子数 D.N 2 O 会迅速与人体血红蛋白结合 , 使人中毒 【 解析 】 选 C 。 A 项 , 该反应中每消耗 2 mol NO 2 , 会生成 1 mol N 2 O, 但没有说明温度和压强 , 故不一定是 22.4 L, 错误 ;B 项 ,HNO 2 的酸酐为 N 2 O 3 , 错误 ;D 项 , 题干已指出 N 2 O 曾用作可吸入性麻醉剂 , 说明其无毒或毒性非常小 , 不会迅速与人体血红蛋白结合 , 使人中毒 , 错误。 【 归纳总结 】 (1) 氮氧化物溶于水的问题分析 无论是单一气体 (NO 2 ), 还是 NO 、 NO 2 、 O 2 中的两者或三者的混合气体 , 反应的实质是 3NO 2 +H 2 O====2HNO 3 +NO,2NO+O 2 ====2NO 2 , 故若有气体剩余只能是 NO 或 O 2 , 不可能是 NO 2 。 ① 若 NO 和 O 2 通入水中 , 总关系式为 4NO+3O 2 +2H 2 O==== 4HNO 3 (4∶3) 。 ②若 NO 2 和 O 2 通入水中 , 总关系式为 4NO 2 +O 2 +2H 2 O==== 4HNO 3 (4∶1) 。 (2)NO x 与 NaOH 溶液反应问题分析 ① NO 2 能被 NaOH 溶液吸收生成 2 种盐。 ② NO 不能被 NaOH 溶液吸收。 ③ n (NO 2 )∶ n (NO)≥1 时能完全被 NaOH 溶液吸收。 考点 2: 氨和铵盐 一、氨 (b) 氨气的性质与制备 (1)NH 3 的结构和物理性质 电子式 结构式 密度 颜色 气味 水溶性 特点 ________ _______ 比空 气小 ___ 色 刺 激 性 _____ 溶于 水 ___ 液 化 无 极易 易 (2) 氨的化学性质 (3) 氨气的实验室制法 ①常规方法 : 固 + 固 NH 3 △ ② 其他方法 : 方法 化学方程式 ( 或原理 ) 气体发生装置 加热浓 氨水 NH 3 ·H 2 O NH 3 ↑+H 2 O △ ==== 方法 化学方程式 ( 或原理 ) 气体发生装置 浓氨水 + 固体 CaO CaO 与水反应 , 使溶剂 ( 水 ) 减少 ; 反应放热 , 促使氨水分解。化学方程式为 NH 3 ·H 2 O+CaO====NH 3 ↑+ Ca(OH) 2 (4) 用途 制硝酸、铵盐、纯碱、尿素、制冷剂等。 二、铵盐 (b) 1. 化学性质 2. 的检验 【 典例精析 】 【 典例 1】 某学习兴趣小组探究氨气的制取实验 : 世纪金榜导学号 (1) 甲同学拟用下列实验方法制备氨气 , 其中合理的是 ________( 填字母 ) 。 A. 将氯化铵固体加热分解收集产生的气体 B. 将浓氨水滴入氢氧化钠固体中 , 收集产生的气体 C. 将碳酸氢铵加热分解产生的气体用碱石灰干燥 D. 将氯化铵稀溶液滴入氢氧化钠固体中 , 收集产生的气体 (2) 根据上述正确的原理 , 该同学欲用下列常见的实验室制气装置制取氨气 , 适宜的装置是 ________ 。 (3) 气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是 ____________( 填序号 ) 。 ①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应 (4) 下图是甲同学设计收集氨气的几种装置 , 其中可行的是 ________, 集气的原理是 __________ 。 【 解题思路 】 (1) 根据所给物质的性质以及氨的性质进行分析。 (2) 根据氨的制备原理及药品性质选择装置。 (3) 收集气体主要有排气法和排液法 , 主要利用了气体的密度、溶解性等。 (4) 氨气极易溶于水、密度比空气小。 【 解析 】 (1) 加热氯化铵产生氯化氢和氨气 , 遇冷又转 化为氯化铵固体 , 不能制取氨气 ; 用浓氨水与氢氧化钠 固体混合制氨气时 , 将氨水滴入氢氧化钠固体中更方便 操作 , 而且节约氨水的用量。 (2) 将浓氨水滴入氢氧化 钠固体中制氨气用 C 装置 , 将碳酸氢铵加热分解 , 产生的 气体用碱石灰干燥制氨气选用 D 装置。 (3) 收集气体可 采用排空气法 ( 气体密度、气体不能被氧气氧化等 ), 也可采用排水法 ( 不易溶于水 ), 与其他性质无关。 (4) 氨气极易溶于水 , 故采用向下排空气法收集。 答案 : (1)B 、 C (2)C 、 D (3)②④ (4)d 利用氨气密度小于空气 , 采用短管进氨气 , 长管出空气 , 即可收集氨气 【 考题变式 】 (1) 在 (2) 中更换为下图装置用于实验室制取氨气 ( 夹持装置略 ) 。 是否可行 ? 提示 : 不可行。应将试管内固体更换为氯化铵与氢氧化钙 , 且氨气不能用排水法收集。 (2) 用 (2) 中 B 装置加热氯化铵与氢氧化钙固体制取氨气时 , 能否用 NaOH 代替 Ca(OH) 2 ? 提示 : 不能。 Ca(OH) 2 不能用 KOH 或 NaOH 代替 , 因两者易吸湿 , 易结块 , 不利于产生 NH 3 , 且高温下腐蚀试管。 【 典例 2】 某课外活动小组欲利用 CuO 与 NH 3 反应 , 研究 NH 3 的某种性质并测定其组成 , 设计了如下实验装置 ( 夹持装置未画出 ) 进行实验。请回答下列问题 : (1) 仪器 a 的名称为 ________ 。 (2) 实验室中 , 利用装置 A, 还可制取的无色气体是 ____ ( 填字母 ) 。 A.Cl 2 B.O 2 C.CO 2 D.NO 2 (3) 实验中观察到装置 C 中黑色 CuO 粉末变为红色固体 , 量气管有无色无味的气体生成 , 上述现象证明 NH 3 具有 ______ 性 , 写出相应的化学方程式 ______________ ____________ 。 (4)E 装置中浓硫酸的作用 ______________ 。 (5) 读取气体体积前 , 应对装置 F 进行的操作 :_______ __________________ 。 (6) 实验完毕 , 若测得干燥管 D 增重 m g, 装置 F 测得气体的体积为 n L( 已折算成标准状况 ), 则氨分子中氮、氢的原子个数比为 ________( 用含 m 、 n 字母的代数式表示 ) 。 【 解析 】 (1) 仪器 a 为分液漏斗。 (2) 氯气和二氧化氮是有色气体 , 故排除 A 、 D, 该装置适 用于固液混合不加热制取的气体 , 所以可以是氧气和二 氧化碳 , 故选 B 、 C 。 (3) 该反应中氧化铜被还原生成铜单质 , 所以氨气有还 原性 , 氨气和氧化铜反应生成铜、水和氮气 , 反应方程 式为 3CuO+2NH 3 3Cu+3H 2 O+N 2 ↑ 。 △ ==== (4) 吸收未反应的氨气 , 阻止 F 中水蒸气进入 D 。 (5) 慢慢上下移动右边漏斗 , 使左右两管液面相平。 (6) 干燥管吸收的物质是水 , 收集的气体是氮气 , 水的物 质的量为 所以含有的氢原子物质的量为 mol, 氮气的物质的量为 所以氮原子 的物质的量为 mol, 所以氨分子中氮、氢的原子个 数比为 答案 : (1) 分液漏斗 (2)B 、 C (3) 还原 3CuO+2NH 3 3Cu+3H 2 O+N 2 ↑ (4) 吸收未反应的氨气 , 阻止 F 中水蒸气进入 D (5) 慢慢上下移动右边漏斗 , 使左右两管液面相平 (6) △ ==== 【 考题变式 】 (1) 若将装置 B 撤去 , 则最后所得氨分子中氮、氢原子个数比与实际值相比有什么变化 ? 提示 : 偏小。若撤去装置 B, 则进入 C 中的氨气中会混有少量的水蒸气 , 使干燥管 D 增重偏大 , 即会使氢原子的量增大。 (2) 若读取气体体积时 , 装置 F 右边漏斗中液面低于左侧量气管中液面 , 则所测得氨分子中氮、氢原子个数比与实际值相比有什么变化 ? 提示 : 偏大。若装置 F 右边漏斗中液面低于左侧液面 , 则装置中气体压强小于外界大气压 , 此时气体的体积偏大 , 即 N 2 体积偏大 , 则氮、氢原子个数比偏大。 【 强化训练 】 1. 思维诊断 ( 正确的打“√” , 错误的打“ ×”) (1)NH 4 HCO 3 受热易分解 , 可用作氮肥。 ( ) 提示 : × 。 NH 4 HCO 3 中含有氮元素 , 可用作氮肥。 (2) 将红热的铂丝伸入盛浓氨水的锥形瓶中 , 瓶口出现少量红棕色气体 , 说明氨气的氧化产物为 NO 2 。 ( ) 提示 : × 。氨气催化氧化生成一氧化氮 , 一氧化氮与空气中的氧气反应生成二氧化氮。 (3) 取少量试液于试管中 , 加入 NaOH 溶液并加热 , 用湿润 的红色石蕊试纸检验产生的气体 , 检验溶液中是否含 。 ( ) 提示 : √ 。向含 的溶液中加入 NaOH 溶液并加热 , 用 湿润的红色石蕊试纸检验产生的气体即可。 (4) 加热盛有 NH 4 Cl 的试管 , 试管底部有固体消失 , 试管口有晶体凝结 , 说明 NH 4 Cl 固体可以升华。 ( ) 提示 : × 。不是升华 , 试管底部 NH 4 Cl 分解生成 NH 3 和 HCl, 试管口 NH 3 与 HCl 反应生成了 NH 4 Cl, 发生了化学反应。 (5)NH 4 Cl 溶液与 Ca(OH) 2 溶液混合的离子方程式为 +OH - ====NH 3 ↑+H 2 O 。 ( ) 提示 : × 。 NH 4 Cl 溶液与 Ca(OH) 2 溶液混合产生 NH 3 ·H 2 O 。 2. 如图 , 利用培养皿探究氨气的性质。实验时向 NaOH 固体上滴几滴浓氨水 , 立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是 ( ) 世纪金榜导学号 选项 实验现象 解释 A 浓盐酸附近产生白烟 NH 3 与浓盐酸反应产生了 NH 4 Cl 固体 B 浓硫酸附近无明显现象 NH 3 与浓硫酸不发生反应 C 氯化物溶液变浑浊 该溶液一定是 AlCl 3 溶液 D 干燥红石蕊试纸不变色 , 湿润红石蕊试纸变蓝 NH 3 是一种可溶性碱 【 解析 】 选 A 。实验时向 NaOH 固体上滴几滴浓氨水 , NaOH 固体溶于水放热 , 氨水易挥发 , 会产生氨气 , 与浓盐 酸反应生成氯化铵 , 反应现象是有白烟生成 , 故 A 正确 ; 氨气为碱性气体 , 与浓硫酸发生中和反应生成硫酸铵 , 故 B 错误 ; 氨气与氯化物发生复分解反应生成氢氧化物 , 如氯化物溶液变浑浊 , 可能生成难溶性氢氧化物 , 但不 一定为 Al(OH) 3 , 也可能为 Mg(OH) 2 等沉淀 , 故 C 错误 ; 氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成 NH 3 ·H 2 O, 电离产生 OH - , 溶液呈碱性 , 氨气为非电解质 , 不属于碱 , 故 D 错误。 3. 根据如图装置回答下列问题。 (1) 该装置能否制得纯净、干燥的 NH 3 ?________, 原因是 ________________ 。 (2) 若要制得纯净、干燥的 NH 3 , 若还是选用一种固体药品 , 应选择 ________, 其原理是 __________________ __________ 。 ( 结合方程式和必要的文字说明 ) (3) 在实验室中还可以把浓氨水滴入 NaOH 固体中 , 制备 NH 3 , 下列适宜的装置是 ________ 。 其收集装置可以选用 ________ 。 尾气处理装置可以选用 ________ 。 答案 : (1) 不能 NH 4 Cl 固体受热分解生成 NH 3 和 HCl, 它们 在试管口又重新生成 NH 4 Cl (2)NH 4 HCO 3 [ 或 (NH 4 ) 2 CO 3 ] NH 4 HCO 3 NH 3 ↑+H 2 O+CO 2 ↑ [ 或 (NH 4 ) 2 CO 3 2NH 3 ↑+H 2 O+CO 2 ↑], 生成的 H 2 O 和 CO 2 可 以被碱石灰吸收 , 可制得纯净、干燥的 NH 3 (3)③ A bd △ ==== △ ==== 【 加固训练 】 某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。 (1) 装置 A 中烧瓶内试剂可选用 ________( 填序号 ) 。 a. 碱石灰 b. 浓硫酸 c. 生石灰 d. 五氧化二磷 e. 烧碱固体 (2) 若探究氨气的溶解性 , 需在 K 2 的导管末端连接下表装置中的 ________( 填序号 ), 当装置 D 中集满氨气后 , 关闭 K 1 、 K 2 , 打开 K 3 , 引发喷泉的实验操作是 ____________ ____________ 。 备选装置 ( 其中水中含酚酞溶液 ) Ⅰ Ⅱ Ⅲ (3) 若探究氨气的还原性 , 需打开 K 1 、 K 3 ,K 2 处导管连接制取纯净、干燥氯气的装置。 ①用二氧化锰与浓盐酸制取氯气 , 生成气体必须通过盛有 ________ 试剂的洗气瓶。 ② D 中氨气与氯气反应产生白烟 , 同时生成一种无色无味的气体 , 该反应的化学方程式为 _________________ ____________ 。 ③ 从 K 3 处导管逸出的气体中含有少量 Cl 2 , 则 C 装置中应盛放 ________ 溶液 ( 填化学式 ), 反应的离子方程式为 _________________ 。 【 解析 】 (1) 在浓氨水中存在平衡 :NH 3 +H 2 O NH 3 ·H 2 O +OH - , 加入生石灰 [CaO+H 2 O====Ca(OH) 2 ] 或 NaOH 固体 , 平衡左移 , 同时放出大量的热促进氨水的挥发。 碱石灰的成分是烧碱和生石灰 , 将浓氨水加入碱石灰 中能快速制备氨气。 (2) 氨气极易溶于水 , 不溶于 CCl 4 , 要用防倒吸装置 , 因此选择 Ⅱ 或 Ⅲ 。要使装置 D 发生喷泉现象 , 必须使烧瓶中的压强迅速降低 , 形成内外压强差。用热毛巾将烧瓶焐热 , 可使 D 中氨气受热膨胀 , 通过导管后溶于水 ,D 中压强变小即产生“喷泉”。 (3) ① 用二氧化锰与浓盐酸制取的氯气中 , 混有氯化氢气体和水蒸气 , 通过饱和食盐水除去氯化氢 , 通过浓硫酸除去水蒸气。 ② 探究氨气具有还原性 , 氯气与氨气反应产生白烟 , 联系反应 NH 3 +HCl====NH 4 Cl 可知 ,“ 白烟”的成分为氯化铵 , 氯元素化合价降低 , 则生成的“无色无味气体”必为氨气的氧化产物 , 可推知为氮气。 ③ 氯气是有毒气体 , 可与强碱溶液反应 , 因此可用氢氧化钠溶液进行尾气吸收。 答案 : (1)ace (2) Ⅱ 或 Ⅲ 用热毛巾将烧瓶焐热片刻 ( 其他合理答案均可 ) (3) ① 饱和食盐水、浓硫酸 ② 3Cl 2 +8NH 3 ==== 6NH 4 Cl+N 2 ③ NaOH Cl 2 +2OH - ====Cl - +ClO - +H 2 O 【 归纳总结 】 氨气实验室制法的注意事项 (1) 实验室用固体铵盐与碱共热制 NH 3 时 , 不能使用 NH 4 HCO 3 、 NH 4 NO 3 及 NaOH 固体 , 因为 NH 4 HCO 3 受热分解产生 CO 2 , 使制得的 NH 3 不纯 ;NH 4 NO 3 受热时易发生爆炸 ;NaOH 容易吸水结块 , 不利于 NH 3 的产生和逸出 , 且加热条件下 NaOH 容易腐蚀玻璃。 (2) 干燥氨气时不能选用酸性干燥剂 , 如浓硫酸、 P 2 O 5 等 , 也不能选用无水 CaCl 2 , 因为它们均能与 NH 3 发生反应 , 通常选用碱石灰。 (3) 吸收氨气 ( 或 HCl) 时要注意防止倒吸。 可用于吸收氨气 ( 或 HCl) 并能防倒吸的常用装置为 (4) 实验室制取氨气的简易方法 方法 化学方程式 ( 或原理 ) 发生装置 加热 浓氨水 NH 3 · H 2 O NH 3 ↑+H 2 O △ ==== 方法 化学方程式 ( 或原理 ) 发生装置 浓氨水 + 固体 NaOH NaOH 溶于水放热 , 促使氨水分解 , 且 OH - 浓度的增大有利于 NH 3 的生成 浓氨水 + 固体 CaO CaO 与水反应 , 使水减少 ; 反应放热 , 促使氨水分解。化学方程式 NH 3 · H 2 O+CaO==== NH 3 ↑+Ca(OH) 2 考点 3: 硝酸及氮的转化 一、硝酸 (a 、 b 、 c) 1. 硝酸的物理性质 : 2. 硝酸的化学性质 (1) 不稳定性 反应 :___________________________ 。 4HNO 3 2H 2 O+4NO 2 ↑+O 2 ↑ (2) 强氧化性 硝酸无论浓、稀都有强氧化性 , 而且浓度越大氧化性越强。 按要求完成下列反应的化学方程式 : ① 与金属反应 : 稀硝酸与铜反应 : _____________________________________; 浓硝酸与铜反应 : ___________________________________ 。 3Cu+8HNO 3 ( 稀 )====3Cu(NO 3 ) 2 +2NO↑+4H 2 O Cu+4HNO 3 ( 浓 )====Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O ② 与非金属反应 : 浓硝酸与 C 的反应 : _______________________________; C+4HNO 3 ( 浓 ) CO 2 ↑+4NO 2 ↑+2H 2 O △ ==== ③ 与还原性化合物反应 : 硝酸可氧化 H 2 S 、 SO 2 、 Na 2 SO 3 、 HI 、 Fe 2+ 等还原性物质。 稀硝酸与 FeSO 4 溶液反应的离子方程式 : ________________________________ 。 3Fe 2+ +4H + + ====3Fe 3+ +NO↑+2H 2 O (3) 与有机物反应 ①硝化反应 ( 与 C 6 H 6 反应 ): _________________________; ② 颜色反应 : 蛋白质遇到浓硝酸时变黄色。 C 6 H 6 +HNO 3 C 6 H 5 NO 2 +H 2 O 浓硫酸 △ 二、含氮物质的转化 (c) 1. 氮及其化合物的转化关系 : 2. 含氮物质的化合价变化及规律 : (1) 氮元素间的歧化和归中。 歧化 :3NO 2 +H 2 O====2HNO 3 +NO; 2NO 2 +2NaOH====NaNO 3 +NaNO 2 +H 2 O 。 归中 :6NO+4NH 3 ====5N 2 +6H 2 O; NO 2 +NO+2NaOH====2NaNO 2 +H 2 O 。 (2) 含氮物质的连续氧化。 NH 3 ___ ___ ____; N 2 ___ ___ ____ 。 NO NO 2 HNO 3 NO NO 2 HNO 3 【 典例精析 】 【 典例 】 在浓硝酸中放入铜片 : 世纪金榜导学号 (1) 开始反应的化学方程式为 _____________, 实验现象为 ________________________ 。 (2) 若铜有剩余 , 则反应将要结束时的化学方程式是 ______________________________ 。 (3) 待反应停止后 , 再加入少量质量分数为 25% 的稀硫酸 , 这时铜片上又有气泡产生 , 其原因是 ____________ ________________ 。 (4) 若将 12.8 g 铜跟一定量的浓硝酸反应 , 铜耗完时 , 共产生气体 (NO 和 NO 2 的混合物 )5.6 L( 标准状况 ) 。则所消耗的硝酸的物质的量是 ________, 所得气体的平均相对分子质量为 ________ 。 【 解题思路 】 浓硝酸与铜反应 , 开始时生成 NO 2 , 随着反应的进行 , 硝酸浓度降低 , 生成 NO 。此时反应混合溶液中仍有大量硝酸根离子 , 当加入稀硫酸时 , 又会发生反应生成 NO 。第 (4) 问可根据反应时硝酸最终变为硝酸铜和 NO x , 利用原子守恒和电子得失守恒的方法进行分析计算。 【 解析 】 (2) 随着反应的进行 , 硝酸浓度不断减小 , 故反应后阶段发生的是铜与稀硝酸的反应。 (4) 有关金属与硝酸反应的计算是考查的热点 , 在解决问题的时候要多从原子守恒和电子守恒的角度来思考 , 如硝酸在反应中有两个去处 : 一个是硝酸盐 ; 一个是 NO 或 NO 2 气体。在计算时可以从这个角度入手 , 去解决有关硝酸消耗的题目。 n (NO x )= =0.25 mol, 故消耗 n (HNO 3 )= 2 n (Cu)+ n (NO x )=2 × +0.25 mol=0.65 mol 。 设产生 NO 2 的物质的量为 x , 则 NO 的物质的量为 (0.25 mol - x ) 。根据得失电子守恒 , 得下列方程 x × 1+(0.25 mol- x ) × 3= 解得 x =0.175 mol =41.2 g·mol -1 故所得气体的平均相对分子质量为 41.2 。 答案 : (1)Cu+4HNO 3 ( 浓 )====Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O 铜片逐渐溶解 , 溶液逐渐变蓝 , 有红棕色气体逸出 (2)3Cu+8HNO 3 ( 稀 )====3Cu(NO 3 ) 2 +2NO↑+4H 2 O (3) 加入稀硫酸后 , 原溶液中的 NO 与 H 2 SO 4 提供的氢离子构成强氧化性的条件 , 又能与过量的 Cu 反应 (4)0.65 mol 41.2 【 考题变式 】 若 (4) 问改为铜与一定量浓硝酸反应 , 得到硝酸铜溶液和 NO 2 、 N 2 O 4 、 NO 的混合气体 , 这些气体与 5.6 L O 2 ( 标准状况 ) 混合后通入水中 , 所有气体完全被水吸收生成硝酸。则消耗铜的质量为 ________g 。 提示 : 32 。 HNO 3 NO x HNO 3 ⇒ 铜转移电子的物质 的量与氧气转移电子的物质的量相等。 【 强化训练 】 1. 下列说法不正确的是 ( ) A. 在稀硫酸中加入铜粉 , 铜粉不溶解 , 再加入 KNO 3 固体 , 铜粉仍不溶解 B. 某气体能使湿润的红色石蕊试纸变蓝 , 该气体的水溶液一定显碱性 C. 铜与稀硝酸反应的离子方程式为 3Cu+8H + +2 ==== 3Cu 2+ +2NO↑+4H 2 O D.HNO 3 NO NO 2 , 以上各步变化均能通过一步实验 完成 【 解析 】 选 A 。 A 项中加入 KNO 3 固体后 ,Cu 和 H + 、 发 生反应 :3Cu+8H + +2 ====3Cu 2+ +2NO↑+4H 2 O,A 错误 ; 气体能使湿润的红色石蕊试纸变蓝 , 该气体的水溶液一 定显碱性 ,B 正确 ;C 、 D 正确。 2.(2019· 湛江模拟 ) 下列图象表示铁跟一定量硝酸反应时 , 铁和硝酸铁物质的量 (mol) 之间的关系 , 其中正确的是 世纪金榜导学号 ( ) 【 解析 】 选 B 。硝酸与铁反应时 , 随着铁的物质的量的 增加 , 先后发生下列反应 :4HNO 3 ( 稀 )+Fe====Fe(NO 3 ) 3 +NO↑+2H 2 O[ 或 6HNO 3 ( 浓 )+Fe Fe(NO 3 ) 3 +3NO 2 ↑ +3H 2 O],2Fe(NO 3 ) 3 +Fe====3Fe(NO 3 ) 2 , 可见生成 Fe(NO 3 ) 3 消耗的 Fe 与 Fe(NO 3 ) 3 变为 Fe(NO 3 ) 2 消耗的 Fe 的物质的 量之比为 2∶1, 故图象 B 正确。 △ ==== 3. 某化学兴趣小组进行有关 Cu 、硝酸、硫酸化学性质的实验 , 实验过程如图所示。下列有关说法正确的是 ( ) A. 实验①中溶液呈蓝色 , 试管口有红棕色气体产生 , 说明稀硝酸被 Cu 还原为 NO 2 B. 实验③中滴加稀硫酸 , 铜片继续溶解 , 说明稀硫酸的氧化性比稀硝酸强 C. 实验③发生反应的化学方程式为 3Cu+Cu(NO 3 ) 2 +4H 2 SO 4 ====4CuSO 4 +2NO↑+4H 2 O D. 由上述实验可以得出结论 :Cu 在常温下既可以和稀硝酸反应 , 也可以和稀硫酸反应 【 解析 】 选 C 。稀硝酸被 Cu 还原为 NO,A 项错误 ;Cu 与稀硫酸不反应 , 但硝酸铜在酸性溶液中具有硝酸的强氧化性 , 继续与 Cu 反应 , 稀硫酸的氧化性比稀硝酸弱 ,B 项错误 ; 实验③发生反应的化学方程式为 3Cu+Cu(NO 3 ) 2 +4H 2 SO 4 ====4CuSO 4 +2NO↑+4H 2 O,C 项正确 ; 由上述实验可得出结论 :Cu 在常温下可以和稀硝酸反应 ,D 项错误。 4. 如图是中学化学中常见物质间的反应转化关系图 , 其中部分产物已略去。常温下 ,G 为固体单质 ,B 、 I 为液体 , 其余都为气体。 A 为化合物 ,I 的浓溶液与 G 在加热条件下生成 F 、 B 和 C 。 H 可用作工业上冶炼金属的还原剂。请按要求填空 : (1) 写出下列物质的化学式 : A________,B________,C________ 。 (2) 写出 F+B I 的化学方程式 ______________, A+E D 的化学方程式 ______________ 。 (3) 写出 G 和 I 的浓溶液反应的化学方程式 __________ ____________________ 。 【 解析 】 液体 B 能被电解说明 B 是 H 2 O, 则 E 是 H 2 或 O 2 , 又根 据气体 A 与 E 反应条件为催化剂加热 , 反应产物 D 又和 E 反 应生成 F, 可确定 E 是 O 2 ,A 是 NH 3 , 则 D 是 NO,F 是 NO 2 ,F 与 B(H 2 O) 反应生成的 I 是 HNO 3 。固体单质 G 与 I 的浓溶液 (HNO 3 ) 在加热条件下反应生成 F(NO 2 ) 、 B(H 2 O) 和 C,C 为 一种气体 , 猜测 G 可能是碳 , 则 C 是 CO 2 ;CO 2 与碳高温下反 应生成 H(CO),G(C) 与 E(O 2 ) 反应也可生成 H(CO), 而 CO 可 用作还原剂 , 在工业上可冶炼铁 , 进而可确定 G 是碳。 答案 : (1)NH 3 H 2 O CO 2 (2)3NO 2 +H 2 O====2HNO 3 +NO 4NH 3 +5O 2 4NO+6H 2 O (3)C+4HNO 3 ( 浓 ) CO 2 ↑+4NO 2 ↑+2H 2 O 催化剂 △ ==== △ ==== 【 加固训练 】 1. 当硝酸与金属和非金属反应时 , 反应物或反应条件不同 , 硝酸被还原的产物也不同。请回答下列问题 : (1) 金属 Zn 与某浓度的硝酸反应时无气体产生 , 那么硝酸的还原产物为 __________( 填化学式 ) 。 (2) 某混酸由 200 mL 3 mol·L -1 的稀硝酸和 200 mL 2.5 mol·L -1 的稀硫酸均匀混合而成 ( 忽略溶液的体积变化 ) 。将其分成两等份 , 分别与铜和铁反应 , 还原产物只有 NO, 则最多能溶解 ________mol Cu 和 ________g Fe 。 (3)200 mL 16 mol·L -1 的浓硝酸与 3.2 g Cu 反应 , 反应 过程中还原产物只有 NO 2 , 则反应结束后 , 产生气体的体 积为 __________( 标准状况下 ), 溶液中 c (H + )∶ c ( ) =____∶____( 忽略 HNO 3 的挥发 ) 。 (4) 用试管将 (3) 反应产生的 NO 2 收集满并倒立在足量的水中 , 待试管中液面不再上升时 , 试管中剩余气体的体积约为原气体体积的 __________ 。试管中的液体的物质的量浓度为 __________( 假设试管中的液体不对外扩散 , 此反应条件下 1 mol 气体的体积为 25.0 L) 。如果 NO 2 中混有 N 2 O 4 气体 , 试管中的液体的物质的量浓度将 __________( 填“增大”“减小”或“不变” ) 。 【 解析 】 (1) 硝酸被还原 , 氮元素化合价降低 , 若无气体产生 , 则还原产物为 NH 4 NO 3 。 (2) 设最多溶解 x mol Cu, 一份溶液中 n ( )=0.3 mol, n (H + )=0.8 mol 据 3Cu+8H + + 2 ====3Cu 2+ +2NO↑+4H 2 O 3 8 2 x 0.8 0.3 可知 x =0.3( 过量 ) 因在反应中 Fe 和 Cu 的化合价变化均为 +2 价 , 则最多溶解 Fe 的物质的量是 0.3 mol, 质量为 56 g·mol -1 × 0.3 mol =16.8 g 。 (3) 据电子守恒 V (NO 2 )= × 2 × 22.4 L·mol -1 =2.24 L, 原溶液中硝酸的物质的量为 16 mol·L -1 × 0.2 L=3.2 mol, 根据方程式 :Cu+4H + +2 =Cu 2+ + 2NO 2 ↑+2H 2 O 可知 : 生成 2.24 L NO 2 消耗 0.1 mol, 消耗 H + 0.2 mol, 则 n (H + ) ∶ n ( )=(3.2-0.2) ∶ (3.2-0.1)=30 ∶ 31 。 (4) 根据方程式 3NO 2 +H 2 O====2HNO 3 +NO 可知试管中剩余 气体的体积约为原气体体积的 。设试管的体积为 1 L, 则试管中溶液 (HNO 3 ) 的物质的量浓度根据 c = 可 得 c = 若 NO 2 中混有 N 2 O 4 , 则根据 3N 2 O 4 +2H 2 O====4HNO 3 +2NO 可知 , 所得溶液的体积 减小 , n (HNO 3 ) 的物质的量增加 , 则 HNO 3 的物质的量浓度将增大。 答案 : (1)NH 4 NO 3 (2)0.3 16.8 (3)2.24 L 30 31 (4)1/3 0.04 mol·L -1 增大 2.[ 问题提出 ] 在检验 Cu 与稀硝酸反应的还原产物时 , 传统实验 , 通常是直接在试管中进行 , 由于试管中有空气 , 开始往往看到的是红棕色气体 , 导致实验现象与实验原理无法吻合。某校化学活动小组对这一实验进行了研究 , 并提出改进措施。 [ 研究目的与要求 ] (1) 克服传统实验的缺点 , 并能证明 Cu 与稀硝酸反应生成的是 NO 。 NO 不溶于水 , 可以与 O 2 反应产生红棕色的 NO 2 。 (2) 改进后的实验必须达到的要求 : 节约药品、操作简便、现象明显、减少污染。 [ 实验过程 ] 实验方案一 : (1) 按图 1 所示接好仪器 , 检查装置气密性的方法是 ____________________ 。 (2) 根据你对装置和研究目的的理解 , 请补充制取 NO 并验证 NO 不溶于水的实验操作 :_____________________ ____________________ 。 (3) 验证 NO 和 O 2 生成 NO 2 的实验操作和现象是 _________ ____________________ 。 实验方案二 : (4) 按图 2 所示连接装置 , 检查气密性后 , 在干燥管内加入 3.2 g 铜片 , 在烧杯中加入适量经过预热的稀硝酸。 (5) 打开止水夹 , 用注射器快速抽空干燥管内的空气 , 使稀硝酸充满整个干燥管 , 然后关闭止水夹。观察到的现象是 ____________________ 。 (6) 反应停止后 , 打开止水夹 , 用注射器将抽取的空气慢慢推入干燥管内 , 发现干燥管内的气体变成红棕色 , 且液面缓缓上升 ,Cu 和稀硝酸反应继续进行。不断充入 O 2 , 直至加入的 3.2 g Cu 完全反应 , 则共消耗的氧气在标准状况下的体积为 ________ L 。 【 解析 】 题干已经指出实验的不足 , 并提出了改进实验方案的要求 , 要克服实验的缺点 , 必须使反应在无 O 2 的环境中进行。 实验方案一 : (1) 根据实验装置图 1 可以确定检查装置气密性的方法是关闭活塞 , 从 U 形管的右端加水使两边产生液面差 , 静置一会 , 观察液面差是否缩小。 (2) 连接好装置 , 打开活塞 , 从 U 形管的右端快速注入稀硝酸 , 直到左端完全充满液体 , 关闭活塞 , 会发现 U 形管中液面左降右升 , 这就证明了生成的 NO 不溶于水。 (3) 打开分液漏斗的活塞 , 在压力作用下 ,NO 会进入分液漏斗内 , 与分液漏斗中的空气反应生成红棕色气体 NO 2 。 实验方案二 : (5) 根据操作和装置知反应时铜片表面有气泡产生 , 液面下降 , 溶液变蓝等现象。 (6) 根据电子守恒 :2 n (O 2 )= n (Cu)=3.2 ÷ 64=0.05(mol), V (O 2 )=0.56 L 。 答案 : (1) 关闭活塞 , 从 U 形管的右端加水 , 使两边产生液面差 , 静置一会 , 观察液面差是否缩小 (2) 连接好装置 , 打开活塞 , 从 U 形管的右端注入稀硝酸 , 直到左端完全充满液体 , 然后关闭活塞 , 观察现象 (3) 将活塞慢慢打开 , 观察到分液漏斗内有红棕色气体生成 (5) 干燥管内铜片溶解 , 表面有气泡产生 , 干燥管内液面逐渐下降 , 溶液变成蓝色 , 当稀硝酸不与铜片接触时 , 液面停止下降 (6)0.56 【 归纳总结 】 1. 不同价态含氮物质的转化 有关氮及其重要化合物的推断题常以“产生白烟、红棕色气体、无色气体在空气中变为红棕色、能使红色石蕊试纸变为蓝色”等特殊现象为突破口。 (1) 歧化 —— 同一元素的化合价在同一反应中既升高又降低。 如 3NO 2 +H 2 O====2HNO 3 +NO 、 2NO 2 +2NaOH====NaNO 3 +NaNO 2 +H 2 O 。 (2) 归中 :6NO+4NH 3 ====5N 2 +6H 2 O NO 2 +NO+2NaOH====2NaNO 2 +H 2 O (3) 含氮物质的连续氧化 2. 金属与硝酸反应的思维模型 3. 金属与硝酸反应计算的四种方法 (1) 原子守恒法 HNO 3 与金属反应时 , 一部分 HNO 3 起酸的作用 , 以 的形 式存在于溶液中 ; 一部分作为氧化剂转化为还原产物 , 这两部分中氮原子的总物质的量等于反应消耗的 HNO 3 中 氮原子的物质的量。 (2) 得失电子守恒法 HNO 3 与金属的反应属于氧化还原反应 ,HNO 3 中氮原子得电子的物质的量等于金属失电子的物质的量。 (3) 电荷守恒法 HNO 3 过量时反应后溶液中 ( 不考虑 OH - ) 则有 c ( )= c (H + )+ nc (M n + )(M n + 代表金属离子 ) 。 (4) 离子方程式计算法 金属与 H 2 SO 4 、 HNO 3 的混合酸反应时 , 由于硝酸盐中 在 H 2 SO 4 提供 H + 的条件下能继续与金属反应 , 则此类题目 应用离子方程式来计算 , 先作过量判断 , 然后根据完全 反应的金属或 H + 或 进行相关计算 , 且溶液中要符合 电荷守恒。查看更多