- 2021-08-23 发布 |
- 37.5 KB |
- 110页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习专题3金属及其化合物1钠镁及其化合物课件苏教版
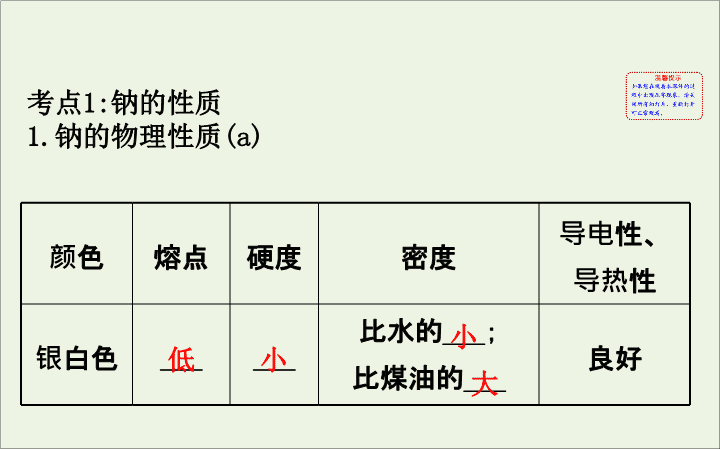
专题 3 金属及其化合物 第一单元 钠、镁及其化合物 考点 1: 钠的性质 1. 钠的物理性质 (a) 颜色 熔点 硬度 密度 导电性、 导热性 银白色 ___ ___ 比水的 ___; 比煤油的 ___ 良好 低 小 小 大 2. 钠的化学性质 (c) 从原子结构认识钠的化学性质 : (1) 钠与非金属单质反应 ①与 O 2 反应 : ② 与 Cl 2 反应的化学方程式 :________________ 。 ③与 S 反应的化学方程式 :_____________ 。 (2) 钠与水的反应 ①钠与水反应的离子方程式 : ________________________ 。 △ ==== △ ==== 2Na+Cl 2 2NaCl 2Na+S Na 2 S 2Na+2H 2 O===2Na + +2OH - +H 2 ↑ ② 钠与水 ( 含酚酞 ) 反应的实验现象及解释 : (3) 钠与酸的反应 : 离子方程式为 ____________________ 。 (4) 钠与盐溶液的反应 : 如钠投入 CuSO 4 溶液中 , 反应的离子方程式为 ___________________________________ 。 2Na+2H + ====2Na + +H 2 ↑ 2Na+2H 2 O+C u 2+ ====2Na + +Cu(OH) 2 ↓+H 2 ↑ 3. 钠的制取、保存及用途 (a) (1) 制取 : 化学方程式为 ________________________ 。 (2) 保存 : 密封保存 , 通常保存在石蜡油或 _____ 中。 (3) 用途。 ①钠、钾合金 ( 液态 ) 可用于原子反应堆的 _______; ② 作强还原剂 , 将某些稀有金属从它们的卤化物中还 原出来 , 如 4Na+TiCl 4 Ti+4NaCl; ③ 用作电光源 , 制作高压钠灯。 电解 ==== 熔融 ==== 2NaCl( 熔融 ) 2Na+Cl 2 ↑ 煤油 导热剂 4. 焰色反应 (a) (1) 焰色反应 : 很多金属或它们的化合物在灼烧时都会 使火焰呈现特殊颜色。属于物理变化 , 是元素的性质。 (2) 操作步骤 (3) 常见元素焰色反应的颜色 钠元素 :___ 色 ; 钾元素 :___ 色 ( 透过蓝色钴玻璃观察 ) 。 黄 紫 【 强化训练 】 1. 下列有关钠的说法中 , 不正确的是 ( ) A. 工业上通过电解氯化钠溶液制取金属钠 B. 高压钠灯常用于道路和广场的照明 C. 钠钾合金可在快中子反应堆中作热交换剂 D. 钠可用于从钛、铌等金属的氯化物中置换出金属单质 【 解析 】 选 A 。钠是活泼的金属 , 工业上通过电解熔融氯化钠制取金属钠 ,A 错误 ; 高压钠灯常用于道路和广场的照明 ,B 正确 ; 钠钾合金可在快中子反应堆中作热交换剂 ,C 正确 ; 钠可用于从钛、铌等金属的氯化物中置换出金属单质 ,D 正确。 2. 下列说法中错误的是 ( ) A. 钠在常温下就容易被氧化 B. 钠在受热后能够着火燃烧 C. 钠在空气中能缓慢氧化发生自燃 D. 钠在氧气中燃烧比在空气中更为剧烈 【 解析 】 选 C 。钠在空气中容易被氧化为 Na 2 O, 但不能自燃 , 加热条件下燃烧生成过氧化钠 , 在纯氧中燃烧更剧烈。 3. 向分别盛有 100 mL 水、 100 mL 0.1 mol·L -1 盐酸、 100 mL 0.01 mol·L -1 NaOH 溶液的 X 、 Y 、 Z 三 个烧杯中各投入 0.05 mol Na 。下列有关说法正确 的是 ( ) 世纪金榜导学号 A. 三个烧杯中均先发生的离子反应为 2Na+2H 2 O==== 2Na + +2OH - +H 2 ↑ B. 三个烧杯中钠均在液面上剧烈反应 , 且 X 烧杯中反应最剧烈 C. 三个烧杯反应后 , 溶质的物质的量浓度相同 D. 三个烧杯反应后 , 生成的气体的质量一定相同 【 解析 】 选 D 。钠与盐酸反应时钠先与 H + 反应 , 离子方程式表示为 2Na+2H + ====2Na + +H 2 ↑,A 项错误 ;X 烧杯中生成的溶质为 NaOH,Y 烧杯中生成的溶质为 NaCl,Z 烧杯中生成 NaOH, 由于原溶质为 NaOH, 故 Z 烧杯中物质的量浓度最大 ,C 项错误 ; 因向三个烧杯中加入钠的物质的量相同且钠全部反应完 , 故生成 H 2 的量相同 ,D 项正确。 4. 某化学兴趣小组发现 , 将钠投入硫酸铜溶液中 , 产生无色气体和蓝色沉淀 , 却未置换出红色的铜。该小组同学对此现象进行了如下探究 : 【 分析与讨论 】 (1) 在实验室中通常将钠保存在煤油里 , 煤油的作用是 ______ 。 (2) 对于钠与水反应的生成物 , 甲同学猜想是 NaOH 和 H 2 , 乙同学猜想是 NaOH 和 O 2 , 你认为 ________ 同学的猜想不 合理 , 请从化合价的角度解释原因 :______ 。 (3) 甲同学认为金属钠与 CuSO 4 溶液的反应之所以没有铜 生成 , 是因为置换生成的铜较少被蓝色沉淀所覆盖。 【 解释与结论 】 (1) 将钠投入硫酸铜溶液中 , 产生无色气体和蓝色沉淀 , 写出发生反应的化学方程式 ( 分两步写 ):______, ____________ 。 (2) 乙同学为验证甲同学的观点是否正确。选择盐酸作为检测试剂 , 请你写出乙同学选择盐酸的原因 : ____________ 。 (3) 乙同学在验证甲同学观点是否正确的实验过程中 , 意外发现生成的蓝色沉淀中混有少量的黑色 CuO 。 已知 :Cu(OH) 2 CuO+H 2 O 。请指出生成 CuO 的原因 : ______________ 。 (4) 为验证钠与 CuSO 4 溶液反应生成的气体产物 , 丙同学 称取 2.3 g Na, 与足量 CuSO 4 溶液反应后收集产生的气体 , 点燃该气体 , 产生 ________ 色火焰 , 在火焰上方罩一个 干冷的烧杯 , 实验现象为烧杯内壁出现 _______ 。 △ ==== 【 解析 】【 分析与讨论 】 (1) 钠与氧气和水反应 , 所以在实验室中通常将钠保存在煤油里 , 煤油的作用是将钠与氧气和水隔绝。 (2) 根据在一个化学反应中 , 如果有元素化合价升高 , 同时就有元素化合价降低。若生成 NaOH 和 O 2 , 则该反应中钠元素的化合价由 0 价升高到 +1 价 , 氧元素的化合价由 -2 价升高到 0 价 , 只有元素化合价升高 , 没有元素化合价降低 , 所以乙同学的猜想不合理。 【 解释与结论 】 (1) 钠和水反应生成氢氧化钠和氢气 , 发生反应的化学方程式为 2Na+2H 2 O====2NaOH+H 2 ↑; 氢氧化钠和硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠 , 发生反应的化学方程式为 CuSO 4 +2NaOH====Cu(OH) 2 ↓+Na 2 SO 4 。 (2) 应从 Cu 与 Cu(OH) 2 的不同性质入手 , 最简单的实验是将沉淀分离出来后用盐酸溶解 , 氢氧化铜可溶于盐酸而铜不溶。 (3) 黑色难溶物 CuO, 其解释是 Cu(OH) 2 分解 , 钠与水反 应放出的热使生成的 Cu(OH) 2 部分分解 :Cu(OH) 2 CuO+H 2 O 。 (4) 氢气点燃的现象是产生淡蓝色火焰。氢气燃烧生成 水 , 所以在火焰上方罩一个干冷的烧杯 , 烧杯内壁出现 无色液滴。 △ ==== 答案 :【 分析与讨论 】 (1) 将钠与氧气和水隔绝 (2) 乙 若生成 NaOH 和 O 2 , 则该反应中钠元素的化合价由 0 价升高到 +1 价 , 氧元素的化合价由 -2 价升高到 0 价 , 只有元素化合价升高 , 没有元素化合价降低 【 解释与结论 】 (1)2Na+2H 2 O====2NaOH+H 2 ↑ CuSO 4 +2NaOH====Cu(OH) 2 ↓+Na 2 SO 4 (2) 氢氧化铜可溶于盐酸而铜不溶 (3) 钠与水反应放出的热使生成的 Cu(OH) 2 部分分解 (4) 淡蓝 无色液滴 【 归纳总结 】 1. 钠与盐溶液的反应 (1) 反应的实质 : 钠与盐溶液反应 , 实质上是先与水反应生成 NaOH,NaOH 再与盐发生复分解反应 , 而不能置换出盐中的金属。这是因为虽然溶液中存在金属阳离子 , 但是钠的活泼性比较强 , 先与水反应 , 而不是先与金属阳离子反应。 (2) 实例 : 如 Na 与 CuSO 4 溶液的反应 , 发生的反应过程 有 :2Na+2H 2 O====2NaOH+H 2 ↑,CuSO 4 +2NaOH==== Cu(OH) 2 ↓+Na 2 SO 4 。 总反应方程式 :2Na+2H 2 O+CuSO 4 ====Na 2 SO 4 + Cu(OH) 2 ↓+H 2 ↑ 。 2. 钠和酸的反应 : 实质是 Na 与 H + 作用。由于在酸溶液中 ,H + 主要来源于酸 , 因此钠先与酸反应 , 当与酸反应完后才与 H 2 O 反应。如钠和足量盐酸反应的化学方程式为 2Na+2HCl====2NaCl+H 2 ↑, 若钠有剩余 , 则还会发生 2Na+2H 2 O====2NaOH+H 2 ↑ 反应。 考点 2: 氧化钠和过氧化钠 1. 氧化钠和过氧化钠的比较 (a 、 c) 2. 过氧化钠的特性 (c) (1) 化合价与性质的关系 因此 Na 2 O 2 既有氧化性 , 又有还原性 , 但主要表现出较强的氧化性。 (2) 强氧化性的表现 【 典例精析 】 【 典例 】 下列说法正确的是 ( ) A.Na 2 O 2 遇到湿润的紫色石蕊试纸后 , 石蕊试纸最终变成蓝色 B.Na 2 O 2 与 CO 2 反应生成 0.1 mol O 2 时转移电子 0.4 mol C.Na 2 O 2 投入 CuCl 2 溶液中有蓝色沉淀及气泡产生 D. 向饱和烧碱溶液中加入 2 g Na 2 O 2 , 充分反应后 , 溶液中 c (Na + ) 不变 【 解析 】 选 C 。 Na 2 O 2 遇湿润的石蕊试纸时 , 它最终能氧 化石蕊使其褪色 ,A 项错误 ; 由 2Na 2 O 2 +2CO 2 ==== 2Na 2 CO 3 +O 2 及 Na 2 O 2 中氧为 -1 价知 , 每生成 1 mol O 2 时会 转移 2 mol 电子 ,B 项错误 ;Na 2 O 2 投入 CuCl 2 溶液中 ,Na 2 O 2 先与水反应生成 NaOH 与 O 2 ,NaOH 再与 CuCl 2 反应生成 Cu(OH) 2 沉淀 ,C 项正确 ;Na 2 O 2 与水反应时能放出大量的 热 , 使溶液温度升高 ,NaOH 溶解度增大 , 导致溶液中 c (Na + ) 增大 ,D 项错误。 【 强化训练 】 1. 密闭容器中充入 CO 2 、 CO 、 CH 4 的混合气体共 m g, 若加入足量 Na 2 O 2 , 充分振荡并不断用电火花引燃至反应完全 , 测得固体质量增加 m g, 则 CO 2 与 CH 4 的体积比为 世纪金榜导学号 ( ) A.3∶1 B.2∶1 C.1∶1 D. 任意比 【 解析 】 选 C 。 2CO+O 2 2CO 2 ① 2Na 2 O 2 +2CO 2 ==== 2Na 2 CO 3 +O 2 ② ① +② 得 :Na 2 O 2 +CO ==== Na 2 CO 3 ( 虚拟的反应 ) 即 :CO 可被 Na 2 O 2 完全吸收 2H 2 +O 2 2H 2 O ③ 2Na 2 O 2 +2H 2 O====4NaOH+O 2 ↑ ④ 点燃 ==== 点燃 ==== ③+④ 得 :Na 2 O 2 +H 2 ==== 2NaOH( 虚拟的反应 ) 即 :H 2 可被 Na 2 O 2 完全吸收 由于 CO 完全被吸收 , 当 CO 2 、 CH 4 的体积比符合 1∶1 时 , 相当于 2CO∶2H 2 , 可被 Na 2 O 2 完全吸收。 2. 如图是 Na 2 O 2 和 CO 2 定性、定量实验的装置示意图。 注射器 1 中抽取了 100 mL CO 2 ,U 形管中装有适量小玻璃珠和约 1.5 g Na 2 O 2 粉末。实验开始时 , 打开 K 1 、 K 2 、 K 4 止水夹 , 关闭 K 3 止水夹 , 推动注射器 1 活塞 , 缓缓将 CO 2 压至 U 形管中 , 注射器 2 活塞缓缓向外移动。回答下列问题 ( 本题不考虑注射器内壁的摩擦阻力 ): (1)U 形管内的玻璃珠并不参与反应 , 其所起的作用除防止过氧化钠粉末被吹走外 , 另一个重要作用是 _____ 。 (2)U 形管中可观察到的反应现象是 ___________ 。 (3) 注射器 1 活塞推到底后 , 注射器 2 中收集到的气体大于 50 mL, 其原因除可能仍含 CO 2 外 , 还有一个重要原因是 ________________________________ 。 (4) 为了使剩余气体中二氧化碳能反应完 , 接下来的操作是 _________________ 。 (5) 要证明反应产物之一为氧气 , 最为方便的实验方法是 ____________________ (6) 本实验结束后固体产物板结 , 难以从 U 形管中取出 , 为了证明固体产物中含有碳酸盐 , 实验时还需要从如下图所示仪器和试剂中选择 ________( 填字母 ) 。当装置和药品都安装完毕后 , 接下来的操作步骤是 _______ 。 【 解析 】 (1) 玻璃珠还可起到增大 Na 2 O 2 与 CO 2 接触面积 , 使之反应完全的作用。 (2)U 形管中 Na 2 O 2 与 CO 2 反应生成 Na 2 CO 3 和 O 2 , 故 U 形管内 淡黄色粉末渐渐变白。 (3) 由 2Na 2 O 2 +2CO 2 ====2Na 2 CO 3 +O 2 可知 100 mL CO 2 理论 上应产生 50 mL O 2 , 收集到的气体大于 50 mL 的原因除 部分 CO 2 没反应外 , 还可能是反应放热 , 气体受热膨胀。 (4) 为了让 CO 2 反应完 , 可把注射器 2 中的 CO 2 气体再推入 U 形管中 , 反复数次。 (5) 可利用 O 2 支持燃烧 , 能使带火星的木条复燃的性质 证明。 (6) 要证明有 C , 可利用 H + 与 C 反应产生 CO 2 , 检验 CO 2 即可。故选 A 、 D 、 E 或 C 、 D 、 E 。操作时 , 需要关闭 K 1 、 K 4 , 打开 K 2 、 K 3 止水夹 , 通过分液漏斗 ( 或胶头滴管 ) 将盐酸滴入 U 形管中 , 观察试管内现象即可。 答案 : (1) 增大过氧化钠和二氧化碳的接触面积 , 使反应完全 (2) 淡黄色粉末渐渐变白 (3) 该反应为放热反应 , 反应后气体温度升高 , 体积变大 (4) 将注射器 2 中气体再推入 U 形管中 , 反复数次 (5) 打开胶塞 , 立即将带火星的木条伸入 U 形管中 , 木条复燃 (6)A 、 D 、 E( 或 C 、 D 、 E) 关闭 K 1 、 K 4 止水夹 , 打开 K 2 、 K 3 止水夹 , 通过分液漏斗 ( 或胶头滴管 ) 将稀盐酸滴入 U 形管中 , 观察试管内 Ca(OH) 2 溶液是否变浑浊 3. 从氧化还原反应角度探究 Na 2 O 2 的结构与性质。 用双线桥分析 Na 2 O 2 与水反应中电子转移的方向和数目 :________ 。 (1) 氧化剂和还原剂是 __________, 氧化产物是 __________, 还原产物是 __________ 。 (2)1 mol Na 2 O 2 与水完全反应时转移的电子数 : _______ 。生成 1 mol O 2 转移电子数 :________ 。 答案 : (1)Na 2 O 2 O 2 NaOH (2) N A ( 或 6.02×10 23 ) 2 N A ( 或 1.204×10 24 ) 4.200 ℃ 时 ,11.6 g CO 2 和水蒸气的混合气体与足量的 Na 2 O 2 充分反应后固体质量增加了 3.6 g, 则原混合气体的总物质的量是 ________; 原混合物的平均相对分子质量为 ________ 。 【 解析 】 由反应方程式 2Na 2 O 2 +2H 2 O====4NaOH+O 2 ↑ 、 2Na 2 O 2 +2CO 2 ====2Na 2 CO 3 +O 2 利用质量守恒定律可知 , 生 成 O 2 的质量为 11.6 g-3.6 g=8 g, n (O 2 )= =0.25 mol, 根据 Na 2 O 2 与 H 2 O(g) 、 CO 2 反应的物质的量 的关系可知 CO 2 和 H 2 O(g) 的物质的量之和为 0.25 mol ×2=0.5 mol 。原混合气体的平均摩尔质量为 M =11.6 g÷0.5 mol=23.2 g · mol -1 , 即原混合气体的平均相对分子质量为 23.2 。 答案 : 0.5 mol 23.2 【 归纳总结 】 1. 过氧化钠的强氧化性 (1) 从化合价的角度分析。 Na 2 O 2 既有氧化性又有还原性 , 但主要表现为氧化性。 (2) 强氧化性的具体表现。 2.Na 2 O 2 与水、 CO 2 反应的四个重要关系 反应方程式 :2Na 2 O 2 +2H 2 O====4NaOH+O 2 ↑ 2Na 2 O 2 +2CO 2 ====2Na 2 CO 3 +O 2 (1) 物质的量关系。 无论是 CO 2 或 H 2 O(g) 的单一物质还是二者的混合物 , 与足量的 Na 2 O 2 反应时 , 消耗 CO 2 或 H 2 O(g) 与放出 O 2 的物质的量之比均为 2∶1, 即气体减小的体积等于生成的 O 2 的体积。 (2) 固体质量关系。 相当于固体 (Na 2 O 2 ) 只吸收了 CO 2 中的“ CO”,H 2 O(g) 中的 “ H 2 ”; 可以看作发生相应的反应 :Na 2 O 2 +CO====Na 2 CO 3 、 Na 2 O 2 +H 2 ====2NaOH( 实际上两反应不能发生 ) 。 (3) 先后顺序关系。 一定量的 Na 2 O 2 与一定量 CO 2 和 H 2 O(g) 的混合物反应 , 解决问题时可视作 Na 2 O 2 先与 CO 2 反应 , 待 CO 2 反应完成后 ,Na 2 O 2 再与 H 2 O(g) 发生反应 ( 实际情况复杂得多 ) 。 (4) 电子转移关系。 不论是与 CO 2 还是与 H 2 O(g) 反应 ,CO 2 与 H 2 O(g) 均既不是氧化剂也不是还原剂 , 反应的实质都是 Na 2 O 2 自身发生的氧化还原反应 , 所以每有 1 mol O 2 生成时 , 转移的电子均为 2 mol 。 考点 3: 碳酸钠与碳酸氢钠 1. 物理性质及用途 (a) 名称 碳酸钠 碳酸氢钠 化学式 ______ ______ 俗名 _____ 、苏打 _______ 颜色、状态 白色粉末 细小白色晶体 溶解度 Na 2 CO 3 _____NaHCO 3 碱性 Na 2 CO 3 _____NaHCO 3 Na 2 CO 3 NaHCO 3 纯碱 小苏打 大于 大于 名称 碳酸钠 碳酸氢钠 热稳定性 受热 ___ 分解 受热 ___ 分解 主要用途 化工原料 , 可用于制造玻璃、造纸、制皂、制洗涤剂 焙制糕点的 发酵粉、 治疗胃酸过多 难 易 2. 化学性质 (c) (1)Na 2 CO 3 写出上述序号所表示反应的化学方程式 : ①_____________________________; ②______________________________; ③____________________________ 。 Na 2 CO 3 +2HCl====2NaCl+H 2 O+CO 2 ↑ Na 2 CO 3 +Ca(OH) 2 ====CaCO 3 ↓+2NaOH Na 2 CO 3 +BaCl 2 ====BaCO 3 ↓+2NaCl (2)NaHCO 3 写出上述序号①、③、④所表示反应的化学方程式 , ② 反应的离子方程式 : ①____________________________; ②Ca(OH) 2 过量 :____________________________; Ca(OH) 2 少量 :____________________________________; ③________________________; ④___________________________ 。 △ ==== NaHCO 3 +HCl====NaCl+H 2 O+CO 2 ↑ HC +OH - +Ca 2+ ====CaCO 3 ↓+H 2 O Ca 2+ +2OH - +2HC ====CaCO 3 ↓+C +2H 2 O NaHCO 3 +NaOH ==== Na 2 CO 3 +H 2 O 2NaHCO 3 Na 2 CO 3 +H 2 O+CO 2 ↑ 【 典例精析 】 【 典例 1】 纯碱和小苏打都是白色晶体 , 在日常生活中都可以找到。若要在家中将它们区分开来 , 下面的方法中可行的是 ( ) A. 在水杯中各盛相同质量的样品 , 分别加入等体积的白醋 , 观察反应的剧烈程度 B. 分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧 , 观察火焰颜色 C. 将样品溶解 , 分别加入澄清石灰水 , 观察是否有白色沉淀 D. 分别放在炒锅中加热 , 观察是否有残留物 【 解析 】 选 A 。碳酸钠与酸反应分步进行 , 首先反应产 生碳酸氢钠和氯化钠 , 然后是碳酸氢钠与酸反应产生氯 化钠、二氧化碳和水 , 产生气体 , 而碳酸氢钠中加入酸 马上放出气体 , 所以根据反应放出气体的快慢就可迅速 得到判断 ,A 正确 ; 纯碱和小苏打都是钠盐 , 焰色反应火 焰都为黄色 , 所以无法区别二者 ,B 错误 ; 二者都能与氢 氧化钙溶液发生反应产生碳酸钙白色沉淀 , 无法区别 它们 ,C 错误 ; 碳酸钠稳定 , 受热不分解 , 碳酸氢钠不稳定受热分解产生碳酸钠、二氧化碳和水 , 也有固体残留物 , 所以无法区分二者 ,D 错误。 【 典例 2】 将一定量的 NaOH 和一定量的 Na 2 CO 3 混合并配成溶液 , 向溶液中滴加 0.1 mol·L -1 盐酸。下列图象能正确表示加入盐酸的体积和生成 CO 2 的物质的量的关系的是 ( ) 【 解析 】 选 C 。反应可分为三个阶段。 第一阶段 :NaOH 与盐酸反应 ,H + +OH - ====H 2 O, 无反应 现象。 第二阶段 :Na 2 CO 3 与盐酸反应生成 NaHCO 3 ,C +H + ====HC , 无反应现象。 第三阶段 :NaHCO 3 与盐酸反应有 CO 2 生成 ,HC +H + ====H 2 O+CO 2 ↑, 有气体放出。 由于第二阶段和第三阶段消耗盐酸的量相等 , 则 NaOH 和 Na 2 CO 3 混合液与盐酸反应时 Oa 段消耗的盐酸的量大于 ab 段消耗盐酸的量 , 图象 C 符合题目要求。 【 考题变式 】 依据你选择的图象 , 能确定混合溶液中 Na 2 CO 3 和 NaOH 的物质的量之比吗 ? 提示 : 能。依据选项 C 中的图象及横坐标中消耗盐酸 的量可以确定 Na 2 CO 3 和 NaOH 的物质的量之比为 【 强化训练 】 1. 下列有关纯碱和小苏打的叙述中正确的是 ( ) A.Na 2 CO 3 和 NaHCO 3 都既能与酸反应 , 又能与氢氧化钠溶液反应 B. 等质量 Na 2 CO 3 、 NaHCO 3 分别与相同浓度的盐酸反应 ,NaHCO 3 消耗的盐酸体积少 C. 向 NaHCO 3 溶液中滴入 Ba(OH) 2 溶液无沉淀 , 而 Na 2 CO 3 溶液中加入 Ba(OH) 2 溶液出现白色沉淀 D. 等物质的量 Na 2 CO 3 、 NaHCO 3 分别与足量稀 H 2 SO 4 反应 ,NaHCO 3 产生的 CO 2 多 【 解析 】 选 B 。 Na 2 CO 3 与盐酸反应生成二氧化碳 , 不与氢 氧化钠反应 ,NaHCO 3 属于弱酸强碱盐 , 既能与盐酸反应 , 生成 CO 2 气体 , 又能与氢氧化钠反应 , 生成盐 ,A 错误 ; 由 方程式 Na 2 CO 3 +2HCl====2NaCl+CO 2 ↑+H 2 O,NaHCO 3 +HCl ====NaCl+CO 2 ↑+H 2 O 可知 , 等质量 Na 2 CO 3 、 NaHCO 3 分别与相同浓度的盐酸反应 ,NaHCO 3 消耗的盐酸体积 少 ,B 正确 ;Na 2 CO 3 和 NaHCO 3 都与 Ba(OH) 2 溶液反应生成 沉淀 :Ba(OH) 2 +Na 2 CO 3 ====BaCO 3 ↓+2NaOH,2NaHCO 3 +Ba(OH) 2 ====BaCO 3 ↓+Na 2 CO 3 +2H 2 O(NaHCO 3 足量 ), C 错误 ; 分别与足量稀 H 2 SO 4 反应 , 反应离子方程式为 C +2H + ====CO 2 ↑+H 2 O 、 HC +H + ====H 2 O+CO 2 ↑, 所以等物质的量 Na 2 CO 3 、 NaHCO 3 分别与足量稀 H 2 SO 4 反应 , 产生的 CO 2 一样多 , 故 D 错误。 2. 一定量 CO 2 通入某浓度的 NaOH 溶液得 A 溶液 , 向 A 溶液中逐滴滴入稀盐酸 , 加入 n(HCl) 与生成 n(CO 2 ) 的关系如图所示。下列有关叙述正确的是 ( ) 世纪金榜导学号 A. 通入的 CO 2 气体在标准状况下可能大于 22.4 L B.A 溶液中 n (NaOH)=2 n (Na 2 CO 3 ) C.A 溶液中既含 Na 2 CO 3 , 又含 NaHCO 3 D.A 溶液中一定只有 Na 2 CO 3 【 解析 】 选 B 。根据碳酸钠与盐酸的反应情况 : ①Na 2 CO 3 +HCl====NaHCO 3 +NaCl; ②NaHCO 3 +HCl====NaCl+CO 2 ↑+H 2 O 。 开始滴入 3 mol HCl( 盐酸 ) 无气体生成 , 后滴入 1 mol HCl( 盐酸 ), 生成 1 mol CO 2 , 而后再滴加盐酸无气体生成 , 说明 A 溶液为氢氧化钠与碳酸钠的混合溶液 , 由生成 1 mol CO 2 可知溶液中碳酸钠的物质的量为 1 mol, 则氢氧化钠的物质的量为 2 mol 。 3. 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体 , 用不同的方法做了以下实验 , 如图 Ⅰ ~ Ⅲ 所示。 (1) 根据图 Ⅰ 所示实验 , 不能够达到实验目的的原因是 ___________________________ 。 (2) 图 Ⅱ 、 Ⅲ 所示实验均能鉴别这两种物质 , 其反应的化学方程式为 _______________________________ 。 (3) 若用实验 Ⅱ 验证碳酸钠和碳酸氢钠的稳定性 , 则试管 B 中装入的固体最好是 ____________( 填化学式 ) 。 【 解析 】 (1)NaHCO 3 、 Na 2 CO 3 都与盐酸反应放出 CO 2 , 不能达到实验目的。 (2)Ⅱ 、 Ⅲ 都是利用 NaHCO 3 受热易分解的性质进行鉴别。 (3) 试管 B 中装入碳酸氢钠 , 试管 A 中装入碳酸钠 , 这样直接加热的碳酸钠温度高 , 不分解 , 不能使澄清石灰水变浑浊 , 而间接加热的碳酸氢钠分解 , 使澄清石灰水变浑浊 , 表明了碳酸氢钠受热易分解。 答案 : (1) 无论是 Na 2 CO 3 还是 NaHCO 3 , 均可以与盐酸反应产生 CO 2 , 两者的反应现象相同 , 故达不到鉴别的目的 (2)2NaHCO 3 Na 2 CO 3 +H 2 O+CO 2 ↑, CO 2 +Ca(OH) 2 ====CaCO 3 ↓+H 2 O (3)NaHCO 3 △ ==== 【 归纳总结 】 1.Na 2 CO 3 和 NaHCO 3 性质的应用 (1)Na 2 CO 3 、 NaHCO 3 的鉴别 ①固体的鉴别用加热法 : 产生使澄清石灰水变浑浊的气体的是 NaHCO 3 固体。 ② 溶液的鉴别可用沉淀法、气体法和测 pH 法。 a. 沉淀法 : 加入 BaCl 2 溶液或 CaCl 2 溶液 , 产生沉淀的是 Na 2 CO 3 溶液。 b. 气体法 : 滴入稀盐酸 , 立即产生气泡的是 NaHCO 3 溶液。 c. 测 pH 法 : 用 pH 试纸测相同浓度的稀溶液 ,pH 大的是 Na 2 CO 3 溶液。 (2)Na 2 CO 3 、 NaHCO 3 的除杂 序号 混合物 ( 括号内为杂质 ) 除杂方法 ① Na 2 CO 3 (s)(NaHCO 3 ) 加热法 ② NaHCO 3 (aq)(Na 2 CO 3 ) 通入足量 CO 2 ③ Na 2 CO 3 (aq)(NaHCO 3 ) 滴加适量 NaOH 溶液 2. 利用数形结合的思想理解碳酸钠、碳酸氢钠与盐酸的反应 (1) 向 Na 2 CO 3 溶液中逐滴加入盐酸 , 消耗盐酸的体积与产生 CO 2 的体积的关系如图甲所示。 (2) 向 NaHCO 3 溶液中逐滴加入盐酸 , 消耗盐酸的体积与产生 CO 2 的体积的关系如图乙所示。 (3) 向 NaOH 、 Na 2 CO 3 的混合物中逐滴加入盐酸 , 消耗盐酸的体积与产生 CO 2 的体积的关系如图丙所示 ( 设 NaOH 、 Na 2 CO 3 的物质的量之比为 1∶1) 。 (4) 向 Na 2 CO 3 、 NaHCO 3 的混合物中逐滴加入盐酸 , 消耗盐酸的体积与产生 CO 2 的体积的关系如图丁所示 ( 设 Na 2 CO 3 、 NaHCO 3 的物质的量之比为 1∶1) 。 考点 4: 镁及其化合物 1. 镁的物理性质 (a) (1) 镁 : 镁是 _____ 色有金属光泽的固体 , 密度较 ___, 硬度较 ___ 、有延展性 , 是电和热的良导体。 (2) 镁合金 : 密度较 ___, 硬度和强度都较 ___ 。 银白 小 低 小 大 2. 镁及其化合物的化学性质 (c) 注意 :①Mg 在空气中燃烧得到的固体物质主要为 MgO 和少量 Mg 3 N 2 及 C 的混合物 ; ②Mg 着火后 , 不可用 CO 2 灭火 ; ③ 由于 Mg(OH) 2 的溶解度比 MgCO 3 的小 , 故水垢的主要成分中含 Mg(OH) 2 , 而非 MgCO 3 。 3. 镁的用途 (a) 镁合金 用于制造火箭、导弹和飞机的部件 镁 制造信号弹和焰火 氧化镁 熔点高 , 可作耐高温材料 4. 从海水中提取镁 (b) (1) 工艺流程 (2) 基本步骤及主要反应 【 强化训练 】 1. 世界上 60% 的镁是从海水中提取的 , 其提取步骤如下 :① 把贝壳制成生石灰 ;② 向海水中加入生石灰 , 过滤 , 洗涤沉淀物 ;③ 将沉淀物与盐酸反应 , 结晶、过滤 ;④ 在氯化氢热气流中加热晶体 ;⑤ 电解上述所得盐 ( 熔融条件下 ) 。下列说法正确的是 ( ) A. 向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 B. 上述变化过程中包括了分解、化合、复分解、置换四种反应类型 C. 在氯化氢热气流中干燥晶体是为了加快干燥速度 D. 步骤⑤也可以采用电解该盐水溶液的方法 【 解析 】 选 A 。洗涤液中如果含有 Ca 2+ , 滴加碳酸钠 溶液会生成白色沉淀 , 所以可检验沉淀是否洗涤干 净 ,A 正确。提取镁的过程中涉及的反应主要有 : CaCO 3 CaO+CO 2 ↑ 、 CaO+H 2 O====Ca(OH) 2 、 Ca(OH) 2 +MgCl 2 ====CaCl 2 +Mg(OH) 2 ↓ 、 Mg(OH) 2 +2HCl====MgCl 2 +2H 2 O 、 MgCl 2 · 6H 2 O MgCl 2 +6H 2 O↑ 、 MgCl 2 ( 熔融 ) Mg+Cl 2 ↑ 。 高温 ==== 电解 ==== 上述反应中没有置换反应 , 故 B 错误。在氯化氢热气流中干燥晶体是为了抑制 MgCl 2 水解 , 故 C 错误。电解 MgCl 2 溶液将得到氢氧化镁 , 故 D 错误。 2. 镁在空气里点燃可以燃烧 , 放出大量的热并发出耀眼的白光 , 生成白色的氧化镁 , 同时 , 镁在这样的高温条件下 , 还可与空气中的另一种主要成分反应 , 生成少量的物质 A, 气体 C 能够使湿润的红色石蕊试纸变蓝。已知 A 有下列一系列变化 : (1) 写出 A 、 C 、 D 的化学式 : A__________ 、 C__________ 、 D__________ 。 (2) 写出下列变化的化学方程式 : ①________________________________________, ②________________________________________ 。 【 解析 】 镁在空气里燃烧时 , 主要和氧气反应生成 MgO, 还可以和氮气反应生成 Mg 3 N 2 , 所以 A 为 Mg 3 N 2 。 Mg 3 N 2 和盐 酸反应得到的溶液 B 中一定含有 Mg 2+ 和 Cl - , 所以沉淀 D 一 定是 Mg(OH) 2 , 能够使湿润的红色石蕊试纸变蓝的气体是 氨气 ,N 能够和 NaOH 溶液反应放出 NH 3 , 所以溶液 B 中还 含有 N , 即它为 MgCl 2 和 NH 4 Cl 的混合物。 答案 : (1)Mg 3 N 2 NH 3 Mg(OH) 2 (2)①Mg 3 N 2 +8HCl====3MgCl 2 +2NH 4 Cl ②MgCl 2 +2NaOH====Mg(OH) 2 ↓+2NaCl, NH 4 Cl+NaOH NaCl+H 2 O+NH 3 ↑ △ ==== 【 归纳总结 】 镁及其化合物的转化关系查看更多