- 2021-08-23 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练8含解析
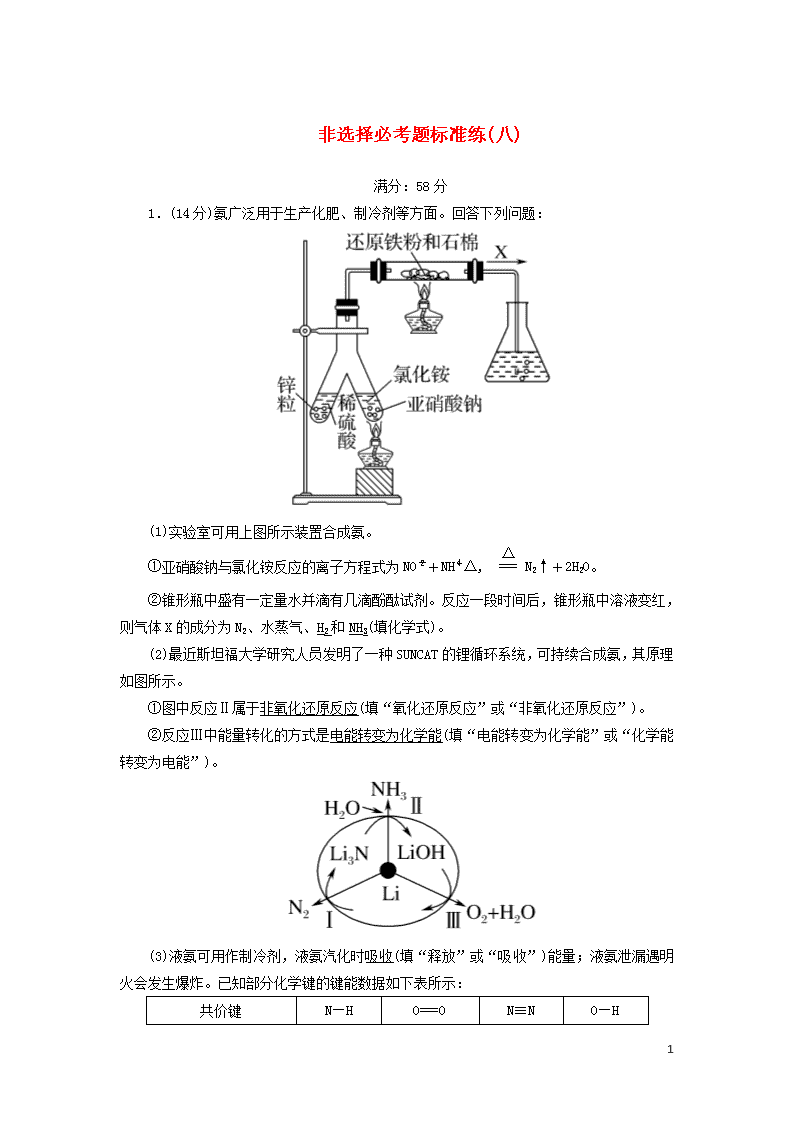
非选择必考题标准练(八) 满分:58分 1.(14分)氨广泛用于生产化肥、制冷剂等方面。回答下列问题: (1)实验室可用上图所示装置合成氨。 ①亚硝酸钠与氯化铵反应的离子方程式为NO+NH△, N2↑+2H2O。 ②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、H2和NH3(填化学式)。 (2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。 ①图中反应Ⅱ属于非氧化还原反应(填“氧化还原反应”或“非氧化还原反应”)。 ②反应Ⅲ中能量转化的方式是电能转变为化学能(填“电能转变为化学能”或“化学能转变为电能”)。 (3)液氨可用作制冷剂,液氨汽化时吸收(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示: 共价键 N—H O===O N≡N O—H 9 键能/kJ·mol-1 391 498 946 463 则反应4NH3(g)+3O2(g)===2N2(g)+6H2O(g)的反应热ΔH=-1_262_kJ·mol-1。 解析:(1)①亚硝酸钠具有强氧化性与氯化铵发生氧化还原反应,生成氮气,反应的离子方程式为NO+NHN2↑+2H2O。 ②锌与稀硫酸反应生成的氢气与亚硝酸钠和氯化铵反应生成的氮气在催化剂作用下反应生成了氨气,因此锥形瓶中酚酞溶液变红,则气体X的成分为N2、水蒸气、H2、NH3。 (2)①反应Ⅱ是Li3N与水反应生成氨气的过程,反应中没有元素化合价的变化,属于非氧化还原反应。 ②反应Ⅲ中氢氧化锂转变为锂、氧气和水,发生了氧化还原反应,属于非自发的氧化还原反应,属于电解池反应,能量转化的方式是电能转变为化学能。 (3)液氨可用作制冷剂,是因为液氨气化时吸收能量,导致周围温度降低;反应4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH=反应物的键能之和-生成物的键能之和=391×3×4+498×3-946×2-463×2×6 kJ·mol-1=-1 262 kJ·mol-1。 2.(14分)铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示: 回答下列问题: (1)FeTiO3中Fe的化合价为+2。 (2)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有采用钛铁矿粉末、升高温度、使用浓度较大的稀硫酸等(任写两种)。 酸性溶液中加入适量铁屑的目的是将Fe3+还原为Fe2+。 (3)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35 ℃以下,其原因是减少NH4HCO3分解、减少Fe2+水解,该反应的离子方程式是Fe2++2HCO===FeCO3↓+CO2↑+H2O。 (4)TiO2+转化为TiO(OH)2需要加热,加热的目的是 9 促进水解,加快反应速率,该反应的离子方程式为TiO2++2H2O△,TiO(OH)2↓+2H+。 (5)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO)=3.0×10-6 mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2?Ksp(FeCO3)=c(Fe2+)·c(CO),故c(Fe2+)==1.0×10-5 mol·L-1,pH=8.5,则c(OH-)=10-5.5 mol·L-1,故c(Fe2+)·c2(OH-)=10-16查看更多