- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练6含解析
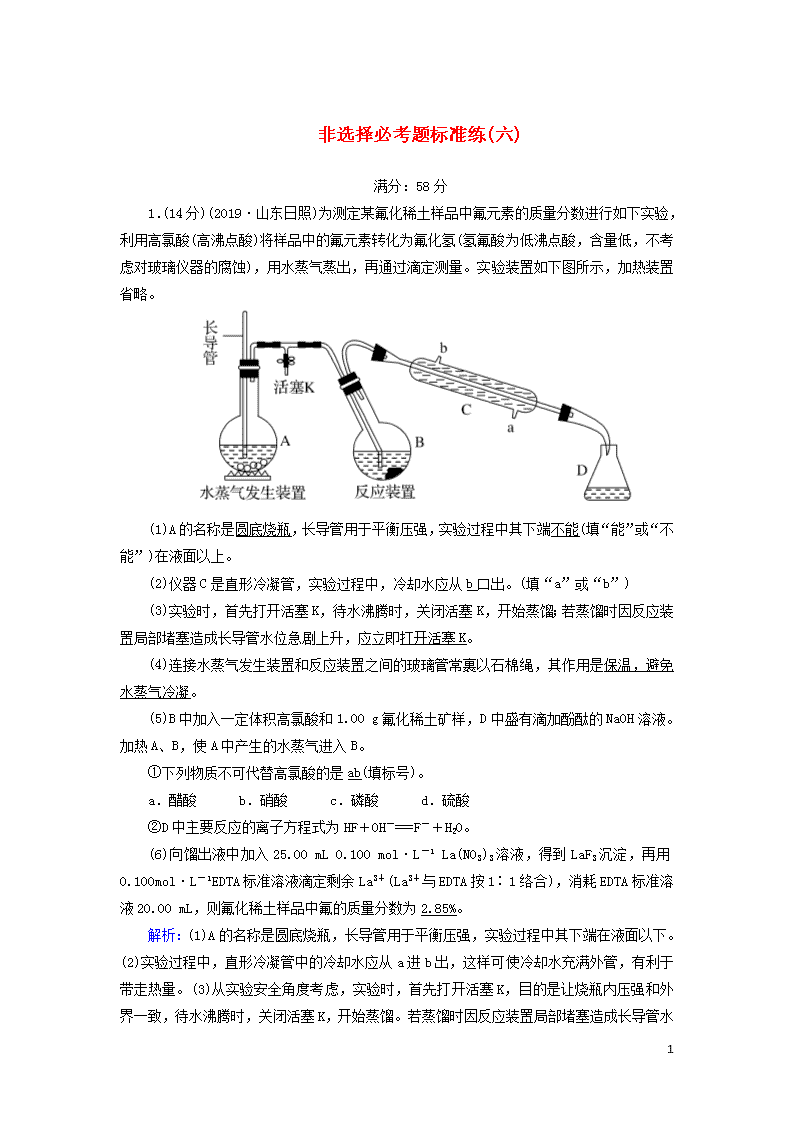
非选择必考题标准练(六) 满分:58分 1.(14分)(2019·山东日照)为测定某氟化稀土样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。 (1)A的名称是圆底烧瓶,长导管用于平衡压强,实验过程中其下端不能(填“能”或“不能”)在液面以上。 (2)仪器C是直形冷凝管,实验过程中,冷却水应从b口出。(填“a”或“b”) (3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏;若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即打开活塞K。 (4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是保温,避免水蒸气冷凝。 (5)B中加入一定体积高氯酸和1.00 g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。 ①下列物质不可代替高氯酸的是ab(填标号)。 a.醋酸 b.硝酸 c.磷酸 d.硫酸 ②D中主要反应的离子方程式为HF+OH-===F-+H2O。 (6)向馏出液中加入25.00 mL 0.100 mol·L-1 La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L-1 EDTA标准溶液滴定剩余La3+(La3+与EDTA按1∶1络合),消耗EDTA标准溶液20.00 mL,则氟化稀土样品中氟的质量分数为2.85%。 解析: 7 (1)A的名称是圆底烧瓶,长导管用于平衡压强,实验过程中其下端在液面以下。(2)实验过程中,直形冷凝管中的冷却水应从a进b出,这样可使冷却水充满外管,有利于带走热量。(3)从实验安全角度考虑,实验时,首先打开活塞K,目的是让烧瓶内压强和外界一致,待水沸腾时,关闭活塞K,开始蒸馏。若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即打开活塞K,和外界连通降低压强。(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,石棉绳的隔热效果比较好,主要起到保温防止水蒸气冷凝的作用。(5)①根据题干知识可知反应原理为高沸点酸(难挥发性酸)制取低沸点酸(易挥发性酸),醋酸和硝酸易挥发,不可代替高氯酸。②D中是氢氧化钠与HF酸碱中和生成盐和水,离子方程式为HF+OH-===F-+H2O。(6)关系式法计算:设F-为x mol 3F-~LaF3~La3+ 3 mol 1 mol x x/3 EDTA ~ La3+ 1 mol 1 mol 0.1 mol/L×20.00×10-3 L 0.1 mol/L×20.00×10-3 L +0.1 mol/L×20.00×10-3 L=0.100 mol/L×25.00×10-3 L 得x=1.5×10-3 mol=0.001 5 mol 氟化稀土样品中氟的质量分数为:×100%=2.85%。 2.(15分)(2019·青岛一模)三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其他一些含钴配合物的原料。下图是某科研小组以含钴废料(含少量Fe、Al杂质)制取[Co(NH3)6]Cl3的工艺流程: 回答下列问题: (1)写出加“适量NaClO3”发生反应的离子方程式6Fe2++ClO+6H+===6Fe3++Cl-+3H2O。 (2)“加Na2CO3调pH至a”会生成两种沉淀,分别为Fe(OH)3和Al(OH)3(填化学式)。 (3)操作Ⅰ的步骤包括HCl氛围下蒸发浓缩、冷却结晶、减压过滤。 (4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-)过大,其原理是NH4Cl溶于水电离出NH会抑制后期加入的NH3·H2O的电离。 7 (5)“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为甲(填“甲”或“乙”)同学观点正确,理由是防止Co(OH)3的生成。写出该步骤的化学方程式:H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O。 (6)通过碘量法可测定产品中钴的含量。将[Co(NH3)6]Cl3转化成Co3+后,加入过量KI溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-===2Co2++I2,I2+2S2O===2I-+S4O,实验过程中,下列操作会导致所测钴含量数值偏高的是ab。 a.用久置于空气中的KI固体配制溶液 b.盛装Na2S2O3标准液的碱式滴定管未润洗 c.滴定结束后,发现滴定管内有气泡 d.溶液蓝色褪去,立即读数 解析:(1)加适量NaClO3的目的是将亚铁离子氧化为铁离子,发生的离子反应为6Fe2++ClO+6H+===6Fe3++Cl-+3H2O。 (2)加入碳酸钠调节pH,沉淀铝离子和铁离子,转化为Fe(OH)3和Al(OH)3。 (3)为了防止产品水解,故应在HCl氛围下蒸发浓缩。 (4)流程中氯化铵除作为反应物外,NH4Cl溶于水电离出NH会抑制后期加入的NH3·H2O的电离,可防止加氨水时氢氧根离子浓度过大。 (5)若先加入过氧化氢,将钴元素氧化到Co3+,后加入氨水,会生成氢氧化钴,不利于产品的生成,故甲同学正确,先加入氨水再加入过氧化氢,可防止Co(OH)3的生成,此时的反应为H2O2+2CoCl2+2NH4Cl+10NH3·H2O===2Co(NH3)6Cl3↓+12H2O。 (6)a.用久置于空气中的KI固体配制溶液,碘化钾部分被氧化为碘单质,滴定时消耗的硫代硫酸钠标准液增多,测定结果偏高,故正确; b.盛装Na2S2O3标准液的碱式滴定管未润洗,则标准液也被稀释,滴定时消耗的硫代硫酸钠标准液也体积增多,测定结果偏高,故正确; c.滴定结束后,发现滴定管内有气泡,气泡占体积,则消耗的硫代硫酸钠标准液体积读数偏小,测定结果偏低,故错误; d.溶液蓝色褪去,立即读数,此时溶液混合不均,碘单质并未完全被标准液反应完全,导致消耗的标准液减少,测定结果偏低,故错误。故选ab。 3.(14分)(2019·江西上饶县调研)Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。 已知:C10H18(l)C10H12(l)+3H2(g) ΔH1 C10H12(l)C10H8(l)+2H2(g) ΔH2 ΔH1>ΔH2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192 ℃;在192 ℃,液态十氢萘的脱氢反应的平衡转化率约为9%。 请回答: 7 (1)有利于提高上述反应平衡转化率的条件是C。 A.高温高压 B.低温低压 C.高温低压 D.低温高压 (2)研究表明,将适量的十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是反应吸热,温度升高,平衡正向移动,与此同时,温度升高导致十氢萘汽化,浓度增大,平衡正向移动,生成氢气量显著增加。 (3)温度335 ℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验(两步反应都使用了催化剂),测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系,如图1所示。 ①在8 h时,反应体系内氢气的量为1.951 mol(忽略其他副反应)。 ②x1显著低于x2的原因是催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累。 ③在图2中绘制“C10H18→C10H12→C10H8”的“能量—反应过程”示意图。 答案:如图所示 Ⅱ.(1)科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250 ℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。 电极反应式:Fe2O3+6e-+3H2O===2Fe+6OH-和2Fe+3H2O+N2===Fe2O3+2NH3。 (2)常温下饱和亚硫酸溶液的物质的量浓度为1.25 mol·L-1,电离常数Ka1=1.54×10 7 -2,Ka2=1.02×10-7。向10 mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液V mL。当V=a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO)+c(HSO);当V=b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO)+c(HSO)+c(H2SO3);则a大于(填“大于”“小于”或“等于”)b。 4.(15分)(2019·江西师大附中模拟)H(3溴5甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线合成。 请回答下列问题: (1)C的化学名称为3,5二硝基苯甲酸,G中所含的官能团有醚键、羧基、溴原子(填名称)。 7 (4)化合物F的同分异构体中能同时满足下列条件的共有30种(不考虑立体异构)。 ①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应 7 7查看更多