- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练2含解析
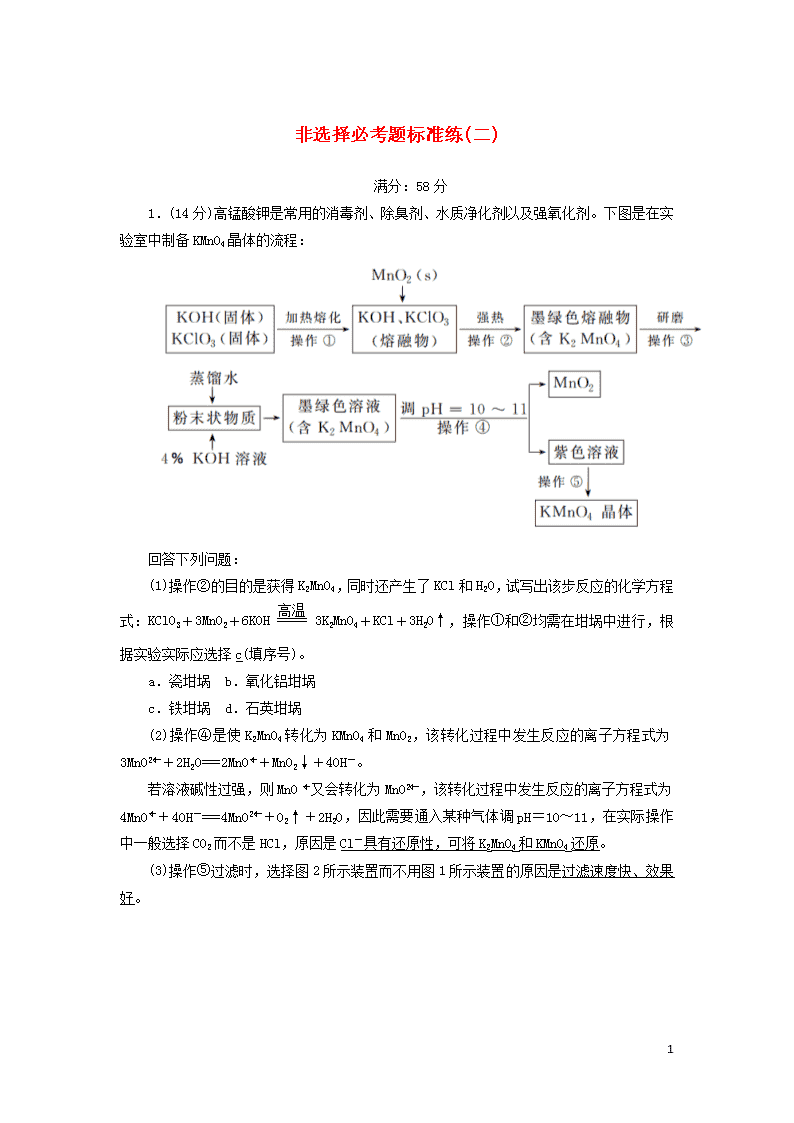
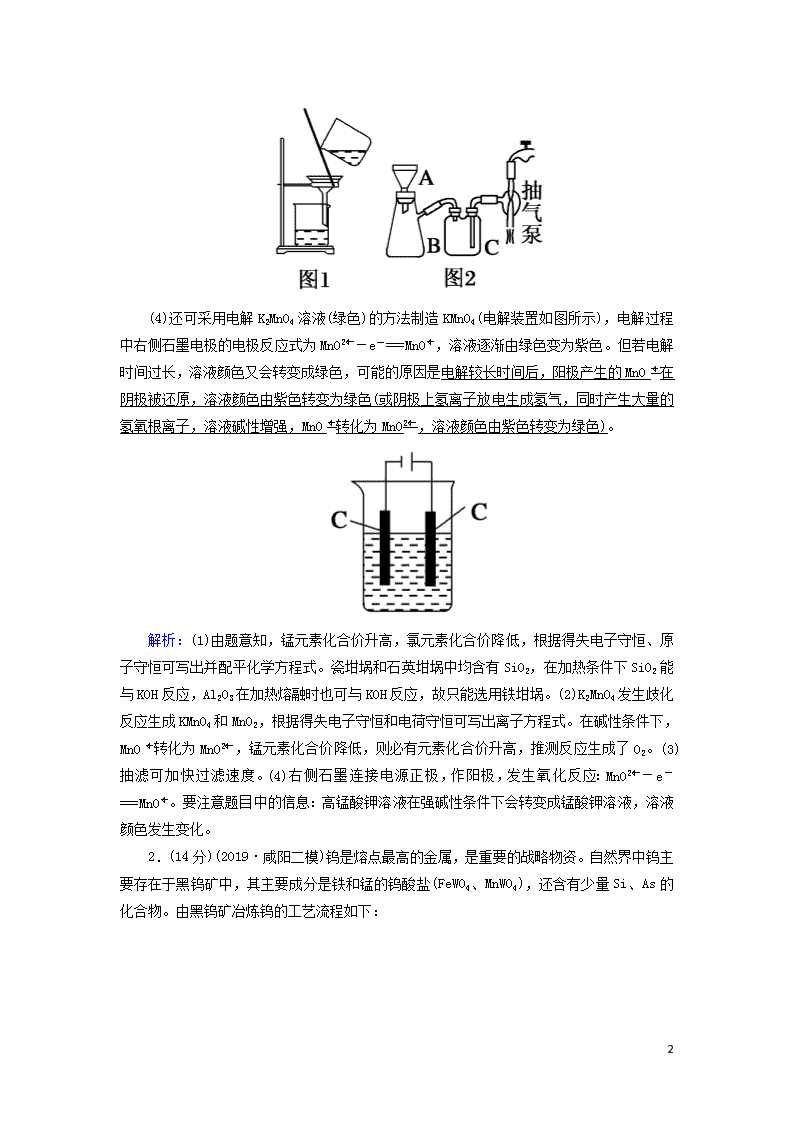
非选择必考题标准练(二) 满分:58分 1.(14分)高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂。下图是在实验室中制备KMnO4晶体的流程: 回答下列问题: (1)操作②的目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式:KClO3+3MnO2+6KOH3K2MnO4+KCl+3H2O↑,操作①和②均需在坩埚中进行,根据实验实际应选择c(填序号)。 a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚 (2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为3MnO+2H2O===2MnO+MnO2↓+4OH-。 若溶液碱性过强,则MnO又会转化为MnO,该转化过程中发生反应的离子方程式为4MnO+4OH-===4MnO+O2↑+2H2O,因此需要通入某种气体调pH=10~11,在实际操作中一般选择CO2而不是HCl,原因是Cl-具有还原性,可将K2MnO4和KMnO4还原。 (3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是过滤速度快、效果好。 9 (4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为MnO-e-===MnO,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是电解较长时间后,阳极产生的MnO在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,MnO转化为MnO,溶液颜色由紫色转变为绿色)。 解析:(1)由题意知,锰元素化合价升高,氯元素化合价降低,根据得失电子守恒、原子守恒可写出并配平化学方程式。瓷坩埚和石英坩埚中均含有SiO2,在加热条件下SiO2能与KOH反应,Al2O3在加热熔融时也可与KOH反应,故只能选用铁坩埚。(2)K2MnO4发生歧化反应生成KMnO4和MnO2,根据得失电子守恒和电荷守恒可写出离子方程式。在碱性条件下,MnO转化为MnO,锰元素化合价降低,则必有元素化合价升高,推测反应生成了O2。(3)抽滤可加快过滤速度。(4)右侧石墨连接电源正极,作阳极,发生氧化反应:MnO-e-===MnO。要注意题目中的信息:高锰酸钾溶液在强碱性条件下会转变成锰酸钾溶液,溶液颜色发生变化。 2.(14分)(2019·咸阳二模)钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含有少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下: 9 已知:①滤渣Ⅰ的主要成分是Fe2O3、MnO2;②上述流程中,钨的化合价只有在最后一步发生改变;③常温下钨酸溶于水。 (1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出FeWO4在熔融条件下发生碱分解生成Fe2O3的化学方程式:4FeWO4+O2+8NaOH2Fe2O3+4Na2WO4+4H2O。 (2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子含有SiO、HAsO、HAsO等,则“净化”过程中,加入H2O2时发生反应的离子方程式为HAsO+H2O2===HAsO+H2O,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4。 (3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度的升高而减小。如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则: ①T1查看更多