- 2021-08-23 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业9图像专题含解析 人教版选修4
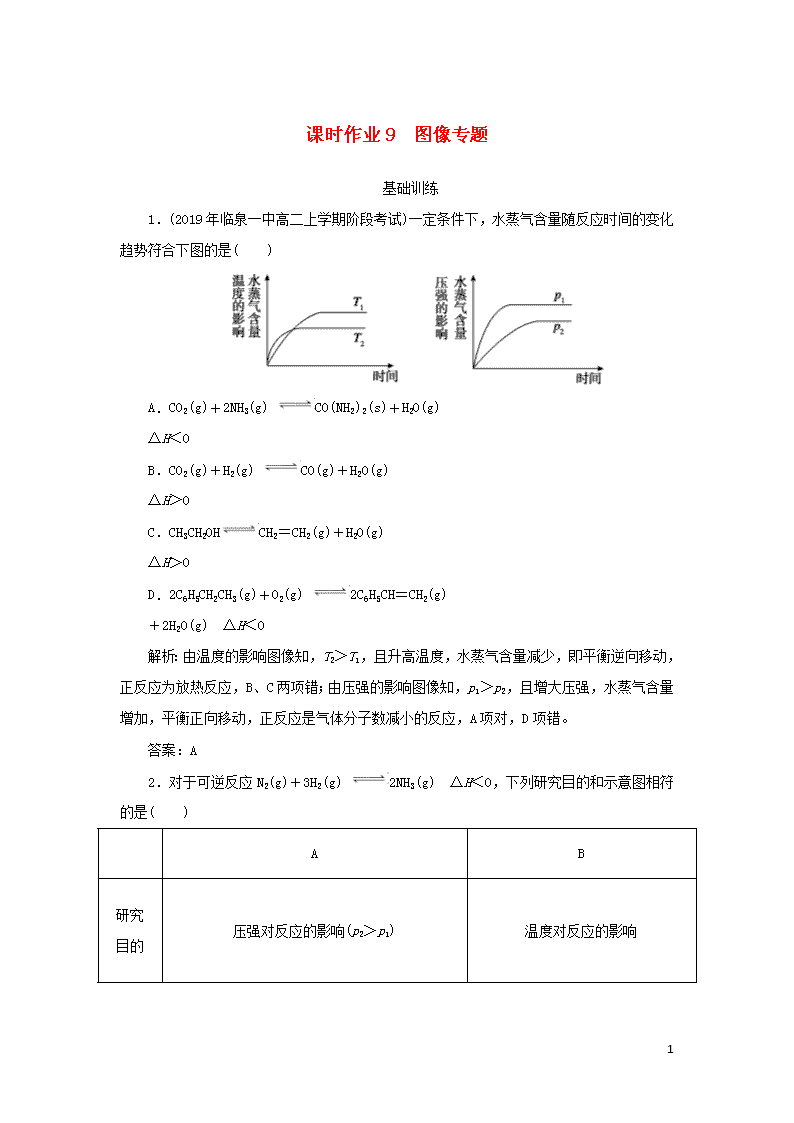
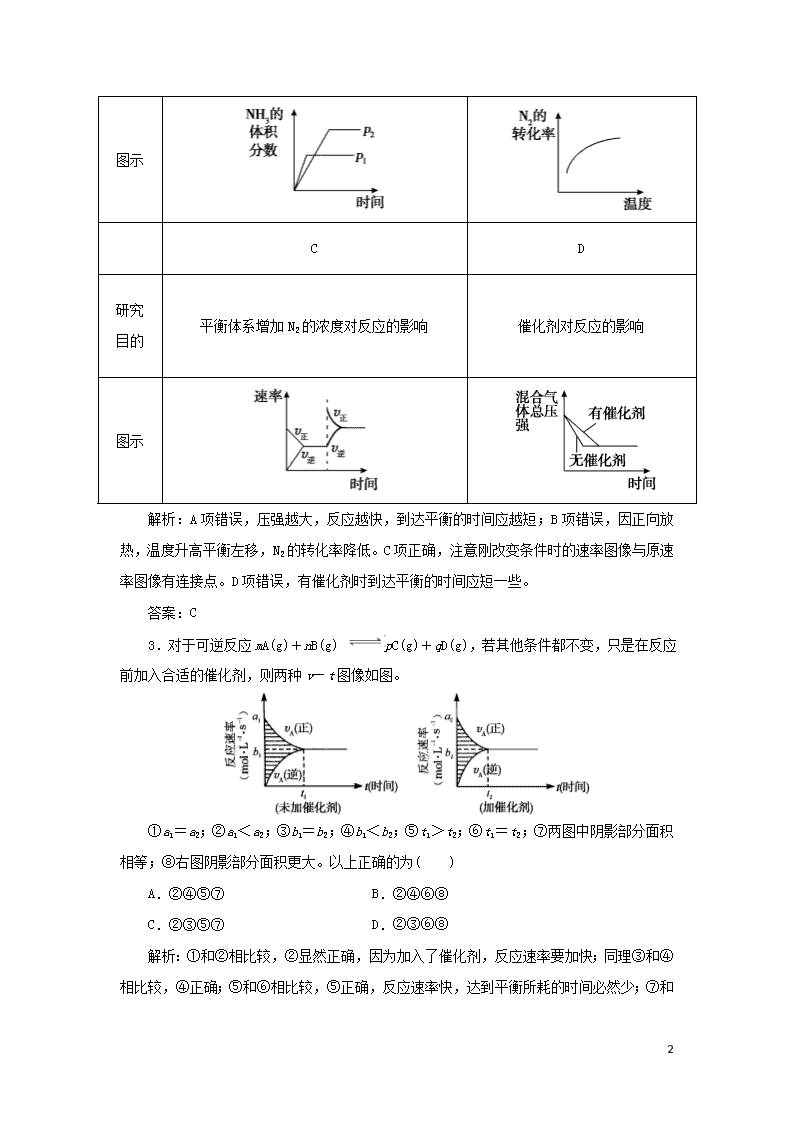
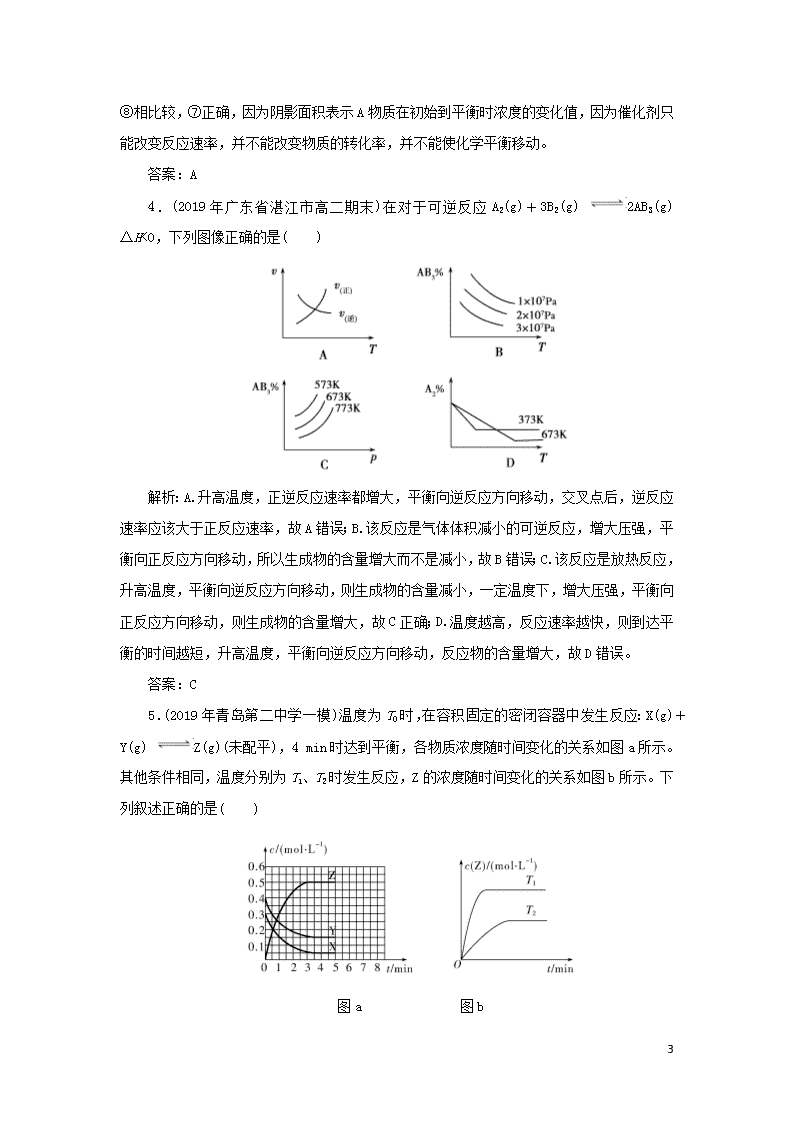
课时作业9 图像专题 基础训练 1.(2019年临泉一中高二上学期阶段考试)一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是( ) A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0 B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0 C.CH3CH2OHCH2=CH2(g)+H2O(g) ΔH>0 D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g) +2H2O(g) ΔH<0 解析:由温度的影响图像知,T2>T1,且升高温度,水蒸气含量减少,即平衡逆向移动,正反应为放热反应,B、C两项错;由压强的影响图像知,p1>p2,且增大压强,水蒸气含量增加,平衡正向移动,正反应是气体分子数减小的反应,A项对,D项错。 答案:A 2.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( ) A B 研究 目的 压强对反应的影响(p2>p1) 温度对反应的影响 10 图示 C D 研究 目的 平衡体系增加N2的浓度对反应的影响 催化剂对反应的影响 图示 解析:A项错误,压强越大,反应越快,到达平衡的时间应越短;B项错误,因正向放热,温度升高平衡左移,N2的转化率降低。C项正确,注意刚改变条件时的速率图像与原速率图像有连接点。D项错误,有催化剂时到达平衡的时间应短一些。 答案:C 3.对于可逆反应mA(g)+nB(g) pC(g)+qD(g),若其他条件都不变,只是在反应前加入合适的催化剂,则两种v—t图像如图。 ①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧右图阴影部分面积更大。以上正确的为( ) A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧ 解析:①和②相比较,②显然正确,因为加入了催化剂,反应速率要加快;同理③和④相比较,④正确;⑤和⑥相比较,⑤正确,反应速率快, 10 达到平衡所耗的时间必然少;⑦和⑧相比较,⑦正确,因为阴影面积表示A物质在初始到平衡时浓度的变化值,因为催化剂只能改变反应速率,并不能改变物质的转化率,并不能使化学平衡移动。 答案:A 4.(2019年广东省湛江市高二期末)在对于可逆反应A2(g)+3B2(g) 2AB3(g) ΔH<0,下列图像正确的是( ) 解析:A.升高温度,正逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A错误;B.该反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以生成物的含量增大而不是减小,故B错误;C.该反应是放热反应,升高温度,平衡向逆反应方向移动,则生成物的含量减小,一定温度下,增大压强,平衡向正反应方向移动,则生成物的含量增大,故C正确;D.温度越高,反应速率越快,则到达平衡的时间越短,升高温度,平衡向逆反应方向移动,反应物的含量增大,故D错误。 答案:C 5.(2019年青岛第二中学一模)温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g) Z(g)(未配平),4 min时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是( ) 图a 图b 10 A.发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z) B.图a中反应达到平衡时,Y的转化率为37.5% C.T0时,该反应的平衡常数为33.3 D.该反应正反应的反应热ΔH<0 解析:根据题图a可知,0~4 min时,X、Y的浓度分别减少0.25 mol·L-1、0.25 mol·L-1,Z的浓度增加0.5 mol·L-1,则化学方程式为X(g)+Y(g) 2Z(g),同一反应中各物质的反应速率之比等于其化学计量数之比,则2v(X)=2v(Y)=v(Z),A项错误;题图a中,Y的起始浓度为0.4 mol·L-1,平衡浓度为0.15 mol·L-1,则Y的转化率为×100%=62.5%,B项错误;达到平衡时,c(X)=0.05 mol·L-1,c(Y)=0.15mol·L-1,c(Z)=0.5mol·L-1,则平衡常数K==≈33.3,C项正确;根据题图b可知,T1条件下反应先达到平衡,则T1>T2,T2→T1,温度升高,c(Z)增大,则平衡向正反应方向移动,故正反应为吸热反应,ΔH>0,D项错误。 答案:C 6.密闭容器中进行反应:M(g)+N(g) R(g)+2L(?),R的体积百分含量φ(R)随时间的变化情况如图所示,下列叙述正确的是( ) A.正反应吸热,L是气体 B.正反应吸热,L是固体或液体 C.正反应放热,L是气体 D.正反应放热,L是固体或液体 解析:根据“先拐平数值大”可知T2>T1,p2>p1。温度升高,φ(R)降低,说明平衡向逆反应方向进行,逆向吸热,则正反应放热;压强增大,φ(R)降低,说明平衡向逆反应方向进行,即:逆向气体系数小,则L为气体,故C项正确。 答案:C 10 提高训练 7.在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量如图所示。下列说法正确的是( ) A.该反应的正反应为吸热反应 B.压强大小关系为p1<p2<p3 C.M点对应的平衡常数K的值约为1.04×10-2 D.在p2及512 K时,图中N点v正<v逆 解析:压强不变时,升高温度,平衡时甲醇的物质的量减小,平衡逆向移动,说明该反应的正反应为放热反应,A项错误;温度不变时,增大压强,平衡正向移动,平衡时甲醇的物质的量增大,则p3<p2<p1,B项错误;M点时,n(CH3OH)=0.25 mol,据此计算出各物质的平衡浓度分别为c(CO2)=0.75 mol·L-1,c(H2)=2 mol·L-1,c(CH3OH)=c(H2O)=0.25 mol·L-1,K=≈1.04×10-2,C项正确;在p2及512 K时,图中N点甲醇的物质的量比平衡时的物质的量小,反应正向移动才能达到平衡,此时v逆<v正,D项错误。 答案:C 8.可逆反应A(g)+2B(g) 3C(g)+4D(g) ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图像正确的是( ) 解析:A项,该反应是吸热反应,升温,平衡正向移动,则平衡常数K应增大,A错;B项,增大压强,平衡逆向移动,则B的转化率降低,B错;C项,催化剂不能使化学平衡发生移动,则D的产率不变,C错;D项,化学平衡常数只受温度影响,D对。 10 答案:D 9.(2019年成都龙泉中学高二下学期入学考试)下面是某化学研究小组探究外界条件对化学反应速率和化学平衡的影响规律图像,其图像和实验结论表达正确的是 ( ) 注:①中的反应式为:A(g)+3B(g) 2C(g);②中的反应式为:A(g)+B(g) 2C(g);③中的反应式为:A(g)+3B(g) 2C(g);④中的反应式为:A(g)+B(g) 2C(g) A.①是其它条件一定时,反应速率随温度变化的图像,正反应ΔH<0 B.②是其它条件一定时,化学平衡常数随温度的变化图像,正反应ΔH<0 C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂的曲线 D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2 解析:A.升高温度,化学平衡向吸热方向移动,正逆反应速率都增大,正反应速率大于逆反应速率,化学平衡向正反应方向移动,所以正反应是吸热反应,即正反应ΔH>0,故A错误;B.升高温度,平衡向吸热方向移动,平衡常数随着温度的增大而增大,说明平衡向正反应方向移动,正反应是吸热反应,即正反应ΔH>0,故B错误;C.催化剂能改变化学反应速率但不影响化学平衡,只是缩短反应到达平衡的时间,反应物的体积分数不变,故C正确;D.一定条件下,向含有一定量A的容器中逐渐加入B时,平衡向正反应方向移动,能提高A物质的转化率,该反应是一个反应前后气体体积不变的化学反应,增大压强,平衡不移动,故D错误。 10 答案:C 10.(2019年辽宁五校协作体联合模拟)氨是一种重要的化工原料,请回答下列各题: 已知合成氨的反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变初始氢气的物质的量对此反应平衡的影响。 (1)图1中0~10 min内该反应的平均速率v(H2)=________,11 min时,在其他条件不变的情况下,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”)。 (2)图2中,e、f、g三点对应的平衡状态中,N2的转化率最高的是________点。 (3)图2中,T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1________T2(填“>”“=”或“<”,后同),K1________K2。 (4)若开始时向容器中加入1 mol N2和3 mol H2,充分反应后,放出的热量________92.4 kJ(填“<”“>”或“=”),理由是__________________________。 (5)为有效提高氢气的转化率,实际生产中宜采取的措施有________(填标号)。 A.降低温度 B.不断补充氮气 C.恒容时,充入氦气 D.升高温度 E.原料气不断循环 F.及时移出氨 (6)氨催化氧化制NO在热的铂铑合金催化下进行,4NH3(g)+5O2(g) 4NO(g)+6H2O(g),反应过程中合金始终保持红热,当升高温度时,化学平衡常数K会________ (填“增大”“减小”或“不变”)。NH3的转化率在温度为T1时随反应时间(t)的变化曲线如图3所示。其他条件不变,仅改变温度为T2(T2>T1),在框图中画出温度为T2时,NH3的转化率随反应时间变化的预期结果示意图。 10 图3 解析:(1)v(N2)=0.015 mol·L-1·min-1,所以v(H2)=0.045 mol·L-1·min-1。压缩容器的体积即为增大体系压强,平衡正向移动,n(N2)减小,压缩的瞬间,n(N2)不变,与压缩前曲线有连接点,曲线d符合。(2)由于其他条件未发生变化,所以氢气的浓度越大,氮气的转化率越高,即e查看更多