2019-2020学年高中化学课时作业14pH的计算含解析 人教版选修4
课时作业14 pH的计算
基础训练
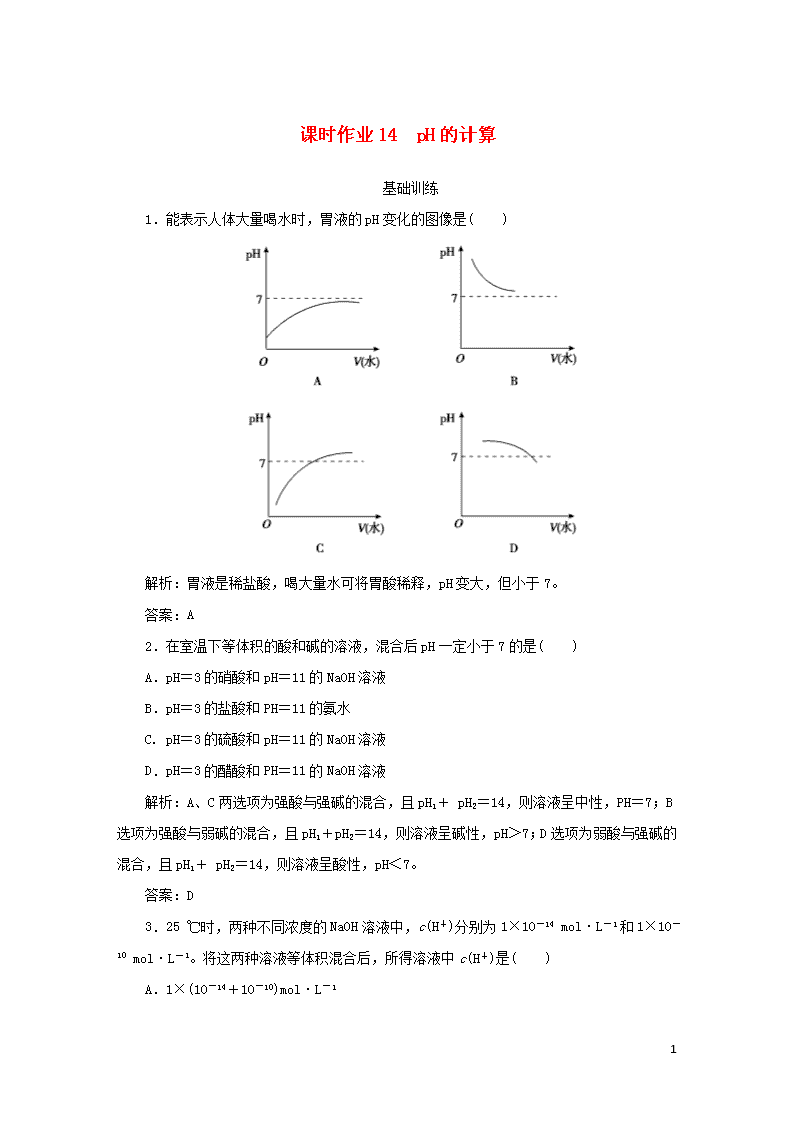
1.能表示人体大量喝水时,胃液的pH变化的图像是( )
解析:胃液是稀盐酸,喝大量水可将胃酸稀释,pH变大,但小于7。
答案:A
2.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
A.pH=3的硝酸和pH=11的NaOH溶液
B.pH=3的盐酸和PH=11的氨水
C. pH=3的硫酸和pH=11的NaOH溶液
D.pH=3的醋酸和PH=11的NaOH溶液
解析:A、C两选项为强酸与强碱的混合,且pH1+ pH2=14,则溶液呈中性,PH=7;B选项为强酸与弱碱的混合,且pH1+ pH2=14,则溶液呈碱性,pH>7;D选项为弱酸与强碱的混合,且pH1+ pH2=14,则溶液呈酸性,pH<7。
答案:D
3.25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是( )
A.1×(10-14+10-10)mol·L-1
9
B.mol·L-1
C.2×10-10 mol·L-1
D.2×10-14 mol·L-1
解析:c(H+)为1×10-14mol·L-1的NaOH溶液中c(OH-)=1 mol·L-1,c(H+)为1×10-10mol·L-1的NaOH溶液中c(OH-)=1×10-4 mol·L-1,设混合前两溶液的体积均为V L,则两溶液等体积混合后,c混(OH-)= mol·L-1≈5×10-1 mol·L-1,所以c混(H+)= mol·L-1=2×10-14 mol·L-1。
答案:D
4.若1体积硫酸恰好与10体积的氢氧化钠溶液完全反应,则二者物质的量浓度之比为( )
A.10∶1 B.5∶1
C.1∶1 D.1∶10
解析:H2SO4和NaOH完全反应时,存在关系:2c(酸)·V(酸)=c(碱)·V(碱),变换后得到:c(酸)∶c(碱)=V(碱)∶2V(酸)=5∶1。
答案:B
5.在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号
NaOH溶液体积
盐酸体积
溶液pH
①
20.00
0.00
8
②
20.00
20.00
6
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1 B.4 C.5 D.6
解析:据题意可知在该温度下水的离子积常数是1×10-12,而不是1×10-14,通过①可知,此NaOH溶液中c(OH-)=10-4 mol·L-1;由②可知,加入20 mL盐酸后溶液的pH=6,此时恰好完全中和,则c(H+)==1×10-4 mol·L-1,则c=4。
答案:B
6.(2019年河北邢台模拟)25 ℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va
7得:a>;由混合后溶液的pH=7得:n(H+)=n(OH-),即Va×10-a=Vb×10b-14,得=10a+b-14;由于VaV2,故D错误。
答案:B
14.(2019年山西省太原市第五中学高三第二次模拟)已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01 mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是( )
A.X、M 简单离子半径大小顺序:X>M
B.X、Y、Z、W、M 五种元素中只有一种是金属元素
C.Z 的最高价氧化物的化学式为ZO3
9
D.X、Z的最简单气态氢化物反应有白烟生成
解析: 由图信息可知,X、Z的最高价氧化物对应的水化物为一元强酸,则X为N元素,Z为Cl元素;M对应的为一元强碱,则M为Na元素;进一步可推出Y对应的为H2CO3,则Y为C元素;W对应H2SO4,则W为S元素。N和Na的简单离子的电子层结构相同,N的原子序数较小,故N3-的半径大于Na+,A正确; X、Y、Z、W、M 五种元素中只有M是金属元素,B正确; Z 的最高价氧化物的化学式为Cl2O7,C不正确; X、Z的最简单气态氢化物是氨气和氯化氢,两者反应生成氯化铵小颗粒,故有白烟生成,D正确。
答案:C
15.有三瓶pH均为2的盐酸溶液、硫酸溶液、醋酸溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间的关系是______(用“>”“<”或“=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则它们之间的关系是________;反应过程中放出H2的速率依次为b1、b2、b3,则它们之间的关系是________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则它们之间的关系是________。
解析:(1)HCl为一元强酸,H2SO4为二元强酸,当二者pH相同时,c(HCl)=2c(H2SO4),即c1=2c2;醋酸为一元弱酸,pH相同的醋酸的浓度远大于盐酸、硫酸的浓度,故c1=2c2<c3。
(2)取体积相同、pH相同的盐酸、硫酸、醋酸,分别与足量锌粉反应,开始时因c(H+)相同,反应速率相同,即a1=a2=a3,反应过程中由于醋酸会电离出H+,使溶液中c(H+)较盐酸、硫酸中c(H+)大,反应速率较快,即b3>b1=b2。
(3)当中和等物质的量浓度等体积的NaOH溶液时,醋酸的浓度大,所需体积小,故V1=V2>V3。
答案:(1)c1=2c2<c3
(2)a1=a2=a3 b3>b1=b2
(3)V1=V2>V3
16.(1)将pH=10和pH=12的NaOH溶液以1∶1的体积比混合,则混合后所得溶液的pH约为__________。
(2)0.2 mol/L NaHSO4和0.1 mol/L BaCl2溶液按等体积混合后,
9
则溶液的pH等于__________。
(3)用pH=4和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比为__________。
解析:欲求混合后溶液中的pH,应先判断混合后溶液的酸碱性。若呈碱性,应先求溶液中c(OH-),再求c(H+),而后计算pH;若呈酸性,可直接求出混合后c(H+),再计算pH。
答案:(1)11.7 (2)1 (3)9∶2
探究创析
17.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)95 ℃时,水的电离平衡曲线应为B,请说明理由:________________。25 ℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为________。
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”“小于”“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02 mol/L Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________。
解析:(1)水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)均增大,95 ℃时,水的电离平衡曲线应为B;25 ℃时,pH=9的NaOH溶液,c(OH-)=10-5 mol/L;pH=4的H2SO4溶液,c(H+)=10-4 mol/L;若所得混合溶液的pH=7,n(OH-)=n(H+),则c(OH-)·V(NaOH)=c(H+)·V(H2SO4),故NaOH溶液与H2SO4溶液的体积比为V(NaOH)∶V(H2SO4)=c(H+)∶c(OH-)=10∶1。(2)95 ℃时,水的离子积常数是Kw=10-12,若100体积pH=a的某强酸溶液中n(H+)=100×10-a mol=102-a mol,1体积pH=b的某强碱溶液n(OH-)=10-12÷10-b=10b-12mol,混合后溶液呈中性,102-amol=10b-12mol。2-a=b-12,所以a+b=14。(3)曲线A所对应的温度是室温,在室温下,pH=2的HCl溶液,c水(H+)=10-12 mol/L;pH=11的某BOH溶液中,c水(H+)=10-11 mol/L;水电离产生的H+的浓度越大,
9
水的电离程度就越大,若水的电离程度分别用α1、α2表示,则α1<α2。(4)曲线B所对应的温度是95 ℃,该温度下水的离子积常数是Kw=10-12,在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,则反应后溶液中c(OH-)=0.02 mol÷2 L=0.01 mol/L,由于该温度下水的离子积常数是Kw=10-12,所以c(H+)=10-10 mol/L,所得混合液的pH=10。
答案:(1)水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)均增大 10∶1
(2)a+b=14
(3)小于 (4)10
9
10