- 2021-08-23 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习专题十硫及其化合物含解析
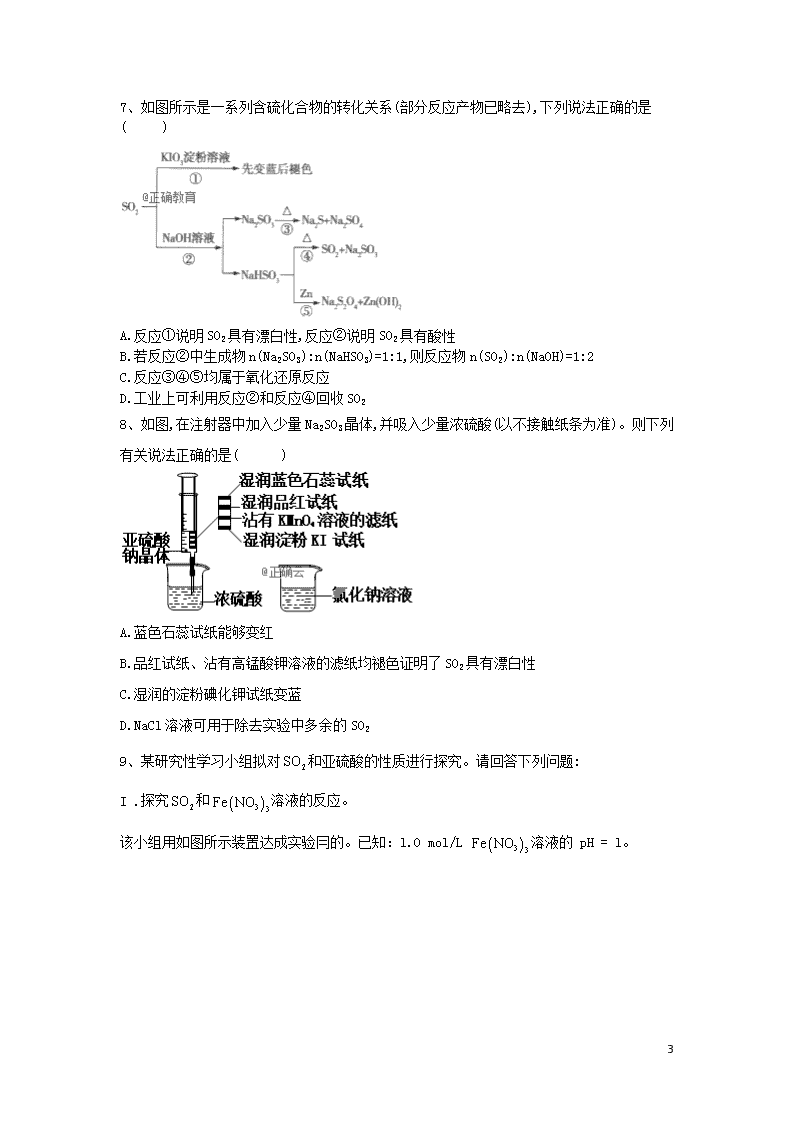
专题十 硫及其化合物 1、下列说法中,正确的是( ) A.SO2是酸性氧化物,可以用澄清石灰水来鉴别SO2与CO2 B.SO2能使品红溶液褪色,其漂白原理与氯水相同 C.SO2能使酸性KMnO4溶液褪色,说明SO2具有还原性 D.用水吸收硫在过量氧气中燃烧的产物,用于工业制备硫酸 2、设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22.4L Cl2通入足量的NaOH溶液充分反应,有NA个电子转移 B.100mL1mol·L−1 FeCl3溶液中所含Fe3+的数目为0.1NA C.1mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 D.84g NaHCO3固体含有离子的数目为NA 3、选用如图所示装置中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法中正确的是( ) A.按气流从左向右流向,装置的正确连接顺序是A→F→E→C→D→B B.丁中溶液褪色,乙中溶液变浑浊说明甲中生成了CO2 C.丙中品红溶液褪色,乙中溶液变浑浊说明甲中生成了CO2 D.丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 4、用如图所示装置进行实验,下列对实验现象的解释不合理的是( ) 实验 选项 ①中试剂 ①中现象 解释 A 品红溶液 溶液褪色 具有漂白性 B 溶液 产生胶状沉淀 酸性: C 酸性溶液 紫色褪去 具有还原性 17 D 酸性溶液 生成白色沉淀 与生成沉淀 A.A B.B C.C D.D 5、根据下列实验操作和现象所得出的结论错误的是( ) 选项 操作 现象 结论 A 向蔗糖中加入浓硫酸 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 浓硫酸具有脱水性和强氧化性 B 向盛有溶液的试管中加入几滴酸化的硫酸亚铁溶液 溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成 催化分解产生;分解反应放热,促进的水解平衡正向移动 C 铝片先用砂纸打磨,再加入到浓硝酸中 无明显现象 浓硝酸具有强氧化性,常温下,铝被浓硝酸钝化 D 向等浓度的KCl、KI混合液中逐滴滴加溶液 先出现黄色沉淀 A.A B.B C.C D.D 6、某研究小组利用图装置探究和硫酸溶液的反应原理。下列说法错误的是( ) A.装置B中若产生白色沉淀,说明能将氧化成 B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C.三颈烧瓶中通入的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气 17 7、如图所示是一系列含硫化合物的转化关系(部分反应产物已略去),下列说法正确的是( ) A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 B.若反应②中生成物n(Na2SO3):n(NaHSO3)=1:1,则反应物n(SO2):n(NaOH)=1:2 C.反应③④⑤均属于氧化还原反应 D.工业上可利用反应②和反应④回收SO2 8、如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( ) A.蓝色石蕊试纸能够变红 B.品红试纸、沾有高锰酸钾溶液的滤纸均褪色证明了SO2具有漂白性 C.湿润的淀粉碘化钾试纸变蓝 D.NaCl溶液可用于除去实验中多余的SO2 9、某研究性学习小组拟对和亚硫酸的性质进行探究。请回答下列问题: I .探究和溶液的反应。 该小组用如图所示装置达成实验冃的。已知:l.0 mol/L 溶液的 pH = l。 17 (1)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。 (2)装置B中产生了白色沉淀,说明具有 性。 (3)分析B中产生白色沉淀的原因: ①观点1:与反应;观点2:酸性条件下,与反应;观点3: 。 ②按观点1,装置B中反应的离子方程式为 ,为证明该观点,应进一步确认生成的新物质,实验操作及现象是 。 ③按观点2,只需将装置B中的溶液替换为等体积的下列溶液,在相同条件下进行实验。此时应选择的最佳溶液是 (填序号)。 a.0. 1mol/L 稀硝酸 b.1. 5 mol/L c.3. 0 mol/L溶液和0. 1 mol/L硫酸等体积混合的溶液 d.6. 0 mol/L溶液和0. 2 mol/L盐酸等体积混合的溶液 Ⅱ.探究的酸性强于。 该小组用图所示装置达成实验目的。 (4)装置的连接顺序为:纯净→ (选填字母),F中反应的离子方程式为 . (5)可证明的酸性强于的实验现象是 。 17 10、自20世纪60年代以来,人们发现了超过120种不同的含铁硫簇(如Fe2S2、Fe4S4、Fe8S7等)的酶和蛋白质。铁硫簇是普遍存在于生物体的最古老的生命物质之一。某化学兴趣小组在研究某铁硫簇的组成时,设计了下列实验: 实验一:测定硫的含量。 ⅰ.从图中选择合适的装置进行连接。 ⅱ.检查装置的气密性后,在装置A中放入0.4g铁硫簇的样品(含有不溶于水和稀盐酸的杂质),在装置B中加入品红溶液,在装置C中加入30mL0.1mol·L-1的酸性KMnO4溶液(反应过程中溶液体积变化忽略不计)。 ⅲ.通入空气并加热,发现装置A中固体逐渐转变为红棕色。 ⅳ.待固体完全转化后,取装置C中的酸性KMnO4溶液3.00mL,用0.1mol·L-1的碘化钾溶液进行滴定。记录数据如下: 滴定次数 待测溶液体积/mL 消耗碘化钾溶液体积/mL 滴定前刻度 滴定后刻度 1 3.00 1.00 7.50 2 3.00 1.02 6.03 3 3.00 1.00 5.99 实验二:测定铁的含量。 取实验一中装置A的硬质玻璃管中的残留固体加入足量稀盐酸中,充分溶解后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经灼烧得0.32g固体。 回答下列问题: 17 (1)装置接口的连接顺序为b→_____________(按气流方向填写导管口处字母)。 (2)检查实验一中装置A的气密性的方法是__________。 (3)滴定终点的判断方法是____________。 (4)装置B中品红溶液的作用是___________。有同学提出,撤去装置B,对实验没有影响,你的看法是_____(填“合理”或“不合理”),理由是_______________________。 (5)用KI溶液滴定酸性KMnO4溶液时发生反应的离子方程式为________________。 (6)请写出这种铁硫簇的化学式:_________。 (7)下列操作,可能引起x/y偏大的是( )(填标号) A.滴定剩余的KMnO4时,KI溶液滴到锥形瓶外边一滴 B.配制0.1mol·L-1 KI溶液时,定容时俯视刻度线 C.用碘化钾溶液滴定剩余的KMnO4时,滴定前滴定管中有气泡,滴定后无气泡 D.实验二中对滤渣灼烧不充分 11、煤燃烧排放的烟气含有和,形成酸雨、污染大气,采用溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题: (1)的化学名称为__________。 (2)在鼓泡反应器中通入含有含有和NO的烟气,反应温度为323K,溶液浓度为。反应一段时间后溶液中离子浓度的分析结果如下表: 离子 ①写出液脱硝过程中主要反应的离子方程式__________________________________。增加压强,NO的转化率____________(填“提高”“不变”或“降低”)。 ②随着吸收反应的进行,吸收剂溶液的pH逐渐____________(填“增大”“不变”或“减小”)。 ③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了和NO在烟气中的初始浓度不同,还可能是__________________________。 (3)在不同温度下,溶液脱硫、脱硝的反应中,和NO的平衡分压如图所示。 17 ①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。 ②反应的平衡常数K表达式为___________。 (4)如果采用NaClO、替代,也能得到较好的烟气脱硫效果。 ①从化学平衡原理分析,相比NaClO具有的优点是______________。 ②已知下列反应: 则反应的__________。 12、已知固体受热分解生成两种正盐,实验流程和结果如下: 已知:气体Y是一种纯净物,在标准状况下密度为1.518 g•L-1,请回答下列问题: (1)气体Y的电子式为 。 (2)实验流程中,受热分解的化学方程式为 。 (3)另取固体X试样和混合,加适量蒸馏水溶解,再加入 17 稀盐酸,立即有淡黄色沉淀产 生。则产生淡黄色沉淀的离子方程式为 (不考虑空气的影响)。 (4) 长期露置在空气中,会被氧化成,检验是否变质的实验操作 是 。 (5)某研究性学习小组通过图所示装置,利用电化学方法处理上述流程中产生的气体Y。基本工艺是将气体Y通入,待充分反应后过滤,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用。与a相连的电极反应式为 。 13、我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾() 设计如图所示装置进行实验: 已知:的熔点为16.8℃,沸点为46.8 ℃;S02的熔点为一72 °C,沸点为一10 °C。 请回答下列问题: (1)仪器a的名称是 ,a中的棒香能复燃,说明热分解产物含有 (填化学式)。 (2)A中固体由蓝色变为黑色,B中的现象是 。 (3)C中冰水的作用是 。 (4)D中品红溶液褪色,E中有、生成,写出E中生成的总的离子方程 17 式: 。 (5)若生成和的物质的量之比为1 : 1,则胆矾热分解的化学方程式 为 。 (6)小组同学用滴定法测定某胆矾样品中碎含置,取m g样品配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用0.100 0 mol/L的EDTA()标准溶液滴定至终点,平均消耗EDTA溶液V mL(滴定反应:)。 ①样品中的质量分数为 %(用含m、V的代数式表示)。 ②下列操作会导致含量的测定结果偏高的是 (填选项字母)。 a.未润洗锥形瓶b.滴定终点时仰视读数c.滴定终点时滴定管尖嘴中有气泡 答案以及解析 1答案及解析: 答案:C 解析: 2答案及解析: 答案:A 解析: 3答案及解析: 答案:A 17 解析:甲为反应发生装置,KMnO4可氧化SO2,用酸性KMnO4溶液除去SO2,再通过品红溶液,若溶液不褪色,可确认SO2已除干净,在排除SO2干扰的条件下,气体通过澄清石灰水,澄清石灰水变浑浊可确认CO2的存在,所以装置的正确连接顺序为A→F→E→C→D→B,A项正确;SO2具有漂白性,能使品红溶液褪色,丁装置用酸性KMnO4溶液除SO2,若丁中溶液褪色,SO2可能没除尽,若丙中品红溶液褪色,则乙中的澄清石灰水变浑浊无法证明甲中反应生成了CO2,B项错误;若丙中品红溶液褪色,则说明SO2没有除尽,SO2也能使澄清石灰水变浑浊,所以无法证明甲中有CO2生成,C项错误,丁和丙中溶液都褪色,说明SO2没有除尽,SO2干扰CO2的检验,不能根据乙中澄清石灰水变浑浊判断甲中生成了CO2,D项错误。 4答案及解析: 答案:D 解析: A.二氧化硫具有漂白性,能和有色物质反应生成无色物质而使品红溶液褪色,该实验体现二氧化硫漂白性,故A正确;B.亚硫酸酸性强于硅酸,向溶液通入二氧化硫气体,反应生成白色胶状硅酸沉淀,故B正确;C.二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该实验体现二 氧化硫还原性,故C正确;D.将通入溶液,酸性条件下硝酸将二氧化硫氧化生成硫酸,硫酸与硝酸钡反应,有白色沉淀硫酸钡生成,故D错误。 5答案及解析: 答案:B 解析:A.浓硫酸使蔗糖脱水后,C与浓硫酸发生 氧化还原反应生成二氧化硫,由现象可知浓硫酸具有脱水性和强氧化性,故A正确;B.溶液变成棕黄色, 说明将氧化为. —段时间后,溶液中 出现气泡,说明催化分解产生,故B错 误;C.常温下A1遇浓硝酸发生钝化,无现象,故C正 确;D.小的先沉淀,先生成黄色沉淀,则,故0正确。 6答案及解析: 答案:A 解析: A.具有氧化性,可将二氧化硫铽化成硫酸根,本身被还原成二价铁,反应的离子方程式是,在酸性条件下也与,和反应生成硫酸钡沉淀,出现白色沉淀,装置B 17 中若产生白色沉淀,不能说明能将氧化成、故A错误; B.配制70%硫酸溶液是浓硫酸加入水中稀释,需要的玻璃仪器有量筒、烧杯、玻璃棒,故B正确;C.为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,目的是排尽装置内的空气,故C正确;D.导气管直接插入溶液时能发生倒吸,反应可能会生成NO, 不能被氢氧化钠溶液吸收,故D正确: 7答案及解析: 答案:D 解析:反应①中溶液先变蓝后褪色的原因是KlO3被还原先得到I2,最终得到I-,体现了SO2的还原性,反应②是酸性氧化物和碱的反应,体现了SO2的酸性,A项错误;根据元素守恒,当n(Na2SO3):n(NaHSO3)=1:1 时,n(SO2):n(NaOH) = 2: 3,B项错误;反应④是非氧化还原反应,C项错误;反应②吸收了二氧化硫,反应④放出了SO2,可以通过反应②④回收二氧化硫,D项正确 8答案及解析: 答案:A 解析: 9答案及解析: 答案:(1)打开弹簧夹,向体系中通入一段时间的,关闭弹簧夹 (2)还原性 (3)①与、 ()都反应②取少量B中溶液于一支洁净的试管中,加入几滴铁氰化钾溶液,如果产生蓝色沉淀,就说明有亚铁离子生成,观点1正确③d (4)CEDF ; (5)D中品红溶液不褪色,F中出现白色沉淀 解析:(1)因为空气中氧气也具有氧化性,对实验造成干扰,为防止空气干扰,用氮气将空气排出,所以为排尽空气,滴加浓硫酸之前应进行的操作是打开弹簧夹,向体系中通入一段时间的,关闭弹簧夹。 17 (2)和溶液不反应,装置B中有白色沉淀生成,说明有生成,该反应中S元素化合价由+4价变为+ 6价,则二氧化硫体现还原性。 (3)①观点3:与及酸性条件下与也反应;②按观点1,与反应生成和, 离子方程式为,要检验可以用铁氰化钾溶液检验,其操作及现象为取少量 B中溶液于一支洁净的试管中,加入几滴铁氰化钾溶液,如果产生蓝色沉淀,就说明有亚铁离子生成,观点I正确;③按观点2,只需将装置B中的溶液替换为c () = 0. 1 mol/L、c() = 3.0 mol/L的溶液即 可,a、0. 1 mol/L稀硝酸中c()不符合,故a错误; b、 1.5 mol/L中c ()不符合,故b 错误; c、 3. 0 mol/L溶液和0. 1 mol/L硫酸等体积混合的溶液中c()不符合,故c错误;d、6.0 mol/ L 溶液和0. 2 mol/L盐酸等体积混合的溶液中c ()、c()都符合,故d正确。 (4)探究的酸性强于,可以用强酸制 取弱酸的方法检验,因为亚硫酸具有还原性、具有强氧化性,二者发生氧化还原反应,所以应该先将亚硫酸转化为没有还原性的酸,再用该酸与次氯酸盐制取次氯酸即可。C装置制取二氧化碳、D装置检验二氧化硫、E装置吸收二氧化硫、F装置制取,所以装置顺序为CEDF,F中离子方程式为。 (5)D中品红不褪色,就说明气体中不含二氧化硫,只有二氧化碳,二氧化碳再和漂白粉溶液反应生成白色沉淀即可证明,所以可证明的酸性强于的实验现象是D中品红溶液不褪色,F中出现白色沉淀。 10答案及解析: 答案:(1)f→e→d→c(→g) (2)在导管b后接上长导管,把长导管末端插入水中,关闭a处开关,用酒精灯微热硬质玻璃管,若长导管口处有气泡产生,撤去洒精灯,长导管末端形成一段水柱,说明装置气密性良好 17 (3)加入最后一滴KI溶液,溶液紫色褪去,且半分钟内不恢复为紫色 (4)检验二氧化硫是否被酸性高锰酸钾溶液完全吸收;合理;若装置C中酸性高锰酸钾溶液的紫色不褪去,说明二氧化硫被完全吸收 (5)2+16H++10I-=2Mn2++5I2+8H2O (6)Fe4S5 (7)ACD 解析:(1)图示装置A中FexSy在加热条件下与空气作用可生成SO2,要测定硫的含量需用酸性KMnO4溶液吸收SO2,再用品红溶液检验SO2是否被完全吸收,即实验装置接口的连接顺序为b→f→e→d→c(→g)。 (3)当滴入最后一滴KI溶液,溶液的紫色褪去,且30s内颜色不再发生变化,说明达到滴定终点。 (4)装置B中品红溶液的作用是检验SO2是否完全被酸性KMnO4溶液吸收;实验结束时若装置C中紫色没有完全褪去,说明SO2完全被吸收,故该同学的看法合理。 (5)酸性KMnO4溶液能将I-氧化为I2,反应的离子方程式为2+16H++10I-=2Mn2++5I2+8H2O。 (6)反应前装置C中KMnO4的物质的量为0.1mol·L-1×0.03L=0.003mol,滴定剩余的KMnO4时消耗0.1mol·L-1 KI溶液的体积为[(6.03-1.02)+(5.99-1.00)]mL+2=5.00mL(第一次滴定结果误差较大,故舍去),根据2~10I-和消耗KI溶液的体积可得出吸收SO2后溶液中剩余n(KMnO4)=0.1mol·L-1×0.005L×=0.001mol,则反应中消耗KMnO4的物质的量为0.003mol-0.001mol=0.002mol,根据5SO2~2KMnO4和消耗0.002mol KMnO4可求出SO2的物质的量为0.005mol,即该铁硫簇中S为0.005mol,实验二中最终得到的0.32g固体为Fe2O3,根据2Fe~Fe2O3可求出n(Fe)=0.004mol,即该铁硫获中n(Fe):n(S)=4:5,则该铁硫簇的化学式为Fe4S5。 (7)滴定剩余的KMnO4时KI溶液滴到锥形瓶外一滴,导致测得的剩余KMnO4的物质的量偏大,则与SO2反应消耗KMnO4的物质的量偏小,得出的y偏小,即引起x/y偏大,A正确;配制0.1mol·L-1 KI溶液时,定容时俯视刻度线,导致溶液浓度偏大,则测得的剩余的KMnO4的物质的量偏小,与SO2反应消耗的KMnO4的物质的量偏大,y偏大,则引起x/y偏小,B错误;滴定前滴定管中有气泡,滴定后无气泡,即滴定时消耗KI溶液的体积偏大,测得的剩余KMnO4 17 的物质的量偏大,同理导致x/y偏大,C正确;实验二中对滤渣灼烧不充分,导致残渣质量增加,即样品中n(Fe)偏大,x偏大,导致x/y偏大,D正确。 11答案及解析: 答案:(1)亚氯酸钠; (2)①;提高 ②减小 ③大于;NO溶解度较低或脱硝反应活化能较高 (3)①减小;② (4)①形成沉淀,反应平衡向产物方向移动,转化率提高 ② 解析:(1)的化学名称为亚氯酸钠; (2)①脱硫过程就是烟气中的NO被溶液吸收的过程,由表中数据可知NO与在溶液中反应后主要生成和,离子方程式为;增加压强,NO的转化率提高。②随着吸收反应的进行,减小,pH逐渐减小。③由表中数据可知,反应一段时间后溶液中的浓度大于的浓度,说明脱硫反应速率大于脱硝反应速率。 (3)①由图象可知,升高温度,气体的平衡分压增大,说明平衡逆向移动,平衡常数减小。 (4)①采用替代NaClO脱硫,反应生成沉淀,平衡向产物方向移动,转化率提高。 ②(I) (II) (III),运用盖斯定律,由(I)+(II)-(III)可得反应:,故。 17 12答案及解析: 答案:(1) (2) (3) (4)取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液.若生成白色沉淀,则说明有被氧化为 (5) 解析: (1)气体Y是一种纯净物,标准状况下密度为 1.518 g•L 1,则 Y 的摩尔质量为 1. 518 g • L -122.4 L g •mol-1=34 g •mol-1根据元素守恒,推出Y为,电子式为. (2)由以上分析可知,气体Y为,以及生成气体Y 的条件,推出固体X中含有即固体X中含有,溶液中加入溶液,出现白色沉淀,该白色 沉淀为,则固体X中含有,受热分解生成和,反应的化学方程式为 。 (3)固体X试样和混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,即有S单质生成,反应的离子方程式为。 (4) 长期暴露在空气中,会被氧化成, 检验是否变质的实验操作是:取少量亚硫酸 钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有被氧化为,亚硫酸钠变质; 17 (5)将气体Y通入,发生氧化还原反应,装置图中放出氢气的一端为阴极,b为电源负极,a为电源正极,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用,说明亚铁离子在阳极失电子生成了铁离子,电极反应为 13答案及解析: 答案:(1)(球形)干燥管 (2)固体由白色变为蓝色 (3)防止挥发(其他合理答案也给分) (4) (5) (6) ;b 解析:(1)仪器a的名称是球形干燥管,也可称为干 燥管;在a中,棒香能复燃,说明反应中产生了助燃 性的气体氧气,故答案应为(球形)干燥管、; (2)A中固体由蓝色变为黑色,说明胆矾发生了分 解,产生了CuO和水等。故B中的白色粉末因吸水变为蓝色,故答案应为固体由白色变为蓝色; (3)由题目所给信息可知. 的熔点为16. 8℃,沸 点为46. 8 ℃,所以C中冰水的作用是为了使凝结,防止其挥发,影响对的检验,故答案应为 防止挥发; (4)D中品红溶液褪色,证明气体中存,故多E中为NaOH与反应生成,后被氧气氧化为,该反应总的离子方程式为; (5)在反应中当生成1 mol时转移2mol电子,则应有0. 5 mol 02生成.根据题目中生成和的物质的量之比为1 : 1,则胆矾热分解的化学方程式为 17 (6)①设胆矾样品中的质量为x克,所以所 取待测液中含有的铜离子的物质的量可表示为由滴定反应原理,可建立如下关系: 1 1 列算式,x = 0. 08V g;则样品中的质量分数为 ②a.由于待测液中溶质的量由滴定管控制,故未润洗锥形瓶,对滴定实验结果不产生影响;滴定终点时仰视读数,则使读得标准液的消耗体积偏大,由可知滴定结果偏高滴定终点时滴定管尖嘴中有气泡,则使读得标准 液的消耗体积比实际消耗的偏小,由可知滴定结果偏低;所以导致含量的测定结 果偏高的是b。 17查看更多