- 2021-08-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 氨和铵盐(提高)巩固练习 新人教版必修1
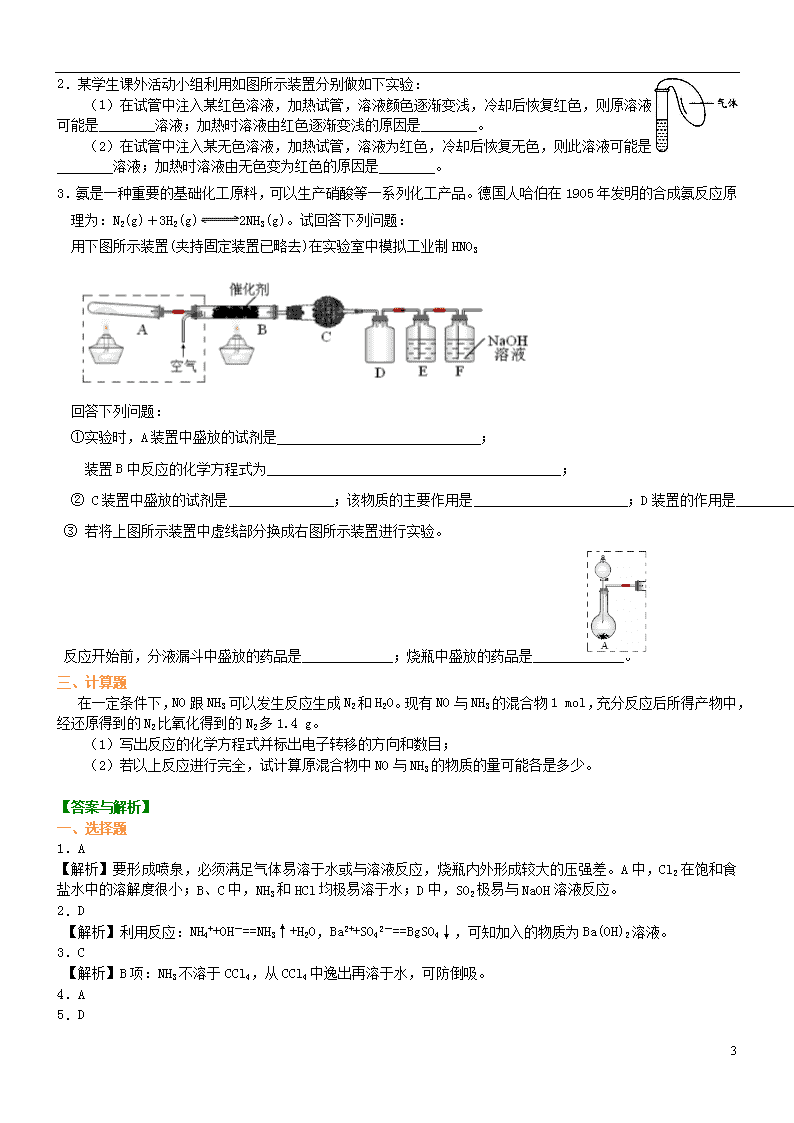
氨和铵盐 【巩固练习】 一.选择题(每小题只有一个选项符合题意) 1.右图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹。下列与实验事实不相符的是( )。 A.Cl2(饱和食盐水) 无色喷泉 B.NH3(H2O含石蕊) 蓝色喷泉 C.HCl(H2O含石蕊) 红色喷泉 D.SO2(NaOH溶液) 无色喷泉 2.只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )。 A.NaOH溶液 B.AgNO3溶液 C.BaCl2溶液 D.Ba(OH)2溶液 3.已知NH3极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做NH3气体尾气吸收的是( )。 4.检验某晶体是铵盐时,将待检物取出少量放在试管中,再( ) A.加烧碱溶液,加热,用湿润的红色石蕊试纸在管口检验 B.直接加热,用湿润的红色石蕊试纸在管口检验 C.加烧碱溶液,加热,向试管中滴加紫色石蕊试液 D.加水溶解,滴加无色酚酞试液,观察是否变红 5.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( ) 6.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) 气体 a b c A NO2 浓硝酸 铜片 NaOH溶液 B SO2 浓硫酸 铜片 酸性高锰酸钾溶液 C NH3 浓氨水 生石灰 碱石灰 D CO2 稀硫酸 CaCO3粉末 浓硫酸 7.向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是( )。 A.K+、Br-、CO32- B.Al3+、H+、MnO4- C.NH4+、Fe3+、SO42- D.Ag+、Cu2+、NO3- 5 8.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )。 A.加热,将湿润的红色石蕊试纸放在管口 B.加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口 D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 9.某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂挂在铁架台上,另取一只盛有某种溶液的烧杯,放在纸蝴蝶身下方(如下图所示)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )。 A B C D 纸蝴蝶上的喷洒液 酚酞 紫色石蕊 酚酞 紫色石蕊 小烧杯中的溶液 浓氨水 浓盐酸 氢氧化钠溶液 浓硫酸 10.已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两种溶液等体积混合,所得氨水溶液的质量分数( )。 A.等于15% B.大于15% C.小于15% D.无法估算 11.把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用6 mol烧碱刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2,则原溶液中c (NO3-)为( )。 A. B. C. D. 12.如下图所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来。气体X和液体Y不可能是( )。 X Y A NH3 H2O B SO2 NaOH溶液 C CO2 6 mol·L-1 H2SO4溶液 D HCl 6 mol·L-1 Na2SO4溶液 13.下列各组物质中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中(如下图所示),最终肯定不会有沉淀生成的是(假定实验过程中不发生倒吸现象)( )。 X Y Z A CO2 SO2 CaCl2 B NH3 SO2 BaCl2 C NH3 CO2 CaCl2 D Cl2 SO2 BaCl2 二、填空题 1.已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示: (1)D的化学式(分子式)是________,E的化学式(分子式)是________。 (2)A和B反应生成C的化学方程式是________________________ ________________________________________________________________________。 (3)E和F反应生成D、H和G的化学方程式是_________________ ________________________________________________________________________。 5 2.某学生课外活动小组利用如图所示装置分别做如下实验: (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________。 (2)在试管中注入某无色溶液,加热试管,溶液为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________。 3.氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品。德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g)2NH3(g)。试回答下列问题: 用下图所示装置(夹持固定装置已略去)在实验室中模拟工业制HNO3 回答下列问题: ①实验时,A装置中盛放的试剂是 ; 装置B中反应的化学方程式为 ; ② C装置中盛放的试剂是 ;该物质的主要作用是 ;D装置的作用是 ; ③ 若将上图所示装置中虚线部分换成右图所示装置进行实验。 反应开始前,分液漏斗中盛放的药品是 ;烧瓶中盛放的药品是 。 三、计算题 在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO与NH3的混合物1 mol,充分反应后所得产物中,经还原得到的N2比氧化得到的N2多1.4 g。 (1)写出反应的化学方程式并标出电子转移的方向和数目; (2)若以上反应进行完全,试计算原混合物中NO与NH3的物质的量可能各是多少。 【答案与解析】 一、选择题 1.A 【解析】要形成喷泉,必须满足气体易溶于水或与溶液反应,烧瓶内外形成较大的压强差。A中,Cl2在饱和食盐水中的溶解度很小;B、C中,NH3和HCl均极易溶于水;D中,SO2极易与NaOH溶液反应。 2.D 【解析】利用反应:NH4++OH-==NH3↑+H2O,Ba2++SO42-==BgSO4↓,可知加入的物质为Ba(OH)2溶液。 3.C 【解析】B项:NH3不溶于CCl4,从CCl4中逸出再溶于水,可防倒吸。 4.A 5.D 5 【解析】A图应改为气体长进短出,B图改为倒扣漏斗防倒吸,C图温度计水银球高度应与蒸馏烧瓶支管口平齐。 6.D 【解析】装置图分三部分,左边是气体发生装置,中间是除杂,右边是气体收集。A中NO2 不能用氢氧化钠溶液除杂,它本身与其反应生成盐;B中不能用酸性高锰酸钾溶液除杂,自身可以被氧化;C中氨气不能用向上排空气法收集;D用碳酸钙粉末和稀硫酸可以。 7.A 【解析】通入足量NH3后,Al3+、H+、Fe3+、Ag+、Cu2+等离子均不可能大量存在。 8.A 【解析】铵盐的检验原理是:NH4++OH-NH3↑+H2O,再用试纸或浓盐酸检验氨气的存在。 9.A 【解析】浓氨水易挥发,酚酞本身无色,遇NH3变红色。浓盐酸易挥发,而石蕊遇HCl由紫色变成红色不符合条件。NaOH溶液、浓H2SO4不易挥发,即无现象。 10.C 【解析】两种浓度的氨水若等质量混合,则质量分数为15%,因等体积的25%的氨水的质量小于5%的氨水的质量,故混合液的质量分数小于15%。 11.B 【解析】有关反应的离子方程式为:NH4++OH-NH3↑+H2O,SO42-+Ba2+==BaSO4↓。 每份中:n (NH4+)=6 mol,n (SO42-)=c mol。 所以每份中:n (NH4NO3)=(b-2c) mo1(据溶液中阴阳离子所带电荷守恒)。 原溶液中,所以B项正确。 12.C 【解析】因为小气球鼓胀,锥形瓶内气体压强减小,CO2在H2SO4溶液中的溶解度比水中更小,所以气体X和液体Y不可能是C项。 13.A 【解析】A项中不会产生沉淀;B项产生亚硫酸钡沉淀;C中可能产生碳酸钙沉淀;D中产生硫酸钡沉淀。 二、填空题 1. (1)NH3 NH4Cl (2)H2+Cl22HCl (3)2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2 【解析】框图推断题的关键是找准切入点,由题目提示知A、B、C、D为气体,E、F为固体,由D+C―→E可知E为铵盐,再由E+F―→D知D为氨气,且F为碱,又知“G为氯化钙”推出F为Ca(OH)2,C为HCl气体。 2.(1)稀氨水和酚酞 稀氨水中的NH3逸出,所以溶液的颜色变浅 (2)溶有SO2气体的品红 SO2气体逸出,品红溶液恢复红色 【解析】本题综合考查NH3和SO2与试剂之间的反应规律,即NH3溶于水显碱性,而SO2具有使品红溶液褪色的性质。 气体的溶解度随着温度升高而减小,温度升高,氨气逸出,溶液颜色变浅,又由于NH3极易溶于水,冷却后氨气重新溶于水,又恢复红色。同理,SO2溶于品红溶液,可使品红溶液褪色,SO2气体逸出后品红溶液恢复红色,冷却后,SO2重新溶于溶液中,溶液又褪色。 3.①NH4Cl和Ca(OH)2; ②P2O 5;吸收H2O和NH3;安全瓶的作用 ③H2O2; 5 浓NH3·H2O和MnO 2 三、计算题 (1) (2)0.3 mol NO和0.7 mol NH3或0.2 mol NH3和0.8 mol NO。 【解析】 6 mol NO还原得到3 mol N2,4 mol NH3氧化得到2 mol N2,两者相差1 mol N2。现相差1.4 g,1.4 g÷28 g·mol-1=0.05 mol,相当于0.3 mol NO和0.2 mol NH3反应。 依题意NO和NH3的总物质的量为1 mol,其中必有一种过量,所以有两种情况:0.3 mol NO和0.7 mol NH3;0.2 mol NH3和0.8 mol NO。 5查看更多