- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版江苏新高考选考化学(苏教版)一轮复习课后达标检测:专题6 1 第一单元 化学反应中的热效应
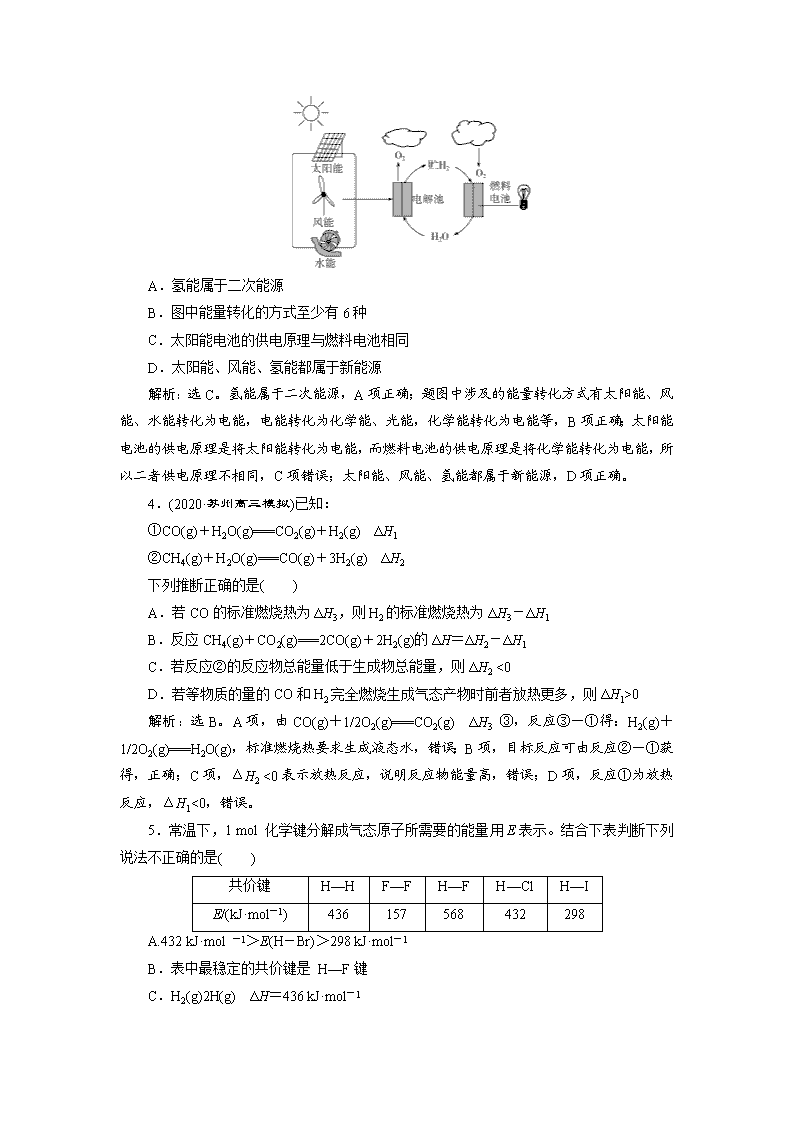
一、单项选择题 1.(2020·奉贤质检)化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下: 下列关于合成氨反应的叙述中不正确的是( ) A.该过程表明在化学反应中存在化学键的断裂与形成 B.在催化剂的作用下,反应物的化学键变得容易断裂 C.过程②需吸收能量,过程③则放出能量 D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 解析:选D。由题图可知,每3个氢气分子和1个氮气分子断键得到原子,然后原子重新结合生成2个氨分子,A正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物化学键的断裂和生成物化学键的形成变得更容易,B正确;化学键的断裂需要吸收能量,而化学键的形成则放出能量,从题图可看出②为化学键断裂过程,③为化学键形成过程,C正确;化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D错误。 2.(2020·南通高三模拟)已知2H2O2(l)===2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( ) A.途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 B.2 mol H2O2(l)的能量高于2 mol H2O(l)的能量 C.其他条件相同,产生相同量氧气时放出的热量,途径Ⅰ大于途径Ⅱ D.其他条件相同,产生相同量氧气时所需的时间,途径Ⅰ大于途径Ⅱ 解析:选C。途径Ⅱ中活化能较低,可能是加入催化剂,A项正确;由题图可知,题给反应为放热反应,2 mol H2O2(l)的能量高于2 mol H2O(l)和1 mol O2(g)之和,B项正确;该反应放出的热量与途径无关,C项错误;途径Ⅱ中加入催化剂,降低了活化能,化学反应速率更快,D项正确。 3.(2020·邢台高三期末)一种生产和利用氢能的途径如图所示。下列说法中错误的是( ) A.氢能属于二次能源 B.图中能量转化的方式至少有6种 C.太阳能电池的供电原理与燃料电池相同 D.太阳能、风能、氢能都属于新能源 解析:选C。氢能属于二次能源,A项正确;题图中涉及的能量转化方式有太阳能、风能、水能转化为电能,电能转化为化学能、光能,化学能转化为电能等,B项正确;太阳能电池的供电原理是将太阳能转化为电能,而燃料电池的供电原理是将化学能转化为电能,所以二者供电原理不相同,C项错误;太阳能、风能、氢能都属于新能源,D项正确。 4.(2020·苏州高三模拟)已知: ①CO(g)+H2O(g)===CO2(g)+H2(g) ΔH1 ②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2 下列推断正确的是( ) A.若CO的标准燃烧热为ΔH3,则H2的标准燃烧热为ΔH3-ΔH1 B.反应CH4(g)+CO2(g)===2CO(g)+2H2(g)的ΔH=ΔH2-ΔH1 C.若反应②的反应物总能量低于生成物总能量,则ΔH2 <0 D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH1>0 解析:选B。A项,由CO(g)+1/2O2(g)===CO2(g) ΔH3 ③,反应③-①得:H2(g)+1/2O2(g)===H2O(g),标准燃烧热要求生成液态水,错误;B项,目标反应可由反应②-①获得,正确;C项,ΔH2 <0表示放热反应,说明反应物能量高,错误;D项,反应①为放热反应,ΔH1<0,错误。 5.常温下,1 mol 化学键分解成气态原子所需要的能量用E表示。结合下表判断下列说法不正确的是( ) 共价键 H—H F—F H—F H—Cl H—I E/(kJ·mol-1) 436 157 568 432 298 A.432 kJ·mol -1>E(H-Br)>298 kJ·mol-1 B.表中最稳定的共价键是 H—F键 C.H2(g)2H(g) ΔH=436 kJ·mol-1 D.H2 (g)+F2(g)===2HF(g) ΔH=-25 kJ·mol-1 解析:选D。由于 H—Br键的键长在H—Cl键和H—I键的键长之间,所以其键能在H—Cl键和H—I键之间,A正确;表中H—F键的键能最大,所以H—F键最稳定,B正确;断裂1 mol H—H键吸收436 kJ能量,C正确;D项,ΔH=反应物的总键能-生成物的总键能=(436+157-568×2) kJ·mol-1=-543 kJ·mol-1,D错误。 6.选择性催化还原烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下: ①4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) ΔH1=a kJ·mol-1 ②4NH3(g)+2NO2(g)+O2(g)3N2(g)+6H2O(g) ΔH2=b kJ·mol-1 副反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH3=c kJ·mol-1 可以计算出反应2NO(g)+O2(g)2NO2(g)的ΔH为( ) A. kJ·mol-1 B. kJ·mol-1 C. kJ·mol-1 D. kJ·mol-1 解析:选D。①4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) ΔH1=a kJ·mol-1,②4NH3(g)+2NO2(g)+O2(g)3N2(g)+6H2O(g) ΔH2=b kJ·mol-1,③4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH3=c kJ·mol-1,根据盖斯定律,由①×-②+③×即得反应:2NO(g)+O2(g)2NO2(g) ΔH=a kJ·mol-1×-b kJ·mol-1+c kJ·mol-1×= kJ·mol-1,故选D。 二、不定项选择题 7.一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( ) A.e是ClO B.b→a+c反应的活化能为60 kJ·mol-1 C.a、b、c、d、e中c最稳定 D.b→a+d反应的热化学方程式为3ClO-(aq)===2Cl-(aq)+ClO(aq) ΔH=-116 kJ·mol-1 解析:选D。A项,e中Cl元素化合价为+7价,而ClO中Cl元素化合价为+5价, 错误;B项,根据图中数据无法计算b→a+c反应的活化能,错误;C项,a、b、c、d、e中a能量最低,所以最稳定,错误;D项,b→a+d,根据转移电子守恒得该反应方程式为3ClO-===2Cl-+ClO,反应热=2×0 kJ·mol-1+64 kJ·mol-1-3×60 kJ·mol-1=-116 kJ·mol-1,所以该热化学方程式为3ClO-(aq)===2Cl-(aq)+ClO(aq) ΔH=-116 kJ·mol-1,正确。 8.下列叙述正确的是( ) A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 B.稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ C.C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ·mol-1,则说明石墨比金刚石稳定 D.反应2CO(g)+2NO(g)===N2(g)+2CO2(g)在298 K时能自发进行,则它的ΔH>0,ΔS>0 解析:选BC。A项,等物质的量时硫蒸气的能量高,完全燃烧时放出热量多,错误;B项,浓硫酸稀释时放出热量,正确;C项,石墨能量低,更稳定,正确;D项,该反应是熵减的反应,能自发进行,说明反应放热,错误。 9.(2017·高考江苏卷)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( ) ①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1 ②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1 ③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1 ④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1 A.反应①②为反应③提供原料气 B.反应③也是CO2资源化利用的方法之一 C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1 D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1 解析:选C。反应①的产物为CO和H2,反应②的产物为CO2和H2,反应③的原料为CO2和H2,A项正确;反应③将温室气体CO2转化为燃料CH3OH,B项正确;反应④中生成物H2O为气体,C项中生成物H2O为液体,故C项中反应的焓变不等于 kJ·mol-1,C项错误;依据盖斯定律,由②×2+③×2+④,可得所求反应的焓变,D项正确。 三、非选择题 10.(1)化学反应中放出的热能与反应物和生成物在断键和成键过程中吸收和放出能量的大小有关。 已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl 键放出的能量为________。 (2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知: ①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 ②C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧放出588.05 kJ的热量,原混合气体中氢气的质量是________。根据以上三个热化学方程式,计算C(石墨,s)+2H2(g)===CH4(g)的反应热ΔH为________。 解析:(1)H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,该反应的ΔH=旧键断裂吸收的能量-新键形成放出的能量,设形成1 mol H—Cl键放出的能量为x kJ,则ΔH=436 kJ·mol-1+247 kJ·mol-1-2x kJ·mol-1=-185 kJ·mol-1,解得x=434,所以形成1 mol H—Cl键放出434 kJ的能量。 (2)设混合气体中CH4的物质的量为a,H2的物质的量为b,a+b=1 mol,890.3 kJ·mol-1×a+571.6 kJ·mol-1×b/2=588.05 kJ,解得a=0.5 mol,b=0.5 mol,所以H2的质量为0.5 mol×2 g·mol-1=1.0 g。 反应C(石墨,s)+2H2(g)===CH4(g)由反应②+③-①得,即该反应的反应热ΔH=(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)-(-890.3 kJ·mol-1)=-74.8 kJ·mol-1。 答案:(1)434 kJ (2)1.0 g -74.8 kJ·mol-1 11.化学反应过程中一定伴随着能量变化,某同学通过如下实验进行探究。 Ⅰ.探究化学反应中的能量变化。通过如图实验测出烧杯中的温度降低。 (1)Ba(OH)2·8H2O与NH4Cl反应的化学方程式: ________________________________________________________________________。 (2)从反应热的角度分析,该反应属于________(填“吸热”或“放热”)反应;从氧化还原角度分析,该反应属于________(填“氧化还原”或“非氧化还原”) 反应;从基本反应类型角度分析,该反应属于________反应。 Ⅱ.测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。 (1)图中尚缺少的一种仪器是________。 (2)实验时环形玻璃搅拌棒的运动方向是________。 a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动 (3)写出该反应的热化学方程式:__________________________ (中和热ΔH=-57.3 kJ·mol-1)。 (4)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L-1 30 mL硫酸进行实验,通过多次实验测定中和热ΔH=-53.5 kJ·mol-1,与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________________________________ (填字母)。 a.实验装置保温、隔热效果差 b.用量筒量取NaOH溶液的体积时仰视读数 c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度 解析:Ⅱ.(4)实验测定中和热ΔH=-53.5 kJ·mol-1与-57.3 kJ·mol-1有偏差,是因为实验过程中热量有散失。此实验中硫酸过量,用量筒量取NaOH溶液的体积时仰视读数使NaOH的量偏多,所测中和热数值应偏大。 答案:Ⅰ.(1)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3·H2O+8H2O (2)吸热 非氧化还原 复分解 Ⅱ.(1)温度计 (2)a (3)NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1[或2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1] (4)b 12.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。 (1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1 P(红磷,s)+O2(g)===P4O10(s) ΔH2=-738.5 kJ·mol-1 则该温度下白磷转化为红磷的热化学方程式为_____________________________ ________________________________________________________________________。 (2)已知298 K时白磷不完全燃烧的热化学方程式为P4(白磷,s)+3O2(g)===P4O6(s) ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。 (3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。则反应P4(白磷,s)+6Cl2(g)===4PCl3(s)的反应热ΔH=________。 解析:(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(白磷,s)===4P(红磷,s) ΔH=(-2 983.2 kJ·mol-1)-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。(2)n(白磷)==0.5 mol,n(O2)==2.25 mol,设得到的P4O10与P4O6的物质的量分别为 x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 mol+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。(3)根据图示可知,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1 326 kJ·mol-1。 答案:(1)P4(白磷,s)===4P(红磷,s) ΔH=-29.2 kJ·mol-1 (2)3∶1 1 323.45 kJ (3)-1 326 kJ·mol-1查看更多