- 2021-08-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省周口中英文学校高一下学期期末考试化学试题
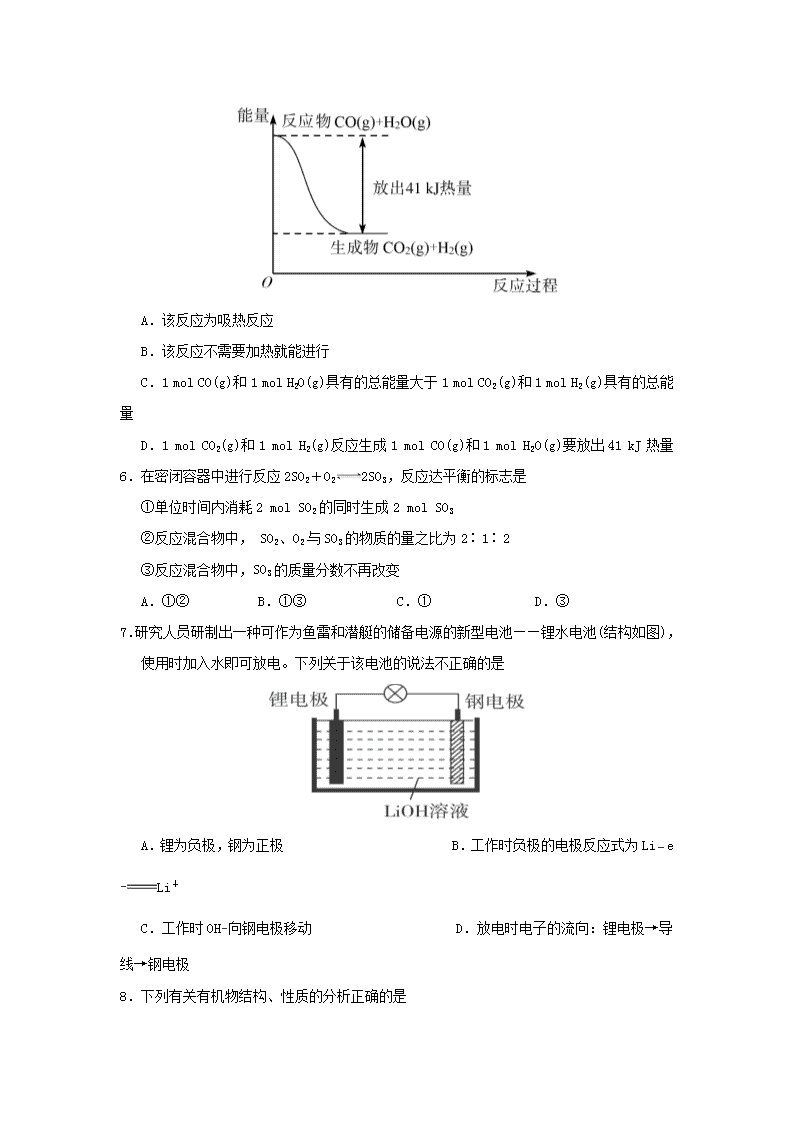
2018-2019学年河南省周口中英文学校高一下学期期末考试化学试题 (考试时间:90分钟 试卷满分:100分) 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Fe-56 Cu-64 第Ⅰ卷(选择题 共48分) 一、选择题:本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.“绿色化学”的核心是实现污染物“零排放”。下列最符合“绿色化学”理念的是 A.在厂区大量植树绿化,净化污染的空气 B.利用太阳能分解水制氢气 C.将煤液化后使用以提高煤的利用率 D.将化石燃料充分燃烧后再排放 2.下列反应,不能用于设计原电池的是 A.Pd+PdO2+2H2SO42PdSO4 +2H2O B.2A1+3I22AlI3 C.Mg(OH)2+ H2SO4MgSO4 +2H2O D.O2+ 2H22H2O 3.化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是 A.CaF2的电子式: B.Cl−的结构示意图: C.CO2的结构式:O=C=O D.中子数为20的氯原子:1737Cl 4.下列各组物质中化学键的类型相同的 A.HCl、MgCl2、NH4Cl B.NH3、H2O、CO2 C.CO、Na2O、CS2 D. CaCl2、NaOH、N2O 5.CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是 A.该反应为吸热反应 B.该反应不需要加热就能进行 C.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量 D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 6.在密闭容器中进行反应2SO2+O22SO3,反应达平衡的标志是 ①单位时间内消耗2 mol SO2的同时生成2 mol SO3 ②反应混合物中, SO2、O2与SO3的物质的量之比为2∶1∶2 ③反应混合物中,SO3的质量分数不再改变 A.①② B.①③ C.① D.③ 7.研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是 A.锂为负极,钢为正极 B.工作时负极的电极反应式为Li−e−Li+ C.工作时OH−向钢电极移动 D.放电时电子的流向:锂电极→导线→钢电极 8.下列有关有机物结构、性质的分析正确的是 A.苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色 B.乙烯和苯都能与 H2发生加成反应,说明二者均含有碳碳双键 C.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 D.乙醇在铜催化作用下,能发生还原反应生成乙醛 9.下列反应属于加成反应的是 A.乙烯使溴水褪色 B.甲烷与氯气在光照条件下的反应 C.苯和液溴在铁作催化剂的条件下反应 D.乙酸和乙醇反应生成乙酸乙酯 10.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述错误的是 A.植物油能使溴的四氯化碳溶液褪色 B.淀粉水解的最终产物是葡萄糖 C.葡萄糖能发生水解和氧化反应 D.利用油脂在碱性条件下的水解,可以生产甘油和肥皂 11.在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2(g)+SO2(g)NO(g)+ SO3(g),平衡时,下列叙述正确的是 ①NO和SO3的物质的量一定相等 ②NO2和SO2的物质的量一定相等 ③体系中的总物质的量一定等于反应开始时总物质的量 ④SO2、NO2、NO、SO3的物质的量一定相等 A.①和② B.②和③ C.①和③ D.③和④ 12.下列有关自然资源的开发利用的叙述正确的是 A.通过催化重整,可从石油中获取环状烃 B.金属铝的冶炼可采取电解熔融氯化铝的方法 C.石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化 D.煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得 13.海水提镁的主要流程如下,下列说法正确的是 ①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应 ③操作b只是过滤 ④ 用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2 ⑤采用电解法冶炼镁是因为镁很活泼 A.①②③④⑤ B.②③ C.④⑤ D.①④⑤ 14.工业上合成丁苯橡胶的反应如下(反应条件已略去): 。 下列有关说法错误的是 A.丁苯橡胶的两种单体都属于烃 B.丁苯橡胶不能使溴水褪色 C.上述反应的原子利用率为100% D.丁苯橡胶属于高分子化合物 15.一定条件下进行反应:COCl2(g)Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表: t/s 0 2 4 6 8 n(Cl2)/mol 0 0.30 0.39 0.40 0.40 下列说法不正确的是 A.生成Cl2的平均反应速率,0~2s比2~4s快 B.0~2s COCl2的平均分解速率为0.15mol·L−1·s−1 C.6s时,反应达到最大限度 D.该条件下,COCl2的最大转化率为40% 16.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述不正确的是 A.X元素可以与W元素形成XW2和XW3两种化合物 B.Y元素的单质一定条件下可以与O2、N2、CO2反应 C.Z原子的最外层电子数为4,形成化合物时一般为+4价 D.X与Y、Z与W都属于同一周期 第II卷(非选择题 共52分) 二、非选择题:包括第17题~第20题4个大题,共52分。 17.(6分)有下列物质的转化或分离方法: A.溶解 B.裂解 C.分馏 D.裂化 E.干馏 F.蒸馏 G.电解 H.过滤 I.萃取 请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。 (1)把煤转化为焦炉气、煤焦油和焦炭等:_____________。 (2)从原油中分离出汽油、煤油、柴油等:_____________。 (3)将海水淡化:_____________。 (4)除去粗盐溶液中的泥沙:_____________。 (5)从海水得到的无水MgCl2中提取金属镁:_____________。 (6)从海水提溴获得的溴水中提取溴单质:_____________。 18.(9分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。 请回答下列问题: (1)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。写出装置Ⅱ中生成有机物的化学方程式_______________,装置Ⅲ中小试管内苯的作用是_____________。 (2)能说明苯与液溴发生了取代反应的现象是_____________________。 (3)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法:__________。 (4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。 ①用蒸馏水洗涤、振荡、分液;②用5%的NaOH溶液洗涤、振荡、分液;③用蒸馏水洗涤、振荡、分液;④加入无水CaCl2粉末干燥;⑤_______________(填操作名称)。 19.(13分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题: (1)B在元素周期表中的位置为______________________。 (2)E的氧化物对应的水化物有_________________(写化学式)。 (3)B、C、D、E形成的简单离子半径由大到小的关系是________________(用离子符号表示)。 (4)化合物D2C的形成过程为_____________(用电子式表示)。 (5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。 (6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。 20.(12分)电池在我们的生活中有着重要的应用,请回答下列问题: (1)为了验证Fe2+与Cu2+氧化性强弱,图1装置中能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05 mol电子时,两个电极的质量差为________。 图1 图2 (2)将CH4设计成燃料电池,其利用率更高,装置如图2所示(A、B为多孔碳棒)。 实验测得OH−定问移向B 电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。 21.(12分)Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题: 序号 硫酸的体积/mL 锌的质量/g 锌的形状 温度/℃ 完全溶于酸的时间/s 生成硫酸锌的质量/g 1 50. 0 2.0 薄片 25 100 m1 2 50.0 2.0 颗粒 25 70 m2 3 50.0 2.0 颗粒 35 35 m3 4 50.0 2.0 粉末 25 45 5.0 5 50.0 6.0 粉末 35 30 m5 6 50.0 8.0 粉末 25 t6 16.1 7 50.0 10.0 粉末 25 t7 16.1 (1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。 (2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。 (3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。 (4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。 Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题: (5)反应开始至2 min,Y的平均反应速率为______________________。 (6)分析有关数据,写出X、Y、Z的反应方程式_________________。 高一 化学 · 参考答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 B C C B D D C A A C C A D B B D 17.(11 分,除标明外,每空 1 分) Ⅰ.(1)K Cl S (2)S (2 分) Ⅱ.(1)第二周期第ⅥA 族 18.(8 分,除标明外,每空 1 分) (1)否 (2)①铜 ②铜 银 ③0.05NA (或 3.01×1022 ) (2 分) 19.(9 分,除标明外,每空 1 分) (1)羟基 CH3CH2OH (2)加成 (3)A、E 20.(13 分,除标明外,每空 1 分) (4)干燥 (5)苯 C (6)DEF 21.(11 分,除标明外,每空 1 分) (1)锌完全消失所需的时间 5 (2)固体反应物的表面积 (是否形成)原电池 (3)①AB 反应放热,使温度升高,反应速率加快 查看更多