- 2021-07-09 发布 |
- 37.5 KB |
- 24页

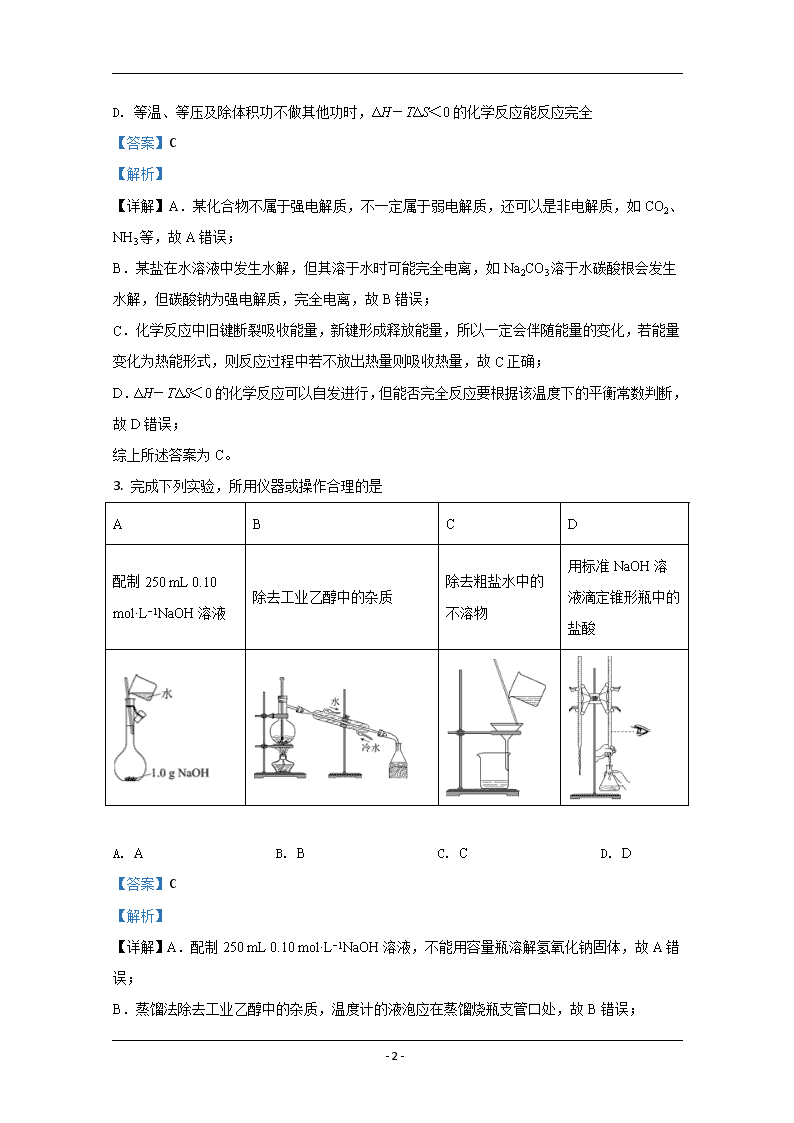

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省日照市2021届高三上学期第二次联合考试化学试卷 Word版含解析
- 1 - 2020~2021 学年度高三第二次校际联合考试 化学试题 1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形 码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。 2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使 用 0.5 毫米黑色签字笔书写,字体工整、笔迹清楚。 3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草 稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 S 32 Ca 40 Fe 56 Sr 87.6 Pd 106 一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合 题意。 1. 下列说法合理的是 A. NaOH 能促进油脂水解,可用含 NaOH 的洗涤剂去除人体皮肤表面的油性物质 B. 新冠肺炎抗疫中使用的干雾过氧化氢空气消毒机,利用了过氧化氢的氧化性 C. 工业生产中常把原料粉碎成小颗粒,可以提高原料的平衡转化率 D. 增大氮肥、磷肥、钾肥使用量,不会改变生态平衡且能提高农作物产量 【答案】B 【解析】 【详解】A.NaOH 有强腐蚀性,不能用于人体皮肤表面,故 A 错误; B.过氧化氢具有强氧化性,能使蛋白质变性,可用于杀菌消毒,所以干雾过氧化氢空气消毒 机在新冠抗疫中被广泛使用,故 B 正确; C.原料粉碎成小颗粒,只能加快反应速率,不能提高原料的平衡转化率,故 C 错误; D.大量使用氮肥、磷肥、钾肥,会影响生态平衡,需要合理使用,故 D 错误。 答案选 B。 2. 下列说法正确的是 A. 某化合物不属于强电解质,则一定属于弱电解质 B. 某盐在水溶液中发生水解,则其溶于水时不能完全电离 C. 某化学反应的能量变化为热能形式,反应过程中若不放出热量则吸收热量 - 2 - D. 等温、等压及除体积功不做其他功时,ΔH-TΔS<0 的化学反应能反应完全 【答案】C 【解析】 【详解】A.某化合物不属于强电解质,不一定属于弱电解质,还可以是非电解质,如 CO2、 NH3 等,故 A 错误; B.某盐在水溶液中发生水解,但其溶于水时可能完全电离,如 Na2CO3 溶于水碳酸根会发生 水解,但碳酸钠为强电解质,完全电离,故 B 错误; C.化学反应中旧键断裂吸收能量,新键形成释放能量,所以一定会伴随能量的变化,若能量 变化为热能形式,则反应过程中若不放出热量则吸收热量,故 C 正确; D.ΔH-TΔS<0 的化学反应可以自发进行,但能否完全反应要根据该温度下的平衡常数判断, 故 D 错误; 综上所述答案为 C。 3. 完成下列实验,所用仪器或操作合理的是 A B C D 配制 250 mL 0.10 mol·L−1NaOH 溶液 除去工业乙醇中的杂质 除去粗盐水中的 不溶物 用标准 NaOH 溶液 滴定锥形瓶中的盐 酸 A. A B. B C. C D. D 【答案】C 【解析】 【详解】A.配制 250 mL 0.10 mol·L−1NaOH 溶液,不能用容量瓶溶解氢氧化钠固体,故 A 错 误; B.蒸馏法除去工业乙醇中的杂质,温度计的液泡应在蒸馏烧瓶支管口处,故 B 错误; - 3 - C.过滤法除去粗盐水中的不溶物,故 C 正确; D.用标准 NaOH 溶液滴定锥形瓶中的盐酸,标准 NaOH 溶液应盛在碱式滴定管中,滴定时, 眼睛应该注视锥形瓶内颜色变变化,故 D 错误; 选 C。 4. NA 为阿伏加德罗常数的值。下列说法错误的是 A. 含 7.8gNa2S 的溶液中所含阴离子的总数大于 0.1NA B. 标准状况下,5.6L 甲烷和乙烯的混合气体中所含碳氢键数目为 NA C. 镁与一定量浓硫酸反应,产生标准状况下气体 2.24L,转移电子数目为 0.2NA D. 向 100mL1mol·L-1 稀盐酸中逐滴加入含 0.1molNa2CO3 的溶液,则混和液中: N(CO 2- 3 ) +N(HCO - 3 )+N(H2CO3)=0.1NA 【答案】D 【解析】 【详解】A.S2-在溶液中会水解,导致阴离子个数增多,故溶液中阴离子个数多于 0.1NA 个, 故 A 正确; B.1 个甲烷分子、1 个乙烯分子都含有 4 个 C-H 键,标准状况下,5.6L 甲烷和乙烯的混合气 体中所含碳氢键数为 5.6 422.4 / mol A L NL = NA,故 B 正确; C.镁与一定量的浓硫酸反应,产生的气体为氢气和二氧化硫的混合气体,标准状况下 2.24L 气体的物质的量为 0.1mol,生成 0.1mol 二氧化硫和氢气的混合气体,转移了 0.2mol 电子,转 移的电子数为 0.2NA,故 C 正确; D.向 100mL1mol•L-1 稀盐酸中逐滴加入含 0.1mol Na2CO3 的溶液,部分碳酸根离子与氢离子 反应生成二氧化碳,所以向 100mL1mol•L-1 稀盐酸中逐滴加入含 0.1mol Na2CO3 的溶液,则混 和液中:N(CO32-)+N(HCO3-)+N(H2CO3)<0.1NA,故 D 错误。 答案选 D。 5. 下列离子方程式或化学方程式正确的是 A. Na2S2O3 溶液中加入稀硫酸:2S2O 2- 3 +2H+=SO 2- 4 +3S↓+H2O B. TiC14 水解制备 TiO2·xH2O:TiCl4+(x+2)H2O =TiO2·xH2O↓+4HC1 C. CuCl2 溶液中通入少量 H2S:Cu2++S2-=CuS↓ D. 磁性氧化铁溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O - 4 - 【答案】B 【解析】 【详解】A.Na2S2O3 溶液中加入稀硫酸发生歧化反应生成 SO2 和 S,离子方程式为 S2O 2- 3 +2H+═SO2↑+S↓+H2O,故 A 错误; B.用 TiCl4 制备 TiO2 的反应,为水解反应,可表示为:TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl, 故 B 正确; C.H2S 为弱酸,正确的离子方程式为:Cu2++H2S=CuS↓+2H+,故 C 错误; D.Fe3+会把 I-氧化,正确离子方程式为:Fe3O4+2I-+8H+=3Fe2++I2+4H2O,故 D 错误; 综上所述答案为 B。 6. X、Y、Z、M、W 为五种原子序数递增的前 20 号元素。X、Y 是同周期元素,原子序数相 差 2,族序数之和为 10;Z 原子最外层电子数等于其最内层电子数,M 在地壳中含量居第二 位;W 的某种盐常用作加碘盐的碘制剂。下列说法错误的是 A. 原子半径:W>Z>M>X>Y B. 最高价氧化物对应的水化物的酸性:X>M C. ZXY3 含离子键和共价键,0.1molW2Y2 含有 0.4mol 离子 D. Z 与 XY2 反应可置换出 X 单质,X 与 MY2 反应可置换出 M 单质 【答案】C 【解析】 【分析】 M 在地壳中含量居第二位,则 M 为 Si 元素;X、Y 是同周期元素,原子序数相差 2,族序数 之和为 10,则分别为第ⅣA 族、ⅥA 族元素,且原子序数小于 Si 元素,所以 X 为 C 元素,Y 为 O 元素;Z 原子最外层电子数等于其最内层电子数,且原子序数大于 O,则 Z 为 Mg 元素; W 的某种盐常用作加碘盐的碘制剂,则 W 为 K 元素。 【详解】A.核外电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以原 子半径 K>Mg>Si>C>O,即 W>Z>M>X>Y,故 A 正确; B.非金属性 C>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故 B 正确; C.K2O2 由 K+和 O 2- 2 构成,所以 0.1molK2O2 含有 0.3mol 离子,故 C 错误; D.Mg 可以和 CO2 反应生成 C 单质和 MgO,C 可以和 SiO2 反应生成 Si 单质和 CO,故 D 正 确; - 5 - 综上所述答案为 C。 7. 绿矾(FeSO4·7H2O)试剂含量的国家标准如表 1 所示。称取四份质量均为 1.012g 某绿矾试 剂样品,分别溶于水配制成 20.00mL 溶液,编号为①、②、③、④。分别用 0.04056 mol∙L−1 的 KMnO4 标准液滴定,滴定数据记录如表 2。 表 1 等级 Ⅰ级品 Ⅱ级品 Ⅲ级品 FeSO4·7H2O 含量 99.50%~100.5% 99.00%~100.5% 98.00%~101.0% 表 2 样品编号 ① ② ③ ④ KMnO4 标准液体积/mL 17.66 17.68 18.26 17.70 下列说法错误的是 A. 盛装 KMnO4 标准液的酸式滴定管使用前需先检查滴定管是否漏水 B. 滴入最后一滴标准液时,锥形瓶中液体变浅红色且半分钟不褪色,则达到滴定终点 C. 根据滴定数据分析,该样品属于国家标准的Ⅱ级品 D. 若绿矾样品已失部分结晶水,可能会导致测定结果偏高 【答案】C 【解析】 【详解】A.滴定管使用前需先检查滴定管是否漏水,再洗涤,再润洗,故 A 正确; B.达到滴定终点判断是当滴入最后一滴标准液时,锥形瓶中液体变浅红色且半分钟不褪色, 故 B 正确; C.根据滴定数据分析,第三次数据是错误数据,另外三次平均数值为 17.68mL,根据关系式 5FeSO4~KMnO4, 1 1mol L 278g m5 0.04056 olω= 0.01768L 1.012 100% 98.g 49% ,该 样品属于国家标准的Ⅲ级品,故 C 错误; D.若绿矾样品已失部分结晶水,称量等质量,则硫酸亚铁增加,消耗的高锰酸钾体积增多, 会导致测定结果偏高,故 D 正确。 综上所述,答案为 C。 8. 北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察, - 6 - 二维冰层的 AFM 表征细节(图 1)及其结构模型(图 2)如下,该成果发表在 2020 年 1 月的《Nature》 上。下列说法正确的是 A. 气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物 B. 固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱 C. 由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解 D. 受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑 【答案】D 【解析】 【详解】A.气相水分子、“准液体”水分子和固态水分子为 H2O 的不同存在形式,为同一种物 质,故 A 错误; B.水分子之间存在范德华力和氢键,不存在化学键,故 B 错误; C.氢键决定水的熔沸点,水分子的稳定性与氢键无关,水分子稳定是因为分子内 O-H 键的键 能较大,故 C 错误; D.受到能量激发时,“准液体”的水分子与下层固态水分子连接的氢键断裂,产生“流动性的 水分子”,使冰面变滑,故 D 正确; 综上所述答案为 D。 9. 我国研发的高效低压电催化还原 CO2 法,居世界领先水平。装置工作原理如图所示,工作 时总反应为:NaCl+CO2 通电 CO+NaClO。a、b 均为涂装催化剂的惰性电极。下列说法错误的 是 A. 该装置工作时电能转化为化学能 B. 该装置工作时 b 极反应为: CO2+2e-+2H+=CO+H2O - 7 - C. 若用铅蓄电池做电源,Y 极反应为: Pb+ 2 4SO -2e-=PbSO4 D. 该装置消耗 0.1molC1-时,有 0.1mol H+通过质子交换膜 【答案】D 【解析】 【详解】A.该装置为电解装置,能使电能转化为化学能,故 A 正确; B.电解池中阳离子向阴极移动,由题中图示 H+移动方向可判断 b 极为阴极,阴极区 CO2 得 电子变为 CO,发生还原反应,其电极反应为 CO2+2e-+2H+=CO+H2O,故 B 正确; C.若用铅蓄电池做电源,由于 b 为阴极,接电源的负极,即 Y 为负极,Pb 失电子,发生氧 化反应,其电极反应为 Pb+ 2 4SO -2e-=PbSO4,故 C 正确; D.a 为阳极,阳极区 Cl-失电子,发生氧化反应,其电极反应为 Cl--2e-+H2O=ClO-+2H+,则消 耗 0.1molC1-时,有 0.2mol H+通过质子交换膜,故 D 错误; 答案为 D。 10. 常温下,向 V2mL 0.1mol·L-1 的一元弱酸 HA 溶液中逐滴加入 V1mL0.1mol·L-1 的 NaOH 溶 液,溶液 pH 随 1 2 V V 的变化如图所示。下列说法错误的是 A. 常温时,HA 的电离常数约为 10-(2x-1) B. a 点和 c 点时,HA 的中和百分率分别为 50%、100% C. 由 b 点到 d 点,溶液中水的电离程度逐渐减小 D. a、b、c、d 四点溶液均存在:c(Na+)-c(A-)=c(OH-)-c(H+) 【答案】C 【解析】 【分析】 已知一元酸与 NaOH 的浓度相等,其体积比为 1:1 时,恰好生成盐,盐溶液呈碱性,可判断 一元酸为弱酸,x 的值大于 1。 - 8 - 【详解】A.常温时,HA 的电离常数 K= c H c A c HA = 10 10 0.1 x x 约为 10-(2x-1),A 说法 正确; B.a 点时,HA 与 NaOH 的物质的量比为 2:1,则中和百分率为 50%,c 点时,HA 与 NaOH 的物质的量比为 1:1,则 HA 的中和百分率为 100%,B 说法正确; C.b 点时,酸过量,抑制水的电离,c 点恰好生成强碱弱酸盐,促进水的电离,d 点碱过量, 抑制水的电离,故由 b 点到 d 点,溶液中水的电离程度先增大,后减小,C 说法错误; D.a、b、c、d 四点溶液中溶液呈电中性,则 c(Na+)+c(H+)=c(OH-)+c(A-),变形为 c(Na+)-c(A-)=c(OH-)-c(H+),D 说法正确; 答案为 C。 二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题只有一个或两个选项 符合题意,全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。 11. 实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12 溶液遇 CO 能产生黑色的 Pd),下列说法错误的是 A. 装置①的仪器还可以制取 H2、NH3 等气体 B. 装置⑤中石灰水变浑浊后,再点燃酒精灯 C. 装置②③中分别盛装饱和 Na2CO3 溶液、浓 H2SO4 D. 装置⑥中有黑色沉淀,发生的反应是 PdC12+CO+H2O=Pd↓+CO2+2HC1 【答案】C 【解析】 【详解】固体和液体不加热反应制备气体,锌和稀硫酸反应制氢气,氧化钙和浓氨水反应制 备氨气都可以用装置①,A 正确;金属钠与空气中的氧气、水蒸气等发生反应,因此实验之前, 用二氧化碳气体排出装置内的空气,当看到装置⑤中石灰水变浑浊后,空气已排净,再点燃 酒精灯,B 正确;反应产生的二氧化碳气体含有氯化氢和水蒸气,因此先用饱和碳酸氢钠溶液 除去氯化氢,(因为碳酸钠溶液与二氧化碳反应),再用浓 H2SO4 吸收水蒸气,C 错误;根据题 给信息可知,PdC12 被 CO 还原为黑色的 Pd,反应 PdC12+CO+H2O=Pd↓+CO2+2HC1,D 正确; - 9 - 正确选项 C。 【点睛】碳酸钠与盐酸反应制备二氧化碳气体,会含有杂质气体氯化氢和水蒸气,要得到纯 净的二氧化碳气体,混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸,不能用饱和碳酸钠 溶液除氯化氢,因为碳酸钠与二氧化碳反应生成碳酸氢钠。 12. 焦亚硫酸钠(Na2S2O5)为具有强还原性的白色细小结晶状固体,常用作食品抗氧化剂。 生产 Na2S2O5,通常是由 NaHSO3 过饱和溶液经结晶、脱水制得,基本流程如下图所示。 下列说法错误的是 A. 工业制备 Na2S2O5 的原理为非氧化还原反应 B. 流程中溶液 1 溶质的成分为 NaHSO3 C. 加入 Na2CO3 固体、并再次通入 SO2 的目的是得到 NaHSO3 过饱和溶液 D. 抗氧化时,1mol Na2S2O5 可以消除 2mol O2 【答案】BD 【解析】 【分析】 由 流 程 可 知 在 饱 和 碳 酸 钠 溶 液 中 通 入 二 氧 化 硫 , 控 制 pH=4.1 , 发 生 Na2CO3+2SO2+H2O=2NaHSO3+CO2,然后加入碳酸钠固体,调节 pH=7-8,可生成亚硫酸钠, 继续通入二氧化硫调节 pH=4.1,可生成过饱和的 NaHSO3,同时生成二氧化碳气体,结晶脱 水生成 Na2S2O5 固体。 【详解】A. 由分析可知,工业制备 Na2S2O5 过程中没有化合价变化,工业制备 Na2S2O5 的原 理为非氧化还原反应,故 A 正确; B. 加入碳酸钠固体,调节 pH=7-8,可生成亚硫酸钠,流程中溶液 1 溶质的成分为 Na2SO3, 故 B 错误; C. 加入 Na2CO3 固体、并再次通入 SO2,考虑到后续操作步骤是结晶脱水制取 Na2S2O5,发生 这一步需要过饱和的 NaHSO3 溶液,由此判断,再通入 SO2 的目的应为:增大 NaHSO3 浓度, 得到 NaHSO3 过饱和溶液,故 C 正确; D. Na2S2O5 中 S 的化合价为+4,抗氧化时,1mol Na2S2O5 可以消除 1mol O2,故 D 错误; - 10 - 故选 BD。 13. 下图为 Ca-LiFePO4 可充电电池的工作示意图,锂离子导体膜只允许 Li+通过,电池反应为: 2+ + 4 1-x 4xCa +2LiFePO xCa+2Li FePO +2xLi 放电 充电 。下列说法错误的是 A. LiPF6-LiAsF6 为非水电解质,主要作用都是传递离子,构成闭合回路 B. 充电时,Li1-xFePO4/LiFePO4 电极发生 Li+嵌入,放电时发生 Li+脱嵌 C. 放电时,负极反应为:LiFePO4-xe-=Li1-xFePO4+xLi+ D. 充电时,当转移 0.2mol 电子时,左室中电解质的质量减轻 2.6g 【答案】BC 【解析】 【分析】 根据电池反应可知,放电时 Ca 转化为 Ca2+发生氧化反应,所以钙电极为负极,充电时则发生 还原反应为阴极,则放电时 Li1-xFePO4/LiFePO4 为正极,充电时为阳极。 【详解】A.钙活泼性很强,会和水发生反应,所以选用非水电解质来传递离子,构成闭合回 路,形成原电池,故 A 正确; B.充电时为电解池,电解池中阳离子流向阴极,Li1-xFePO4/LiFePO4 为阳极,所以 Li1- xFePO4/LiFePO4 电极发生 Li+脱嵌然后流向阴极,放电时为原电池,原电池中阳离子流向正极, 所以放电时发生 Li+嵌入,故 B 错误; C.放电时,钙电极为负极,电极反应为 Ca-2e-=Ca2+,故 C 错误; D.充电时每转移 0.2mol 电子,左室中就有 0.1molCa2+转化为 Ca,同时有 0.2mol 迁移到左室, 所以左室中电解质的质量减轻 0.1mol 40g/mol-0.2mol 7g/mol=2.6g,故 D 正确; 综上所述答案为 BC。 14. 在 400℃和 550℃条件下,向两个体积恒定的容器中分别充入 2mol N2O 和 2mol CO,发生 反应:N2O(g)+CO(g) N2(g)+CO2(g)。实验测得两容器中 CO 与 N2 的物质的量随时间变 - 11 - 化关系如图所示,曲线Ⅰ平衡后的总压强为 P1kPa,曲线Ⅱ平衡后总压强为 P2kPa。下列说法 正确的是 A. 曲线Ⅱ为 550℃条件下的变化曲线 B. a、c、d 三点的逆反应速率:a>d>c C. ad 段 N2O 的平均速率为 0.015 P1kPa·min-1 D. 曲线Ⅱ代表的温度下,该反应的 KP 为 9 4 【答案】AC 【解析】 【详解】A.由题干图像可知,曲线Ⅱ所用的时间较少,故反应速率快,对应的温度更高,故 曲线Ⅱ为 550℃条件下的变化曲线,A 正确; B.由于曲线Ⅱ的温度高于曲线 I,故反应速率 c 点最快,a、d 温度相同,曲线 I 表示 CO 的 变化,即正反应,故 a 点到 d 点过程中逆反应速率逐渐增大,故 a、c、d 三点的逆反应速率: c>d>a,B 错误; C.曲线 I 表示的是 CO 的变化过程,根据图像可知,平衡时 CO 为 0.8mol,故有: 2 2 2( ) ( ) ( ) ( ) (mol) 2 2 0 0 (mol) 1.2 1.2 1.2 1.2 (mol) 0.8 0.8 1.2 1. N O g +CO g N g +CO g 2 起始量 转化量 平衡量 ,P1=(0.8+0.8+1.2+1.2) RT V ,故 RT V = 1 4 P1,ad 段 N2O 的物质的量变化了:1.4-0.8=0.6mol,故压强变化了 0.6 RT V =0.15P1,故 平均速率为 10.15( ) 10min PPP t =0.015 P1kPa·min-1,C 正确; D.曲线Ⅱ代表该温度下 N2 的变化情况,由图像可知,平衡时 N2 的物质的量为 1mol,故有: 2 2 2( ) ( ) ( ) ( ) (mol) 2 2 0 0 (mol) N O g +CO g N 1 1 g 1 1 (mol) 1 1 1 1 +CO g 起始量 转化量 平衡量 ,故有平衡时 N2O、CO、N2、CO2 - 12 - 四种气体的平衡分压相等均为 0.25P2,故曲线Ⅱ代表的温度下,该反应的 KP= 2 2 2 P(N )P(CO ) P(N O)P(CO) =1,D 错误; 故答案为:AC。 15. T K 时,现有 25mL 含 KC1 和 KCN 的溶液,用 0.1000mol·L-1 的硝酸银标准溶液对该混合 液进行电位滴定(CN-与 H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V) 的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。已知: Ⅰ、Ag+与 CN-反应过程为:①Ag++2CN-=[Ag(CN)2]- ②[Ag(CN)2]-+Ag+=2AgCN↓。 Ⅱ、TK 时,Ksp(AgCN)=2×10-16,Ksp(AgC1)=2×10-10。 下列说法不正确的是 A. V1=5.00,B 点时生成 AgCN B. c(KCN)=0.02000mol·L-1,c(KC1)=0.03000mol·L-1 C. 反应①的平衡常数为 K1,反应②的平衡常数为 K2,则 K1+K2=2Ksp(AgCN) D. C 点时,溶液中 - 6 - (Cl ) =10(CN ) c c 【答案】C 【解析】 【分析】 AgCN 与 AgCl 的类型相同,Ksp(AgCN)=2×10-16 ≪ Ksp(AgC1)=2×10-10,故向含 KC1 和 KCN 的 溶液滴加 AgNO3 标准溶液,先生成 AgCN 沉淀,后生成 AgCl 沉淀;曲线上的转折点即为化 学计量点,结合已知 I,0~2.50mL 发生的反应为 Ag++2CN-=[Ag(CN)2]-、AB 段发生的反应为 [Ag(CN)2]-+Ag+=2AgCN↓,BC 段发生的反应为 Ag++Cl-=AgCl↓;据此分析,结合反应的方程 式和 AgCN、AgCl 的 Ksp 解答。 【详解】A.A 点加入 2.50mLAgNO3 标准溶液,根据反应 Ag++2CN-=[Ag(CN)2]-,原溶液中 n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,生成的[Ag(CN)2]-物质的量为 2.5×10-4mol, - 13 - AB 段发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,2.5×10-4mol[Ag(CN)2]-消耗 2.5×10-4molAg+转 化 成 AgCN 沉 淀 , 所 耗 标 准 AgNO3 溶 液 的 体 积 为 2.5×10-4mol÷0.1000mol·L - 1=2.5×10-3L=2.50mL,则 B 点的 V1=2.50+2.50=5.00,A 正确; B.根据 A 项计算,原溶液中 n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,c(KCN)= 5×10-4mol ÷0.025L=0.02000mol·L-1,BC 段发生的反应为 Ag++Cl-=AgCl↓,BC 段消耗的标准 AgNO3 溶液的体积为 12.50mL-5.00mL=7.50mL,则原溶液中 n(Cl-)=0.1000mol·L- 1×7.50×10-3L=7.5×10-4mol,c(KC1)= 7.5×10-4mol÷0.025L=0.03000mol·L-1,B 正确; C.①Ag++2CN-=[Ag(CN)2]-的平衡常数为 K1= - 2 + 2 - [Ag(CN) ] (Ag ) (CN ) c c c ,②[Ag(CN)2]-+Ag+=2AgCN↓ 的平衡常数为 K2= + - 2 1 (Ag ) [Ag(CN) ] c c ,Ksp(AgCN)=c(Ag+)·c(CN-),则 K1×K2= 2 sp 1 (AgCN)K ,C 错误; D.C 点,溶液中 - - (Cl ) (CN ) c c = + - + - (Ag ) (Cl ) (Ag ) (CN ) c c c c = sp sp (AgCl) (AgCN) K K = -10 -16 2 10 2 10 =106,D 正确; 答案选 C。 三、非选择题:本题共 5 小题,共 60 分。 16. 金属钯(Pd)能吸收大量氢气,是重要的储氢材料。我国科研工作者研发了利用铂钯精矿 为原料,高效、低成本提取钯黑(单质钯)的工艺,主要过程如图所示。 回答下列问题: (1)过程②中,加入草酸的过量系数和反应温度对除铜、除镍的影响如下表,本工艺中除铜、 除镍的适宜的生产条件为_______________________。 表 1 草酸过量系数与去除率 草酸过量系数 去除率% - 14 - Cu2+ Ni2+ 1.0 68.44 46.15 1.5 91.30 7766 2.0 99.83 98.86 2.5 99.53 98.46 3.0 99.48 98.53 表 2 温度与去除率 温度/℃ 去除率% Cu2+ Ni2+ 60 94.44 91.85 65 95.30 92.36 70 98.89 97.20 75 99.22 97.67 80 99.46 97.92 (2)已知:[Pd(NH3)2]Cl2、(NH4)2PdCl6、(NH4)2PdCl4 均为难溶于水的物质。 ①本工艺中,不能把过程⑤、过程⑥合并的原因为_____________。 ②过程⑦中,每生成 1mol(NH4)2PdCl6 时消耗 2molHCl,则单质 A 为_____(填化学式)。 ③在过程⑧实现“转晶”时,除生成(NH4)2PdCl4 外,还得到物质的量之比为 1:l 的无氧酸和 含氧酸,则过程⑧的化学方程式为________________。 (3)过程⑨中甲酸的氧化产物为 CO2,当得到 50g 钯黑时,需要密度为 1.22g·cm-3 的甲酸 _____mL(保留两位小数);水合肼(N2H4·H2O)常用作工业还原剂,当用 N2H4·H2O(氧化 产物为 N2)代替甲酸时,分别制备等量的钯黑,消耗的水合肼与甲酸的物质的量之比为____。 【答案】 (1). 草酸过量系数为 2.0、温度为 70°C (2). 若合并,会使[Pd(NH3)2]Cl2 中混 有含银的杂质 (3). Cl2 (4). (NH4)2PdCl6+H2O= (NH4)2PdCl4+HCl+HClO (5). 17.79 (6). 1∶2 - 15 - 【解析】 【分析】 (2)③根据流程图中(NH4)2PdCl6 和 H2O 反应生成(NH4)2PdCl4,反应物和产物的原子个 数相差 2 个 Cl、2 个 H、1 个 O 原子,即为 1:1 的无氧酸和有氧酸,为无氧酸 HCl 和含氧酸 HClO; (3)由氧化还原反应中电子得失守恒,判断甲酸中 C 的化合价为+2,CO2 为+4,失去 2mol 电子,(NH4)2PdCl4 中 Pd 化合价为+2,产物 Pd 为 0 价,得到 2mol 电子,即消耗甲酸和产生 Pd 的物质的量之比为 1:1,根据关系式列等式,即可得到消耗甲酸的质量,再根据体积=质量/ 密度公式,求算消耗的体积,此时注意单位换算:1cm3=1mL;换成水合肼做还原剂时,根据 N2H4·H2O 中 N 元素化合价为-2,产物 N2 为 0 价,转移电子为 2×2mol=4mol 电子,而甲酸转 移 2mol 电子,故得到等量的 Pd,消耗水合肼与甲酸的物质的量之比为 1:2. 【详解】(1)由表 1 数据可知,草酸过量系数为 2.0 时,铜、镍去除率最佳,考虑节能,温度 在 70℃时去除率较佳;故答案为:草酸过量系数为 2.0、温度为 70°C; (2)①已知信息[Pd(NH3)2]Cl2 是难溶物,过程⑤生成 AgCl 也是难溶物,如果过程⑤、⑥合 并,会使[Pd(NH3)2]Cl2 中混有 AgCl 的杂质;故答案为:若合并,会使[Pd(NH3)2]Cl2 中混有含 银的杂质; ②过程⑦中,1mol[Pd(NH3)2]Cl2 生成 1mol(NH4)2PdCl6 时消耗 2molHCl,根据原子守恒,反 应物差 2 个 Cl 原子,则单质 A 为 Cl2;故答案为 Cl2; ③(NH4)2PdCl6 和 H2O 反应生成(NH4)2PdCl4,产物的原子个数相差 2 个 Cl、2 个 H、1 个 O 原子,为无氧酸 HCl 和含氧酸 HClO,反应的化学方程式为:(NH4)2PdCl6+H2O= (NH4)2PdCl4+HCl+HClO; (3)HCOOH 中 C 的化合价为+2,氧化产物 CO2 中 C 为+4,失 2mol 电子,(NH4)2PdCl4 中 Pd 化合价为+2,还原产物 Pd 为 0 价,得 2mol 电子,故可得甲酸和 Pd 的关系为 HCOOH ~ Pd 46 106.4 g 50gx ,根据 3 3 46 50g 106.4V= = 17.79cm =17.79mL1.22g / cm m ;N2H4·H2O 中 N 元 素化合价为-2,氧化产物为 N2 化合价为 0,失 4mol 电子,生成等量的 Pd,则需要的水合肼与 甲酸的物质的量之比为 1:2;故答案为:17.79;1:2。 17. 含铁化合物的应用研究是科学研究的前沿之一,回答下列问题: Ⅰ、铁铝铅榴石常用作宝石和研磨材料,其化学式为 Fe3Al2Pb3(SiO4)5,可写作氧化物形式: - 16 - FexOy·Al2O3·3PbO·5SiO2。 (1)FexOy 中铁元素有+2、+3 两种价态,N(Fe3+):N(Fe2+)=______。 (2)硅属于______区元素;基态铁原子的电子排布式为_____________。 (3)氧的第一电离能_____氮(填“大于”或“小于”);工业上用γ−Al2O3 冶炼铝,其熔点很高,熔融 时需用助熔剂,γ−Al2O3 属于______晶体。 (4)SiO2 是原硅酸和硅酸的酸酐。 ①原硅酸的结构式如图 1,硅原子的价电子对的空间构型为___________。 ②原硅酸失去一分子水后形成硅酸,结构式如图 2,硅原子的杂化方式为_________。 ③SiO2 晶体结构如图 3,硅原子的配位数为_________。 Ⅱ、已知:NA 为阿伏加德罗常数的值;图Ⅰ、图Ⅱ表示的晶胞均为立方晶胞。 (5)下面晶胞化学式为 SrFeO3 的是______(填“Ⅰ”或“Ⅱ”)。 (6)图Ⅰ所示晶胞密度为 dg·cm-3,则该晶胞的边长为_____nm(用含 NA 的式子表示)。 【答案】 (1). 2∶1 (2). p (3). 1s22s22p63s23p63d64s2(或[Ar]3d64s2) (4). 小于 (5). 离子 (6). 正四面体 (7). sp2 (8). 4 (9). II (10). 73 A 175.6 10d N 【解析】 【详解】(1)根据 Fe3Al2Pb3(SiO4)5 改写作氧化物形式:Fe3O4∙Al2O3∙3PbO∙5SiO2,则 Fe3O4 中铁 元素有+2、+3 两种价态,根据化合物元素的正负化合价代数和为 0,N(Fe3+):N(Fe2+)=2∶1; 故答案为:2∶1。 (2)硅价电子排布式为 3s23p2,属于 p 区元素;铁为 26 号元素,基态铁原子的电子排布式为 1s22s22p63s23p63d64s2(或[Ar]3d64s2);故答案为:p;1s22s22p63s23p63d64s2(或[Ar]3d64s2)。 (3)同周期从左到右第一电离能呈增大趋势,但第 VA 大于第 VIA 族,第 IIA 族大于第 IIIA 族, - 17 - 因此氧的第一电离能小于氮;γ−Al2O3 是离子化合物,其熔点很高,熔融时需用助熔剂,γ−Al2O3 属于离子晶体;故答案为:小于;离子。 (4)①原硅酸的结构式如图 1,硅原子的价电子对有 4 对,无孤对电子对,因此空间构型为正四 面体形;故答案为:正四面体形。 ②原硅酸失去一分子水后形成硅酸,结构式如图 2,硅原子有 3 个σ键,无孤对电子,因此价 层电子对数为 3,其杂化方式为 sp2;故答案为:sp2。 ③SiO2 晶体结构如图 3,一个硅原子与周围四个氧原子连接,因此硅原子的配位数为 4;故答 案为:4。 (5)Ⅰ中 Fe 有1 个,O 有 14 22 ,Sr有 18 18 ,Ⅱ中 Fe 有1 个,O 有 16 32 ,Sr有 18 18 , 因此晶胞化学式为 SrFeO3 的是 II;故答案为:II。 (6)图Ⅰ所示晶胞的化学式为 SrFeO2,密度为 d g∙cm−3, 3 1 A 1175.6g mol 1mol Vdg cm N ,因此 该晶胞的边长为 73 A 175.6 10d N nm;故答案为: 73 A 175.6 10d N 。 18. 研究氮及其化合物参与的反应,对于提高含氮物质的平衡转化率和产品产率都具有重要的 意义。回答下列问题: (1)己知:Ka1(H2SO3)>Kb(NH3·H2O)>Ka2(H2SO3)。工业上用氨水吸收硫酸厂尾气中 的 SO2,恰好生成(NH4)2SO3 时,溶液显_______性(填酸、中或碱);继续吸收 SO2 恰好生 成 NH4HSO3 时,溶液显________性(填酸、中或碱)。 (2)在α-Fe(III)铁原子簇表面,以 N2 和 H2 为原料合成氨的反应机理如下: ①H2(g)=2H(g) ∆H1 ②N2(g)+2H(g) ⇌ 2(NH)(g) ∆H2 ③(NH)(g)+H(g) ⇌ (NH2)(g) ∆H3 ④(NH2)(g)+H(g) ⇌ NH3(g) ∆H4 总反应:N2(g)+3H2(g) ⇌ 2NH3(g) ∆H。则∆H4=_______(用含∆H1、∆H2、∆H3、∆H 的式子表示)。 (3)660K 在恒容容器中,2NO(g)+O2(g) ⇌ 2NO2(g)的速率方程为:v=k·cm(NO)·cn(O2),k 是该 反应在 660K 时的速率常数。NO 和 O2 的初始浓度为 c(NO)和 c(O2),反应的初始速率 v 如下表所示。 编号 c(NO)/mol·L-1 c(O2)/ mol·L-1 v/ mol·L-1·s-1 Ⅰ 0.10 0.10 0.3 - 18 - Ⅱ 0.10 0.20 0.6 Ⅲ 0.20 0.20 2.40 ①m=______,k=_____(只写数值,不写单位)。 ②第 1 组达平衡时,n(NO)+n(O2)=n(NO2),平衡常数 K=_____(保留一位小数)。 ③一定温度下,向恒容容器中充入 NO 和 O2,O2 初始的体积分数[ φ (O2)]与平衡时 NO2 的 体积分数[ φ (NO2)]关系如上图所示。φ (O2)= 1 2 时,φ (NO2)可能为_______点(填 C、 D 或 E)。 【答案】 (1). 碱 (2). 酸 (3). 1 2 3ΔH-3ΔH -ΔH -2ΔH 2 (4). 2 (5). 300 (6). 266.7 (7). E 【解析】 【详解】(1)已知 Kb(NH3·H2O)>Ka2(H2SO3),则(NH4)2SO3 为相对的强碱弱酸盐,溶液显碱性; 同理 Ka1(H2SO3)>Kb(NH3·H2O),则 NH4HSO3 为相对的强酸弱碱盐,溶液显酸性; (2)根据盖斯定律,①×3+②+③×2+④×2 可得 N2(g)+3H2(g) ⇌ 2NH3(g), ∆H=3∆H1+∆H2+2∆H3+2∆H4,则∆H4= 1 2 (∆H-3∆H1-∆H2-2∆H3); (3)①v=k·cm(NO)·cn(O2),把 II、III 中数据代入,两式相除, 0.6 2.40 = 0.10 0.20 m m ,解得 m=2,同理 把 I、II 中数据代入,两式相除,n=1,把 m=2,n=1 代入 I 中,解得 k=300; ②反应在恒温、恒容条件下进行,体积不变, 2 2( ) ( )( ) 0.1 0.1 2 2 0.1 2 0.1 2 22 x x x x x O g NO gO x N g 初始 反应 平衡 已知 n(NO)+n(O2)=n(NO2),则 0.1-2x+0.1-x=2x,解得 x=0.04mol/L,K= 2 2 0.08 0.02 0.06 =266.7; - 19 - ③已知初始投料比 n(NO):n(O2)=2:1 时,两物质的转化率最高,φ(NO2)的体积分数最大,即 φ(O2)= 1 3 ,则 B 点为φ(NO2)最大值,故φ(O2)= 1 2 ,NO 的转化率降低,φ(NO2)的体积分数减小, 答案为 E。 19. 由甲苯可以合成扁桃酸也可以合成 G( )。以下是合成线路(部分产物、 反应条件已略去): 已知: I R-CHO+HCN II R-CN + 2H O/H R-COOH III R1-CHO R1-CH= +H2O 回答下列问题: (1)B 物质中官能团的结构简式是_______;C 物质的名称为______。 (2)由 E 生成 F 的反应类型为_______;扁桃酸的结构简式___________。 (3)关于 G 物质,下列说法错误的是________(填标号)。 A G 分子中所有碳原子可能处于同一平面 B G 与 F 都能与新制 Cu(OH)2 反应 C G 可以发生聚合反应和还原反应 D G 使酸性 KMnO4 溶液和溴的 CCl4 溶液褪色的机理相同 (4)写出反应③的化学方程式__________。 (5)X 是扁桃酸的同分异构体,1mol X 可与 2mol Na2CO3 反应,其核磁共振氢谱有四组峰, 峰面积之比为 3:2:2:1,其可能的结构有______种。 (6)请设计由甲苯和乙醛为原料(无机试剂任选)制备肉桂醛( )的 合成路线_______。 【答案】 (1). -CHO (2). 对硝基甲苯(或 4-硝基甲苯) (3). 氧化反应 (4). - 20 - (5). BD (6). 2 +O2 Cu Δ 2 +2H2O (7). 4 (8). 【解析】 【分析】 甲苯与氯气光照条件发生取代反应生成 C7H7Cl,则 C7H7Cl 的结构简式为 , 在 NaOH 水溶液加热条件下水解生成 A,则 A 为 ,A 发生 反应生成 B,B 和 HCN,H2O/H+条件发生反应④生成扁桃酸,结合已知Ⅰ、Ⅱ,则 B 是 , 与 HCN 加成得 , 水解生 成扁桃酸 ;甲苯发生硝化反应生成 C,由 G 的结构可知,C 含有 1 个硝 基,则 C 为 , 与 Cl2 光照条件发生取代反应生 成 D 为 , 在水液加条件下水解生成 E 为 , 氧 化 生 成 F 为 , 与 合 成 G 为 ,据此解答。 - 21 - 【详解】(1)由分析可知,B 为 ,B 物质中官能团的结构简式是-CHO;C 为 ,名称为对硝基甲苯(或 4-硝基甲苯),故答案为:-CHO;对硝基甲 苯(或 4-硝基甲苯); (2)由 E 生成 F 为 氧化生成 F 为 ,反应 类型为氧化反应;由分析可知,扁桃酸的结构简式 ,故答案为:氧化反 应; ; (3)G 为 : A.G 分子中含有苯环、碳碳双健、碳氧双键都是平面型结构,所有碳原子可能处于同一平面, A 正确; B.G 不含有醛基,能与新制 Cu(OH)2 反应,F 含有醛基,都能与新制 Cu(OH)2 反应, 故 B 错误; C.G 可以发生加成反应、聚台反应、氧化反应和还原反应,如碳碳双键可以加成、聚合、氧 化反应,与氢气加成也是还原反应,故 C 正确; D.G 使酸性 KMnO4 溶液褪色,是发生氧化还原反应,G 使溴的 CCl4 溶液褪色,是发生加成 反应,故 D 错误; 故选 BD; (4)反应③为 转化为 ,化学方程式为 2 +O2 Cu Δ 2 +2H2O,故答案为:2 +O2 Cu Δ 2 +2H2O; - 22 - (5)X 是扁桃酸的同分异构体,1mol X 可与 2mol Na2CO3 反应,则分子中侧链可能含有酚羟 基和羧基,或者 2 个酚羟基、1 个碳氧双键;又因为其核磁共振氢谱有四组峰,峰面积之比为 3:2:2:1,所以侧链应含有 2 个酚羟基、1 个碳氧双键(可以是醛基也可以是羰基),还有 1 个 甲基,结构对称,符合条件的结构简式为 ,可能 的结构有 4 种,故答案为:4; (6)根据题中流程,A(甲苯)可以发生一系列反应生成 ,结台已知Ⅲ, 和乙醛在一定条件下反应可制备肉桂醛,故合成路线为 ,故答案为: 。 20. 氯化钪(ScC13)是一种可溶性、易潮解的固体,是工业制备钪及其合金的重要原料。某 小组用实验室现有的五水合草酸钪[Sc2(C2O4)3·5H2O]来制备氯化钪,基本过程如下。 回答下列问题: (1)五水合草酸钪灼烧时除生成 Sc2O3,还生成了 CO 和 CO2,化学方程式为________。 (2)该小组用下列装置检验五水合草酸钪灼烧产物中的 CO,各装置连接顺序为 c→______→f (填装置标号,可重复使用)。 - 23 - (3)把 Sc2O3 固体与焦炭混合,将干燥纯净的 Cl2 通入赤热的混合物反应制备 ScCl3,反应为 Sc2O3+3C+3Cl2 灼烧 2ScCl3+3CO。装置如下: ①试剂 a 与浓盐酸反应的离子方程式为______________________。 ②盛装碱石灰的仪器名称为_____,该仪器及碱石灰的作用为________。 (4)工业上 ScCl3 粗产品用升华法提纯,将粗产品与 NH4C1 固体共热来抑制 ScCl3 水解,其 原理为_______________。 【 答 案 】 (1). Sc2(C2O4)3·5H2O 灼烧 Sc2O3 + 3CO + 3CO2 + 5H2O (2). c→d→e→b→a→e→f (3). 2MnO - 4 +16H++10Cl-=2Mn2++5Cl2↑+8H2O (4). 干燥管 (5). 防止后续装置中水蒸气进入玻璃管使 ScCl3 吸水潮解,吸收 Cl2 尾气 (6). NH4Cl 受热分 解产生 HCl,可以抑制 ScCl3 水解 【解析】 【分析】 由题可知,五水合草酸钪灼烧时除生成 Sc2O3,还生成了 CO 和 CO2,把 Sc2O3 固体与焦炭混 合,将干燥纯净的 Cl2 通入赤热的混合物反应制备 ScCl3,据此解答。 【详解】(1)五水合草酸钪灼烧时除生成 Sc2O3,还生成了 CO 和 CO2,根据元素守恒,还生成 了水,化学方程式为 Sc2(C2O4)3·5H2O 灼烧 Sc2O3 +3CO+3CO2 +5H2O,故答案为: Sc2(C2O4)3·5H2O 灼烧 Sc2O3+3CO+3CO2+5H2O; (2)检验五水合草酸钪灼烧产物中的 CO,要先除去二氧化碳,再用澄清石灰水检查二氧化碳 是否除尽,再用浓硫酸干燥一氧化碳,将干燥的一氧化碳通过灼热的氧化铜,产生的气体通 - 24 - 入澄清石灰水,若 a 中出现黑色固体变红,a 后面的澄清石灰水变浑浊,则证明含有一氧化碳, 一氧化碳是有毒气体,选择燃烧的方式除去尾气,所以各装置连接顺序为 c→d→e→b→a→e→f,故答案为:c→d→e→b→a→e→f; (3)①由装置可知,A 为氯气的发生装置,属于固液不加热的发生装置,所以选择高锰酸钾和 浓盐酸发生反应,离子方程式为:2MnO - 4 +16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为: 2MnO - 4 +16H++10Cl-=2Mn2++5Cl2↑+8H2O; ②盛装碱石灰的仪器为干燥管,该仪器及碱石灰可防止后续装置中水蒸气进入玻璃管使 ScCl3 吸水潮解,吸收 Cl2 尾气,故答案为:干燥管;防止后续装置中水蒸气进入玻璃管使 ScCl3 吸 水潮解,吸收 Cl2 尾气; (4)NH4Cl 受热分解产生 HCl,可以抑制 ScCl3 水解,所以可以将粗产品与 NH4C1 固体共热来 抑制 ScCl3 水解,故答案为:NH4Cl 受热分解产生 HCl,可以抑制 ScCl3 水解。查看更多