- 2021-07-08 发布 |
- 37.5 KB |
- 17页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习第6章化学能与热能第19讲焓变热化学方程式教学案新人教版
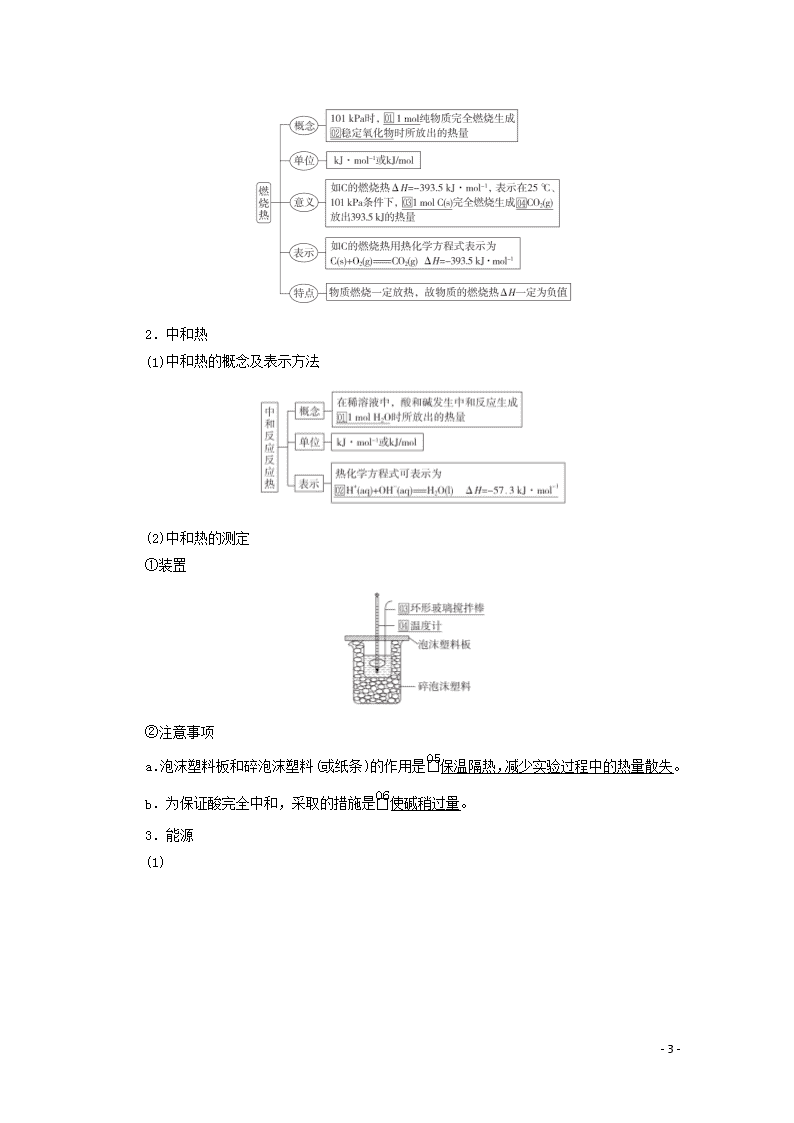
第六章 化学能与热能 [考纲解读] 1.了解化学反应中能量转化的原因及常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能正确书写热化学方程式。4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。5.了解焓变(ΔH)与反应热的含义。6.理解盖斯定律,能用盖斯定律进行有关反应焓变的计算。 第19讲 焓变 热化学方程式 一、焓变 1.焓变和反应热 (1)反应热:化学反应中吸收或放出的热量。 (2)焓变:生成物与反应物的内能差,ΔH=H(生成物)-H(反应物)。在恒压条件下化学反应的热效应等于焓变,其符号为ΔH,单位是kJ·mol-1或kJ/mol。 2.吸热反应与放热反应 (1)从能量守恒的角度理解 ΔH=生成物的总能量-反应物的总能量。 (2)从化学键变化角度理解 ΔH=反应物的总键能-生成物的总键能。 (3)常见的放热反应和吸热反应 ①放热反应:大多数化合反应、中和反应、金属与水或酸的反应、所有的燃烧反应、铝热反应及物质缓慢氧化。 - 17 - ②吸热反应:大多数分解反应、盐的水解反应、Ba(OH)2·8H2O和NH4Cl反应、C与H2O(g)反应、C与CO2反应。 注意 (1)吸热反应,放热反应的研究对象是化学变化。 有些变化过程虽有能量变化,但不属于吸热反应,放热反应,如NaOH固体溶于水,NH4NO3溶于水,浓H2SO4稀释,物质的三态变化,电解质的电离等。 (2)化学反应是放热还是吸热与反应发生的条件没有必然联系,有些放热反应需要高温引发,如2Al+Fe2O32Fe+Al2O3;有些吸热反应在常温下即可进行,如2NH4Cl+Ba(OH)2·8H2O===BaCl2+2NH3↑+10H2O。 二、热化学方程式 1.概念:表示参加反应物质的量和反应热的关系的化学方程式。 2.意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。例如:H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1,表示在25 ℃和1.01×105 Pa下,1 mol氢气和0.5 mol氧气完全反应生成1 mol液态水时放出285.8 kJ的热量。 3.热化学方程式的书写 三、燃烧热与中和热 能源 1.燃烧热 - 17 - 2.中和热 (1)中和热的概念及表示方法 (2)中和热的测定 ①装置 ②注意事项 a.泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量散失。 b.为保证酸完全中和,采取的措施是使碱稍过量。 3.能源 (1) - 17 - (2)按能源的基本形态,还可以把能源分为一次能源和二次能源。 ①一次能源是指直接取自自然界,没有经过加工转换的各种能量和资源,包括原煤、原油、天然气、核能、太阳能、水能、风能、地热能、潮汐能等。 ②二次能源是由一次能源经过加工转换以后得到的能源产品,如:电能、煤气、汽油、氢能、沼气等。 1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)物质发生化学变化不一定伴有能量的变化。(×) 错因:物质发生化学变化都伴有能量的变化。 (2)放热反应不需要加热就能反应,吸热反应不加热就不能反应。(×) 错因:碳的燃烧反应是放热反应,但反应需要加热引发,Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,反应不需加热就能发生。 (3)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同。(×) 错因:ΔH只与反应体系的始态和终态有关,与反应引发的条件无关。 (4)N2分子中含3个共价键,键能大,故N2的能量(焓)也大。(×) 错因:分子中键能越大,分子越稳定,能量越低。 (5)甲烷的燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1。(×) 错因:燃烧热是指101_kPa时,1_mol纯物质完全燃烧生成稳定氧化物时放出的热量,最后应生成液态水。 (6)S(s)+O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热)(ΔH的数值正确)。(×) 错因:硫的燃烧热是硫充分燃烧生成SO2(g)时的焓变。 2.教材改编题 (据人教选修四P6T4)关于下列图像的叙述不正确的是( ) - 17 - A.图1表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 B.图2表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·mol-1 C.由图可知正、逆反应的热效应的数值相同 D.两个图像表示的含义不同 答案 B 解析 图2表示的热化学方程式为:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ/mol 考点一 焓变、反应热 [解析] 反应的焓变只与反应的始态和终态有关,而与变化路径无关,催化剂能降低反应所需的活化能,但不能改变反应的焓变,故A错误;由题图可知,催化剂通过改变反应的途径降低了反应的活化能,故C错误;由题图可知,过氧化氢分解的反应中,反应物的总能量高于生成物的总能量,则该反应为放热反应,故D错误。 [答案] B 解答能量变化图像题的“三”关键 - 17 - 1.注意活化能在图示中的意义 (1)从反应物至最高点的能量数值表示正反应的活化能(E1)。 (2)从最高点至生成物的能量数值表示逆反应的活化能(E2)。 (3)ΔH=E1-E2。 2.催化剂只影响正、逆反应的活化能,而不影响反应的焓变。 3.涉及反应热的有关计算时,要特别注意图示中反应物和生成物的物质的量。 1.(2019·河南汝州实验中学高三期末)已知25 ℃、101 kPa下,如下图所示,石墨的燃烧热为393.51 kJ/mol,金刚石的燃烧热为395.41 kJ/mol。下列表达正确的是( ) A.金刚石比石墨稳定 B.C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ/mol C.ΔH1<ΔH2 D.如果使用催化剂,ΔH1和ΔH2都变小 答案 B 解析 由题可知石墨、金刚石燃烧的热化学方程式分别为C(s,石墨)+O2(g)===CO2(g) ΔH=-393.51 kJ/mol;C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.41 kJ/mol,二者相减可得C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ/mol,B正确。由题图可知,金刚石总能量较大,石墨比金刚石稳定,A错误;反应放热,则ΔH<0,金刚石放出的热量多,则有ΔH1>ΔH2,C错误;催化剂不改变反应热的大小,D错误。 2.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: - 17 - 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 答案 C 解析 A项,状态Ⅰ总能量为反应物总能量,状态Ⅲ总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,该反应为放热反应;B项,从状态Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断键形成C和O,C、O原子间一直有化学键;C项,由图示可以看出,CO和O生成了CO2,CO2分子中C与O形成极性共价键;D项,状态Ⅰ→状态Ⅲ表示CO与O反应生成CO2的过程,并不是CO与O2的反应过程。 考点二 热化学方程式的书写与判断 [解析] 1 mol的气态水分解产生1 mol的氢气和 mol的氧气的能量变化是: kJ·mol-1=242.5 kJ·mol-1,因此热化学方程式为H2O(g)===H2(g)+O2(g) ΔH=+242.5 kJ·mol-1,A、B错误。2 mol的气态水分解产生2 mol的氢气和1 mol的氧气吸收的热量是485 kJ,则产物燃烧生成2 mol气态水放出的热量也为485 kJ,即热化学方程式是2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1,C错误,D正确。 [答案] D 判断热化学方程式正误的“五审” - 17 - 3.(1)(2019·哈尔滨六中高三期末)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下: 共价键 C—O H—O N—H C—N 键能(kJ/mol) 351 463 393 293 则该反应的ΔH=________ kJ/mol。 (2)(2019·广州高三调研)已知反应2N2O(g)===2N2(g)+O2(g)的ΔH=-163 kJ/mol,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1 mol N2O(g)分子中化学键断裂时需要吸收的能量为________kJ。 答案 (1)-12 (2)1112.5 解析 (1)设C—H键能为x kJ/mol,ΔH=反应物总键能-生成物总键能=3x+351+463+3×393-(3x+293+2×393+2×463)kJ/mol=-12 kJ/mol。 (2)根据ΔH=反应物总键能-生成物总键能,则2E(N2O)-(945 kJ×2+498 kJ)=-163 kJ,解得E(N2O)=1112.5 kJ。 4.写出下列反应的热化学方程式。 (1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________________。 (2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3 - 17 - 沉淀,则乙醇燃烧的热化学方程式为________________________________________。 (3)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:______________________。 答案 (1)N2(g)+3H2(g)===2NH3(g)ΔH=-92 kJ·mol-1 (2)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-2Q kJ·mol-1 (3)A2(g)+B2(g)===2AB(g)ΔH=+(a-b)kJ·mol-1 解析 (2)根据C原子守恒有:C2H5OH~2CO2~2CaCO3。生成100 g CaCO3沉淀,乙醇为0.5 mol,则1 mol乙醇完全燃烧放出2Q kJ热量,据此可写出反应的热化学方程式:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2Q kJ·mol-1。 考点三 燃烧热 中和热 能源 [解析] (2)1、2、3、4次实验的温度差分别为4.0 ℃、6.1 ℃、3.9 ℃、4.1 - 17 - ℃,与其他三组数据相比,6.1 ℃误差较大,应舍去,其余三次温度差的平均值为4.0 ℃。0.50 mol·L-1 H2SO4(aq)和0.50 mol·L-1 NaOH(aq)的密度为1 g·cm-3,故m(H2SO4)=ρ(H2SO4)·V(H2SO4)=1 g·mL-1×30 mL=30 g,m(NaOH)=ρ(NaOH)·V(NaOH)=1 g·mL-1×50 mL=50 g。中和后生成的溶液为稀溶液,其比热容c=4.18 J·g-1·℃-1,由此可以计算出30 mL H2SO4(aq)和50 mL NaOH(aq)发生反应时放出的热量Q放=[m(NaOH)+m(H2SO4)]·c·(T2-T1),中和热为生成1 mol H2O(l)时放出的热量,ΔH=-=-×10-3 kJ·mol-1≈-53.5 kJ·mol-1。 [答案] (1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 (2)①4.0 ②-53.5 kJ·mol-1 ③acd 1.燃烧热、中和热 (1)由于中和反应和燃烧均是放热反应,因此表示中和热和燃烧热的ΔH要带“-”号。如:某物质的燃烧热为ΔH=-Q kJ·mol-1。 (2) 2.中和热的测定 (1)测定原理 ΔH=- c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。稀溶液的密度用1 g·mL-1进行计算。 (2)问题设计 ①该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。 实验序号 起始温度T1/℃ 终止温度T2/℃ 温差(T2-T1)/℃ 盐酸 NaOH溶液 平均值 1 25.0 25.0 25.0 28.2 3.2 2 24.9 24.9 24.9 28.3 3.4 3 25.0 25.0 25.0 28.3 3.3 已知盐酸、NaOH溶液密度近似为1.00 g·mL-1,盐酸的浓度为0.5 - 17 - mol/L,NaOH溶液的浓度为0.55 mol/L,中和后混合液的比热容c=4.18×10-3kJ·g-1·℃-1,则该反应的中和热ΔH=-55.176 kJ·mol-1。 ②若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小,其原因是醋酸电离要吸热。 ③在中和热测定实验中要用水冲洗温度计上的盐酸,若无此操作步骤,则测得的中和热偏小。 5.为了测量某酸碱反应生成1 mol水时的反应热,在计算时至少需要的数据有( ) ①酸的浓度 ②碱体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间 A.①②③④ B.①③④⑤ C.③④⑤⑥ D.全部 答案 C 解析 测定中和热的原理为Q=c·m·Δt,ΔH=-,故需要的数据有比热容、反应后溶液的质量、反应前后温度变化、生成水的物质的量,C项正确。 6.(2019·台州期末)合理利用燃料,减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( ) A.“可燃冰”是将水变为油的新型燃料 B.通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 C.燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 D.硫的燃烧热为a kJ·mol-1,硫燃烧热的热化学方程式:S(s)+O2(g)===SO3(g) ΔH=-a kJ·mol-1 答案 C 解析 “可燃冰”外观像冰,其化学组成是CH4·nH2O,水的化学式为H2O,根据元素守恒知,水不能变为油,A错误;氧气助燃,所以通入足量的空气能使燃料充分燃烧,但通入大大过量的空气会使热量被空气带走,不利于热量的充分利用,B错误;物质的化学能可以转化为热能、光能、电能等能量形式,C正确;根据燃烧热的定义,硫转化成气态的二氧化硫,D错误。 建议用时:40分钟 满分:100分 一、选择题(每题9分,共72分) 1.伴随下列变化而发生的能量变化中,属于反应热的是( ) - 17 - A.形成1 mol H—Cl键放出的能量 B.石墨转化成金刚石吸收的能量 C.Na变成Na+吸收的能量 D.水蒸气变成液态水放出的能量 答案 B 解析 反应热是化学反应放出或吸收的热量。 2.下列物质间的反应,其能量变化符合右图的是( ) A.由Zn和稀硫酸制氢气 B.灼热的炭粉与二氧化碳反应 C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解 答案 A 解析 该图示为放热反应能量图,A正确。 3.下图表示某反应的能量变化,对于该图的理解正确的是( ) A.曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 B.曲线Ⅱ可表示反应2NH3N2+3H2的能量变化 C.该反应不需要加热就能发生 D.该反应的ΔH=E2-E1 答案 D 解析 图中曲线Ⅰ和曲线Ⅱ的始态、终态相同,表示同一个化学反应的能量变化,A错误;反应物的能量大于生成物的能量,该反应是放热反应,NH3的分解反应是吸热反应,B错误;放热反应是指在反应过程中放出热量,并不表示反应不需要加热,C错误。 - 17 - 4.已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量,则表示乙炔燃烧热的热化学方程式正确的是( ) A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g) ΔH=-2b kJ·mol-1 B.C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1 D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1 答案 B 解析 由题意知2 mol CO2~2b kJ~1 mol C2H2,则表示乙炔燃烧热的热化学方程式为:C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1,故答案为B。 5.下列热化学方程式或叙述正确的是( ) A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1 B.12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ·mol-1 C.已知:H2(g)+O2(g)===H2O(l) ΔH=-286 kJ·mol-1, 则:2H2O(l)===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1 D.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 答案 C 解析 A项,放热反应,ΔH<0,错误;B项,12 g C的物质的量为1 mol,ΔH=-221.0 kJ·mol-1,错误;C项,已知反应为放热反应,则其逆反应为吸热反应,ΔH为“+”,ΔH与化学计量数成正比,正确;D项,反应是可逆反应,0.5 mol N2和1.5 mol H2不能完全反应,错误。 6.(2019·永州联考)反应N2+3H22NH3的能量变化如图所示,其热化学方程式正确的是( ) - 17 - A.N2(g)+3H2(g)2NH3(l)ΔH=+2(b+c-a)kJ·mol-1 B.N2(g)+3H2(g)2NH3(g)ΔH=+2(b-a)kJ·mol-1 C.N2(g)+3H2(g)2NH3(l)ΔH=-2(b+c-a)kJ·mol-1 D.N2(g)+3H2(g)2NH3(g)ΔH=-(a+b)kJ·mol-1 答案 C 解析 由题图可知,反应物的能量高,则合成氨的反应为放热反应,由于 mol N2(g)和 mol H2(g)的总能量比1 mol NH3(g)的能量大(b-a) kJ,故热化学方程式为N2(g)+H2(g)NH3(g) ΔH=-(b-a)kJ·mol-1,则N2(g)+3H2(g)2NH3(g) ΔH=-2(b-a)kJ·mol-1,故B、D错误;由于 mol N2(g)和 mol H2(g)的总能量比1 mol NH3(l)的能量大(b+c-a)kJ,故热化学方程式为N2(g)+H2(g)NH3(l) ΔH=-(b+c-a) kJ·mol-1,则N2(g)+3H2(g)2NH3(l) ΔH=-2(b+c-a)kJ·mol-1,故A错误,C正确。 7.下列说法正确的是( ) A.已知C2H6的燃烧热为1090 kJ·mol-1,则C2H6燃烧的热化学方程式为C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(g) ΔH=-1090 kJ·mol-1 B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后最高温度 D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 答案 C 解析 A项,燃烧热指1 mol可燃物完全燃烧所放出的热量,完全燃烧指C元素生成CO2,H元素生成液态水,错误;B项,CO的燃烧热为283 kJ·mol-1,错误;D项,醋酸为弱电解质,在电离时吸收热量,所以稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出的热量小于57.3 kJ,错误。 8.燃烧a g C2H5OH(l),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则表示乙醇燃烧的热化学方程式是( ) - 17 - A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-20Q kJ·mol-1 B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1 C.C2H5OH(l)+O2(g)===CO2(g)+H2O(g) ΔH=-20Q kJ·mol-1 D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-40Q kJ·mol-1 答案 B 解析 由关系式:CaCO3~CO2~C2H5OH可知,a g乙醇的物质的量为n(CaCO3)=0.025 mol,所以1 mol C2H5OH(l)燃烧生成二氧化碳气体和液态水,放出的热量是40Q kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1。 二、非选择题(共28分) 9.(15分)Ⅰ.已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。 (1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。 (2)若在反应体系中加入催化剂使反应速率增大,则E1、E2和ΔH的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)。 Ⅱ.依据事实,写出下列反应的热化学方程式。 (1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为____________________。 (2)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是________________________________。 (3)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 - 17 - kJ。该反应的热化学方程式为_____________________________________。 答案 Ⅰ.(1)吸热 E1-E2 一定低 (2)减小 减小 不变 Ⅱ.(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1 (2)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216.0 kJ·mol-1 (3)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ·mol-1 解析 Ⅰ.(2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变。 10.(13分)利用如图所示装置测定中和热的实验步骤如下: ①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题: (1)为什么所用NaOH溶液要稍过量? ________________________________________________________________________。 (2)倒入NaOH溶液的正确操作是________(填字母)。 A.沿玻璃棒缓慢倒入 B.分三次倒入 C.一次迅速倒入 (3)使盐酸与NaOH溶液混合均匀的正确操作是________(填字母)。 A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动 (4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________。 (5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容 - 17 - c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下: 实验序号 起始温度t1/℃ 终止温度t2/℃ 盐酸 氢氧化钠溶液 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6 依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。 (6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ________________________________________________________________________。 答案 (1)确保盐酸被完全中和 (2)C (3)D (4)ΔH1=ΔH2<ΔH3 (5)-51.8 kJ·mol-1 (6)不能 H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响反应的中和热 解析 (4)稀氢氧化钠溶液和稀氢氧化钙溶液中溶质都完全电离,它们的中和热相同,稀氨水中的溶质是弱电解质,它与盐酸的反应中一水合氨的电离要吸收热量,故反应热的数值要小一些(注意中和热与ΔH的关系)。 - 17 -查看更多