- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2010届高中化学竞赛(习题)----晶体结构
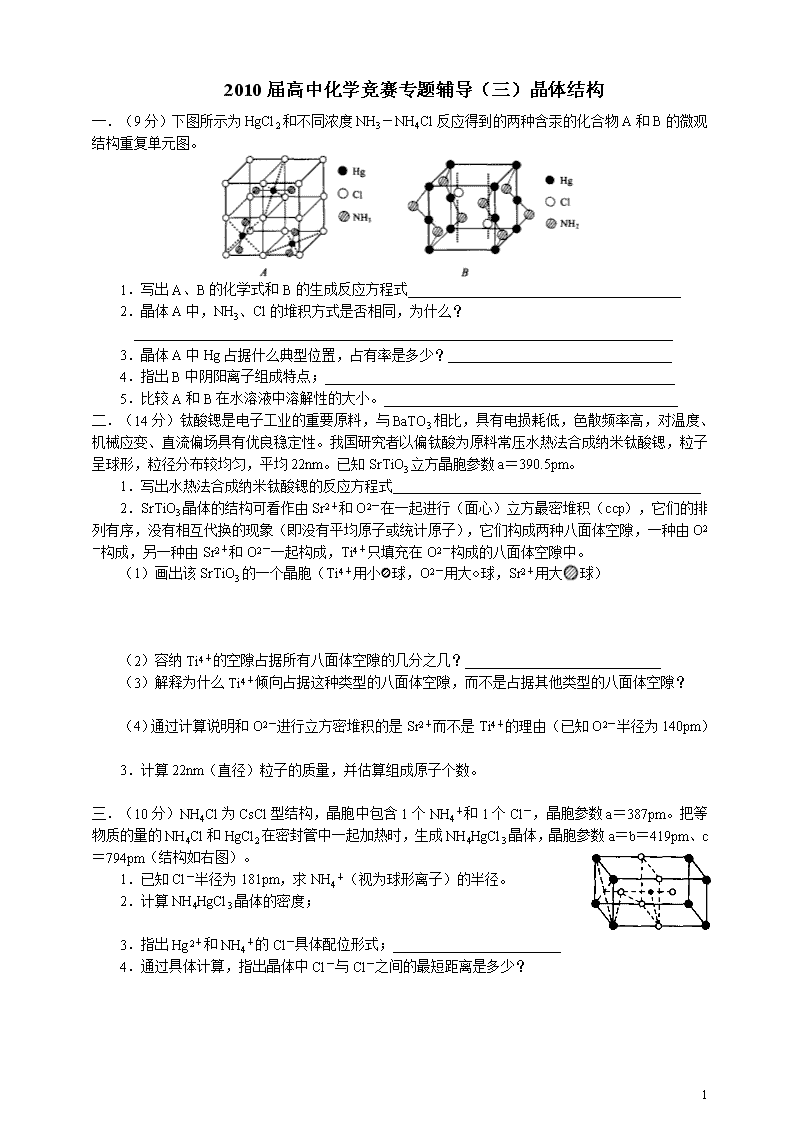
1 2010 届高中化学竞赛专题辅导(三)晶体结构 一.(9 分)下图所示为 HgCl2 和不同浓度 NH3-NH4Cl 反应得到的两种含汞的化合物 A 和 B 的微观 结构重复单元图。 1.写出 A、B 的化学式和 B 的生成反应方程式_______________________________________ 2.晶体 A 中,NH3、Cl 的堆积方式是否相同,为什么? _____________________________________________________________________________ 3.晶体 A 中 Hg 占据什么典型位置,占有率是多少?________________________________ 4.指出 B 中阴阳离子组成特点;__________________________________________________ 5.比较 A 和 B 在水溶液中溶解性的大小。__________________________________________ 二.(14 分)钛酸锶是电子工业的重要原料,与 BaTO3 相比,具有电损耗低,色散频率高,对温度、 机械应变、直流偏场具有优良稳定性。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子 呈球形,粒径分布较均匀,平均 22nm。已知 SrTiO3 立方晶胞参数 a=390.5pm。 1.写出水热法合成纳米钛酸锶的反应方程式____________________________________________ 2.SrTiO3 晶体的结构可看作由 Sr2+和 O2-在一起进行(面心)立方最密堆积(ccp),它们的排 列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由 O2 -构成,另一种由 Sr2+和 O2-一起构成,Ti4+只填充在 O2-构成的八面体空隙中。 (1)画出该 SrTiO3 的一个晶胞(Ti4+用小 球,O2-用大○球,Sr2+用大 球) (2)容纳 Ti4+的空隙占据所有八面体空隙的几分之几?____________________________ (3)解释为什么 Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙? (4)通过计算说明和 O2-进行立方密堆积的是 Sr2+而不是 Ti4+的理由(已知 O2-半径为 140pm) 3.计算 22nm(直径)粒子的质量,并估算组成原子个数。 三.(10 分)NH4Cl 为 CsCl 型结构,晶胞中包含 1 个 NH4 +和 1 个 Cl-,晶胞参数 a=387pm。把等物 质的量的 NH4Cl 和 HgCl2 在密封管中一起加热时,生成 NH4HgCl3 晶体,晶胞参数 a=b=419pm、c= 794pm(结构如右图)。 1.已知 Cl-半径为 181pm,求 NH4 +(视为球形离子)的半径。 2.计算 NH4HgCl3 晶体的密度; 3.指出 Hg2+和 NH4 +的 Cl-具体配位形式;________________________ 4.通过具体计算,指出晶体中 Cl-与 Cl-之间的最短距离是多少? 2 H3BO3 的层状结构 四.(8 分)金属铜的理想堆积模型为面心立方紧密堆积(CCP),设它的边长为 acm。在晶体中与 晶胞体对角线垂直的面在晶体学中称为(1,1,1)面。 1.请画出金属铜的晶胞(○表示 Cu 原子),并涂黑有代表性的 1 个(1,1,1)面上的 Cu 原子。 2.计算(1,1,1)面上 Cu 占整个面积的百分率以及 Cu 占整个体积的百分率(给出计算过程)。 五.(10 分)某钠盐 X 的阴离子为正八面体构型,由 7 个原子 70 个电子组成。X 晶体的结构有如下 特点:阴离子的空间排列方式与 NaCl 晶体中的 Na+(或 Cl-)的排列方式完全一样,而 Na+占据其全 部四面体空隙中。 1.确定阳离子、阴离子个数比;_________________ 2.确定 X 的化学式;____________ 3.如果 X 晶体的晶胞参数为 a(cm),X 的摩尔质量为 MX(g/mol),写出 X 密度的表达式; 4.X 晶体中 Na+的空间排列方式与 CsCl 晶体中的 Cs+(或 Cl-)的排列方式是否完全一样?____ 如果将阴离子看作由 Na+形成的空隙中,那么占有率为多大?_______________________ 5.如果晶胞的坐标原点为 Na+,请画出该晶胞全部阴离子的空间构型(阴离子用●表示) 6.某钾盐 Y 的阴离子组成和在晶胞中的排列方式与 X 相似,而 K+填充在全部八面体空隙中,写 出 Y 的化学式。___________ 六.(5 分)Na2O 为反 CaF2 型结构,晶胞参数 a=555pm。 1.计算 Na+的半径(已知 O2-半径为 140pm); 2.计算密度。 七.(8 分)点阵素单位是指最小的重复单位,将最小重复单位的内容用一个点阵表示,最小重复单 位中只含一个点阵点,称为素单位。含 2 个或 2 个以上点阵点的单位称为复单位。画出素单位的关键 是能按该单位重复,与单位预角上是否有圆圈无关。某平面周期性结构系按右图单位重复堆砌而成。 1.写出该素单位中白圈和黑圈的数目。_____________ 2.请画出 2 种点阵素单位,要求一种顶点无原子,另一种顶点有原子。 3.请画出石墨片层的 3 种点阵素单位。 九.(8 分)正硼酸(H3BO3)是片层状结构白色晶体,层内的 H3BO3 分子通过氢键相连(如右图)。 1.正硼酸晶体属于 晶体; 2.片层内微粒间的作用力是上面?片层间微粒间的作用力又是上面? 3.含 1mol H3BO3 的晶体中有 mol 氢键; 4.以 1 个片层为研究对象,画出其二维晶胞,并指出其所包含的内容。 3 十.(11 分)Ar、Xe、CH4、Cl2 等分子能和水形成气体水合物晶体。在这种晶体中,水分子形成三 维氢键骨架体系。在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。 (1)甲烷的气体水合物晶体成为可燃冰。已知每 1m3 这种晶体能释放出 164m3 的甲烷气体。试 估算晶体中水与甲烷的分子比。(不足的数据由自己假定,只要假设合理均按正确论) (2)X 射线分析,该晶体属于立方晶系,a=1200pm(即晶胞为立方体,边长为 1200pm)。晶 胞中 46 个水分子围成两个五角十二面体和六个稍大的十四面体(2 个六角形面,12 个五角 形面),八个 CH4 分子可进入这些多面体笼中。计算甲烷和水的分子数之比和该晶体的密度。 (3)已知 Cl2 的气体水合物晶体中,Cl2 和 H2O 的分子数之体为 1︰8,在其晶体中水分子所围成 的笼型结构与可燃冰相同。推测它的结构。 十一.三价铜化合物越来越受到化学家的重视。起初发现的三价铜化合物为离子化合物,三价铜存在 于阴离子[Cu2O6]6-中,目前所发现的三价铜配合物都是四配位的。 1.画出[Cu2O6]6-的结构; 2.一种三价铜的稀土化合物 LaCuO3 的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子 所构成的空隙中,其中三价铜离子的配位数是 La(Ⅲ)的一半,试画出 LaCuO3 的晶胞。 十二.(12 分)Q 为多核电中性对称配合物,化学式可写成 M3A3Cl3,其中 M 为中心原子,A 为一有 机配体(由常见元素组成)。A 为中性配体,不带电荷,M 的质量分数为 30.70%。空气中灼烧有白 烟和刺激性气体生成,A 中也有一 C3 轴。将 Q 溶解在液氨中得 R,分离溶液后蒸馏结晶再灼烧,得 红褐色固体氧化物。R 可由一常见白色难溶物(氯化物)溶解在液氨中制得。 1.M 为何种元素,指出其配位数;_______________________ 2.推出 A 的化学式;_________________ 3.画出 Q 的结构。 十三.(8 分)发光材料 Y2O2S 的晶体属三方晶系,它的六方晶胞参数为:a=378.8pm,c=659.1pm。 在晶体中,每个 Y 原子由 3 个 S 原子和 4 个 O 原子和它配位,Y 原子坐标为±(1/3,2/3,0.71),O 原子坐标为±(1/3,2/3,0.36),试画出 Y2O2S 的晶胞。 4 十四.(14 分)钛酸锶与 BaTO3 相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具 有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制 备高纯、超细、均匀 SrTiO3 的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳 米钛酸锶,粒子呈球形,粒径分布较均匀,平均 22nm。已知 SrTiO3 立方晶胞参数 a=390.5pm。 1.写出水热法合成纳米钛酸锶的反应方程式;____________________________________________ 2.SrTiO3 晶体的结构可看作由 Sr2+和 O2-在一起进行(面心)立方最密堆积(ccp),它们的排 列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由 O2 -构成,另一种由 Sr2+和 O2-一起构成,Ti4+只填充在 O2-构成的八面体空隙中。 (1)画出该 SrTiO3 的一个晶胞(Ti4+用小 球,O2-用大○球,Sr2+用大 球) (2)容纳 Ti4+的空隙占据所有八面体空隙的几分之几?_______________________ (3)解释为什么 Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙? (4)通过计算说明和 O2-进行立方密堆积的是 Sr2+而不是 Ti4+的理由(已知 O2-半径为 140pm) 3.计算 22nm(直径)粒子的质量,并估算组成原子个数。 十五.(11 分)硫化锰 MnS 是赭色物质,用碱金属硫化物沉淀制得。 1.计算纯水中 MnS 的溶解度?已知 MnS 的 Ksp 为 3×10-14,H2S 的 K1 和 K2 分别为 1.0×10-7 和 1.2×10-13 2.α-MnS 晶体属于立方晶系,用 X 射线粉末法测得该晶体晶胞参数 a=522.4pm; (1)26℃测得该晶体的密度为 4.05g/m3,请计算一个晶胞中的离子数; (2)若某α-MnS 纳米颗粒形状为立方体,边长为α-MnS 晶胞边长的 10 倍,请估算其表面原子 占总原子数的百分比。(已知 S2-的半径 0.184nm) 十六.(6 分)金属 M 的晶格是面心立方,密度为 8.90g/cm3,计算: 1.Ni 晶体中最邻近的原子之间的距离。 2.能放入 Ni 晶体空隙中的最大原子半径是多少? 5 2010 届高中化学竞赛专题辅导(三)晶体结构答案 一.(9 分)下图所示为 HgCl2 和不同浓度 NH3-NH4Cl 反应得到的两种含汞的化合物 A 和 B 的微观结构 重复单元图。 1.写出 A、B 的化学式和 B 的生成反应方程式; 2.晶体 A 中,NH3、Cl 的堆积方式是否相同,为什么?3.晶体 A 中 Hg 占据什么典型位置,占有率? 4.指出 B 中阴阳离子组成特点; 5.比较 A 和 B 在水溶液中溶解性的大小。 答案:1.A:Hg(NH3)2Cl2;B:Hg2(NH2)2Cl2(HgNH2Cl);HgCl2+2NH3=HgNH2Cl+NH4Cl(各 1 分) 2.都为简单立方堆积(1.5 分) 3.占据 Cl-形成简单立方的面心,占有率 1/6(各 1 分) 4.B 中存在着-Hg-NH2-Hg-锯齿型链和链间的 Cl-(1.5 分) 5.A 比 B 易溶于水(1 分) 二.(14 分)钛酸锶是电子工业的重要原料,与 BaTO3 相比,具有电损耗低,色散频率高,对温度、机 械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷 敏感元件等。制备高纯、超细、均匀 SrTiO3 的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水 热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均 22nm。已知 SrTiO3 立方晶胞参数 a=390.5pm。 1.写出水热法合成纳米钛酸锶的反应方程式; 2.SrTiO3 晶体的结构可看作由 Sr2+和 O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序, 没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由 O2-构成,另一 种由 Sr2+和 O2-一起构成,Ti4+只填充在 O2-构成的八面体空隙中。 (1)画出该 SrTiO3 的一个晶胞(Ti4+用小 球,O2-用大○球,Sr2+用大 球) (2)容纳 Ti4+的空隙占据所有八面体空隙的几分之几? (3)解释为什么 Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙? (4)通过计算说明和 O2-进行立方密堆积的是 Sr2+而不是 Ti4+的理由(已知 O2-半径为 140pm) 3.计算 22nm(直径)粒子的质量,并估算组成原子个数。 答案:1.H2TiO3+SrCl2+2KOH=SrTiO3+2H2O+2KCl(2 分) 2.(1) (2 分) (2)1/4(1 分) (3)容纳 Ti4+的八面体空隙处于晶胞的中心,是由 6 个最邻近的 O2-氧负离子所构成。其他的八面 体中心均位于晶胞边棱的中心,虽然最邻近的微粒数也是 6,但其中只有 4 个是 O2-,另外两 个是 Sr2+。两个正离子 Sr2+和 Ti4+彼此靠近,从静电学角度分析是不利的。(2 分) (4)Sr2+半径为(390.5× 2 -140×2)/2=136pm; Ti4+半径为(390.5-140×2)/2=55pm(各 1 分) Sr2+半径与 O2-半径相近,而 Ti4+半径小得多,适合填充在八面体空隙中(1.5 分) 4.ρ=M/NAa3=5.12g/cm3(1 分) V=πd3/6=5.57×10-18cm3(0.5 分) m=ρV=2.85×10-17g(1 分) N=5×V/a3=4.68×105 个(1 分) 6 三。NH4Cl 为 CsCl 型结构,晶胞中包含 1 个 NH4 +和 1 个 Cl-,晶胞参数 a=387pm。把等物质的量的 NH4Cl 和 HgCl2 在密封管中一起加热时,生成 NH4HgCl3 晶体,晶胞参数 a=b=419pm、c=794pm(如右图)。 1.已知 Cl-半径为 181pm,求 NH4 +(视为球形离子)的半径。 2.计算 NH4HgCl3 晶体的密度; 3.指出 Hg2+和 NH4 +的 Cl-具体配位形式; 4.通过具体计算,指出晶体中 Cl-与 Cl-之间的最短距离是多少? 答案:1.154pm(1.5 分) 2.ρ=1×325.0/[6.022×1023×(4.19×10-8)2×(7.94×10-8)]=3.87g/cm3。(1.5 分) 3.Hg2+:压扁的正八面体 NH4 +:压扁的正四棱柱(各 1.5 分,无压扁各 1 分) 4.Cl-的空间环境不同,可分为两类:体内的两个 Cl-①为一类;棱边中点的 4 个 Cl-②为另一类。前 者距 NH4 +较近(335pm),距 Hg2+也较近(241pm);后者距离 NH4 + 397pm,距 Hg2+ 296cm。Cl-①与 邻近晶胞的 Cl-的距离最短为 3.13pm,Cl-①与 Cl-②的距离为 382pm;Cl-②与 Cl-②的距离为 419pm。 四.(8 分)金属铜的理想堆积模型为面心立方紧密堆积(CCP),设它的边长为 acm。在晶体中与晶胞 体对角线垂直的面在晶体学中称为(1,1,1)面。 1.请画出金属铜的晶胞(○表示 Cu 原子),并涂黑有代表性的 1 个(1,1,1)面上的 Cu 原子。 2.计算(1,1,1)面上 Cu 占整个面积的百分率以及 Cu 占整个体积的百分率(给出计算过程)。 3.在 1 个盛有 CuSO4 溶液的电解槽内电镀铜,其中阴极经过特殊处理,只有 1 个(1,1,1)面暴露 在电解质溶液中,其余各面均被保护。假设此面面积为 bcm2,电镀时电流恒为 I。Cu2+在此面上做恒速率 均匀沉积,tmin 后,有一层 Cu 原子恰好在阴极上沉积完毕,求这是已沉积的第几层 Cu 原子?(阿伏加德 罗常数为 NA,法拉第常数为 F) 答案:1. (2 分) 2.设 Cu 原子半径为 r,r= 2 a/4,一个(1,1,1)面上有 1/2×3+1/6×3=2 个 Cu 原子。SCu=2 πr2=πa2/4,S 总= 3 a2/2,SCu/S 总= 3 π/6=90.69%。(1.5 分) 一个晶胞上有 1/2×6+1/8×8=4 个 Cu 原子。SCu=16/3πr3= 2 πa3/6,S 总=a3,SCu/S 总= 2 π/6= 74.05%。(1 分) 2.阴极面上一层 Cu 的物质的量为: 2/3 2a b ×2× AN 1 = ANa b 23 34 ;沉积的 Cu 原子的物质的量是: F It 2 60 , 层数: ANab FIt 23/34 /30 = Fb ItNa A 2 315 2 (3.5 分) 五.某钠盐 X 的阴离子为正八面体构型,由 7 个原子 70 个电子组成。X 晶体的结构有如下特点:阴离子 的空间排列方式与 NaCl 晶体中的 Na+(或 Cl-)的排列方式完全一样,而 Na+占据其全部四面体空隙中。 1.确定阳离子、阴离子个数比; 2.确定 X 的化学式; 3.如果 X 晶体的晶胞参数为 a(cm),X 的摩尔质量为 MX(g/mol),写出 X 密度的表达式; 4.X 晶体中 Na+的空间排列方式与 CsCl 晶体中的 Cs+(或 Cl-)的排列方式是否完全一样?如果将阴 离子看作由 Na+形成的空隙中,那么占有率为多大? 5.如果晶胞的坐标原点为 Na+,请画出该晶胞全部阴离子的空间构型(阴离子用●表示) 6.某钾盐 Y 的阴离子组成和在晶胞中的排列方式与 X 相似,K+填充在全部八面体空隙中,Y 的化学式。 答案:1.2︰1(1 分) 2.Na2SiF6(2 分) 3.ρ=4MX/NAa3(1.5 分) 4.一样 50%(1 分) 5. (正四面体)(2.5 分) 6.KPF6(1.5 分) 六.(5 分)Na2O 为反 CaF2 型结构,晶胞参数 a=555pm。 7 B N H3BO3 的层状结构 1.计算 Na+的半径(已知 O2-半径为 140pm);2.计算密度。 答案:1.100.32pm(2 分) 2.2.41g/cm3(3 分) 七.(8 分)点阵素单位是指最小的重复单位,将最小重复单位的内容用一个点阵表示,最小重复单 位中只含一个点阵点,称为素单位。含 2 个或 2 个以上点阵点的单位称为复单位。画出素单位的关键是能 按该单位重复,与单位预角上是否有圆圈无关。某平面周期性结构系按右图单位重复堆砌而成。 1.写出该素单位中白圈和黑圈的数目。 2.请画出 2 种点阵素单位,要求一种顶点无原子,另一种顶点有原子。 3.请画出石墨片层的 3 种点阵素单位。 答案:1.●○(1 分) 2. (各 2 分) 3. (各 1 分) 八.(8 分)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的 H3BO3 分子通过氢键相连(如右图)。 1.正硼酸晶体属于 晶体; 2.片层内微粒间的作用力是上面?片层间微粒间的作用力又是上面? 3.含 1mol H3BO3 的晶体中有 mol 氢键; 4.以 1 个片层为研究对象,画出其二维晶胞,并指出其所包含的内容。 答案:1.分子(1.5 分) 2.共价键、氢键(1 分) 分子间作用力(1 分)3.3(1.5 分) 4. (2 分) 2H3BO3(1 分)(B 的排列类似石墨) 九.(10 分)最简单的二元硼氮化合物可以通过下列反应合成: B2O3(l)+2NH3(g) 2BN(s)+3H2O(g) 反应产生的氮化硼的结构与石墨结构相类似,但上、下层平行,B、N 原子相互交替 (见图 1),其层状六方氮化硼的晶胞如图 2 所示。层内 B-N 核间距为 145 pm,面间距为 333 pm。 请回答下列问题: ⑴写出晶胞中 B、N 原子的原子坐标。 B 原子: ,N 原子 。 8 ⑵试列出求算层状六方氮化硼晶体的密度的计算式:(阿伏加德罗常数 NA) 。 ⑶在高压(60 kpa)、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼, 它与金刚石有类似结构。若立方氮化硼晶胞的边长为 a pm,试列出求算立方氮化硼晶体 中 B-N 键键长的计算式: 。 答案:(10 分,每空 2 分)⑴(4 分) B 原子 (0,0,0) ( 3 1 , 3 2 , 2 1 )或( 3 2 , 3 1 , 2 1 )(2 分) N 原子 (0,0, 2 1 ) ( 3 1 , 3 2 ,0)或( 3 2 , 3 1 ,0) (2 分) ⑵ 33021 A 1 cm103332 2 2145)3(mol -mol14.01)g(10.812 N ρ (3 分) ⑶d(B-N)= a4 3 (3 分) 十.(11 分)Ar、Xe、CH4、Cl2 等分子能和水形成气体水合物晶体。在这种晶体中,水分子形成三 维氢键骨架体系。在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。 (1)甲烷的气体水合物晶体成为可燃冰。已知每 1m3 这种晶体能释放出 164m3 的甲烷气体。试 估算晶体中水与甲烷的分子比。(不足的数据由自己假定,只要假设合理均按正确论) (2)X-射线衍射分析表明,该晶体属于立方晶系,a=1200pm(即晶胞为立方体,边长为 1200pm)。 晶胞中 46 个水分子围成两个五角十二面体和六个稍大的十四面体(2 个六角形面,12 个五角形面), 八个 CH4 分子可以进入这些多面体笼中。计算甲烷和水的分子数之比和该晶体的密度。 (3)已知 Cl2 的气体水合物晶体中,Cl2 和 H2O 的分子数之体为 1︰8,在其晶体中水分子所围成 的笼型结构与可燃冰相同。推测它的结构。 答案. (1)假设甲烷气体体积果折合成标准状况下的数据,为 7.32kmol。设甲烷水合物晶体的密度与 冰密度是相同的,为 1g/cm3,则其中的水有:55.56kmol,因此:CH4︰H2O=1︰7.6。说明:甲烷水 合物的组成可能是 6CH4·46H2O。以上是最简单的参考答案,只要答案为 CH·7~9H2O,均可按满 分计。(4 分) (2)n(CH4)︰n(H2O)=8︰46=4︰23(1 分);ρ=0.92g/cm3。(3 分) (3)由于 n(Cl2):n(H2O)=1︰8=6︰48。因此,十四面体笼填入 6 个 Cl2,2H2O 进入十二 面体笼。(3 分) 十一.近年来对于三价铜的研究日益深入,特别随着是钇钡铜氧化物的研究的深入,三价铜化合物越来越 受到化学家的重视。起初发现的三价铜化合物为离子化合物,三价铜存在于阴离子[Cu2O6]6-中,目前所发 现的三价铜配合物都是四配位的。 1.画出[Cu2O6]6-的结构; 2.一种三价铜的稀土化合物 LaCuO3 的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子所构 成的空隙中,其中三价铜离子的配位数是 La(Ⅲ)的一半,试画出 LaCuO3 的晶胞。 答案:1. O Cu3- O O O Cu3- O O 2. 9 十二。(12 分)Q 为多核电中性对称配合物,化学式可写成 M3A3Cl3,其中 M 为中心原子,A 为一有机 配体(由常见元素组成)。A 为中性配体,不带电荷,M 的质量分数为 30.70%。空气中灼烧有白烟和刺 激性气体生成,A 中也有一 C3 轴。将 Q 溶解在液氨中得 R,分离溶液后蒸馏结晶再灼烧,得红褐色固体氧 化物。R 可由一常见白色难溶物(氯化物)溶解在液氨中制得。 1.M 为何种元素,指出其配位数; 2.推出 A 的化学式; 3.画出 Q 的结构。 十三。(8 分)发光材料 Y2O2S 的晶体属三方晶系,它的六方晶胞参数为:a=378.8pm,c=659.1pm。在 晶体中,每个 Y 原子由 3 个 S 原子和 4 个 O 原子和它配位,Y 原子坐标为±(1/3,2/3,0.71),O 原子 坐标为±(1/3,2/3,0.36),试画出 Y2O2S 的晶胞。 十四。(14 分)钛酸锶与 BaTO3 相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具 有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制 备高纯、超细、均匀 SrTiO3 的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳 米钛酸锶,粒子呈球形,粒径分布较均匀,平均 22nm。已知 SrTiO3 立方晶胞参数 a=390.5pm。 1.写出水热法合成纳米钛酸锶的反应方程式; 2.SrTiO3 晶体的结构可看作由 Sr2+和 O2-在一起进行(面心)立方最密堆积(ccp),它们的排 列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由 O2 -构成,另一种由 Sr2+和 O2-一起构成,Ti4+只填充在 O2-构成的八面体空隙中。 (1)画出该 SrTiO3 的一个晶胞(Ti4+用小 球,O2-用大○球,Sr2+用大 球) (2)容纳 Ti4+的空隙占据所有八面体空隙的几分之几? (3)解释为什么 Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙? (4)通过计算说明和 O2-进行立方密堆积的是 Sr2+而不是 Ti4+的理由(已知 O2-半径为 140pm) 3.计算 22nm(直径)粒子的质量,并估算组成原子个数。 答案:1.H2TiO3+SrCl2+2KOH=SrTiO3+2H2O+2KCl(2 分) 2.(1) (2 分) (2)1/4(1 分) (3)容纳 Ti4+的八面体空隙处于晶胞的中心,是由 6 个最邻近的 O2-氧负离子所构成。其他的八面 体中心均位于晶胞边棱的中心,虽然最邻近的微粒数也是 6,但其中只有 4 个是 O2-,另外两 个是 Sr2+。两个正离子 Sr2+和 Ti4+彼此靠近,从静电学角度分析是不利的。(2 分) (4)Sr2+半径为(390.5× 2 -140×2)/2=136pm; Ti4+半径为(390.5-140×2)/2=55pm(各 1 分) Sr2+半径与 O2-半径相近,而 Ti4+半径小得多,适合填充在八面体空隙中(1.5 分) 4.ρ=M/NAa3=5.12g/cm3(1 分) V=πd3/6=5.57×10-18cm3(0.5 分) m=ρV=2.85×10-17g(1 分) N=5×V/a3=4.68×105 个(1 分) 十五。(11 分)硫化锰 MnS 是赭色物质,用碱金属硫化物沉淀制得。 1.计算纯水中 MnS 的溶解度? 已知 MnS 的 Ksp 为 3×10-14,H2S 的 K1 和 K2 分别为 1.0×10-7 和 1.2×10-13 2.α-MnS 晶体属于立方晶系,用 X 射线粉末法测得该晶体晶胞参数 a=522.4pm; (1)26℃测得该晶体的密度为 4.05g/m3,请计算一个晶胞中的离子数; (2)若某α-MnS 纳米颗粒形状为立方体,边长为α-MnS 晶胞边长的 10 倍,请估算其表面原子 占总原子数的百分比。(已知 S2-的半径 0.184nm) 答案:1.S2-+H2O HS-+OH- Kb=Kw/K2=0.083 10 MnS 的溶解度为 x mol/L,x=[Mn2+]=[HS-]=[OH-]。 [S2-]=[HS-][OH-]/Kb=x2/0.083 [Mn2+][S2-]=x(x)2/0.083=Ksp=3×10-14 x=1.4×10-5(4 分) 2.(1)Z=NAVD/M=4 即晶胞中含有 4 个[MnS],8 个离子。(3 分) (2)该纳米颗粒(立方体)边长为 10×522.4pm=5.224nm。 设表面层厚度为 S2-的直径,即 2×0.184nm=0.368nm 表面原子占总原子数的百分比为: 1-(5.224-0.368)3nm3/(5.224nm)3×100%=20%(3 分) 十六。(6 分)金属 M 的晶格是面心立方,密度为 8.90g/cm3,计算: 1.Ni 晶体中最邻近的原子之间的距离。 2.能放入 Ni 晶体空隙中的最大原子半径是多少? 答案:1.一个晶胞中有 Ni:8×1/8+6×1/2=4(个) 设晶胞边长为 acm 4×58.69/(6.02×1023×a3)=8.90 得 a=352.5(pm) 最邻近的 Ni 原子是顶角与面心的两个 Ni 原子 dmin= 2 a/2=249.3(pm)(3 分) 2.八面体空隙显然要大于四面体空隙 2rNi=dmin,2rx+2rNi=a,所以 rx=51.6(pm) 故最大填隙原子半径为 51.6pm。(3 分)查看更多