- 2021-07-08 发布 |
- 37.5 KB |
- 38页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
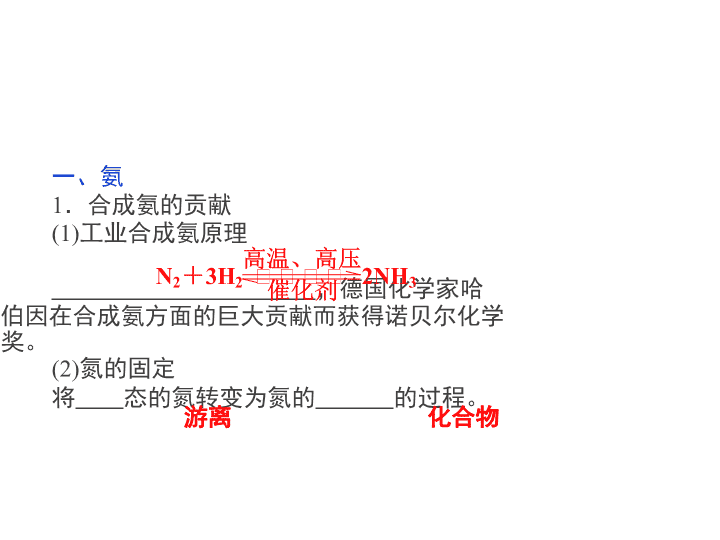
高中-化学:4氨
1.了解氨的性质、实验室制法及应用。 2.了解铵盐的性质。 3.了解NH4 +的检验。 4.了解氮循环对生态平衡的重要意义。 一、氨 1.合成氨的贡献 (1)工业合成氨原理 ,德国化学家哈 伯因在合成氨方面的巨大贡献而获得诺贝尔化学 奖。 (2)氮的固定 将 态的氮转变为氮的 的过程。 化合物游离 2.氨的物理性质 颜色: ,气味: ,溶 解性: 溶于水(体积比 )。 无色 刺激性气味 极易 1∶ 700 3.喷泉实验 实验装置 操作及现象 结论 (1)打开止水夹,并 挤压滴管的胶头 (2)烧杯中的溶液由 玻璃管进入烧瓶, 形成 ,瓶内液 体呈 色 氨 溶于水, 水溶液呈 性 喷泉 红 极易 碱 4.氨的化学性质 (1)氨与水的反应 ①反应的化学方程式为: 。NH3+H2ONH3·H2O ③氨水呈弱碱性,原因是(用电离方程 式表示) NH3·H2ONH4 ++OH-。 (2)氨与酸的反应 蘸取浓氨水和浓盐酸的两支玻璃棒靠近时 。 反应的化学方程式为: 。 (3)氨的催化氧化 化学方程式为: 。 产生白烟 NH3+HCl===NH4Cl 1.用蘸有浓硫酸和浓硝酸的玻璃棒分别和 蘸有浓氨水的玻璃棒接近时有白烟生成吗? 【思考·提示】 浓H2SO4没有白烟生成, 因为浓硫酸不具有挥发性。浓HNO3有白烟生成, 因为浓HNO3易挥发。 思考 二、铵盐 1.物理性质:铵盐都 于水。 2.化学性质 (1)铵盐受热易分解 易溶 (2)铵盐与碱反应 2.实验室如何检验NH4 +的存在? 【思考·提示】 向盛有待测液的试管中滴 加浓NaOH溶液,加热试管,将湿润的红色石蕊 试纸置于管口,若变蓝则证明溶液中存在NH4 +。 思考 三、氨的实验室制法 1.实验装置 3.收集: 法(管口塞一团棉花, 防止空气对流,使收集到的NH3尽量纯净)。 4.验满:将湿润的红色石蕊试纸放置在试 管口附近,若试纸变蓝色,说明NH3已收集满。 或用沾有浓盐酸的玻璃棒靠近试管口,若产生白 烟,则已集满。 向下排空气 1.喷泉形成的原理 容器内外存在较大的压强差,在这种压强 差的作用下,液体迅速流动,通过带有尖嘴的 导管喷出来,即形成喷泉。 喷泉实验 2.使容器内外产生较大的压强差的两类 情况 (1)容器内气体极易溶于水或容器内气体 易与溶液中的溶质发生化学反应。 例如: 气体 HCl NH3 CO2、Cl2、 H2S、SO2 NO2+ O2 吸收剂 水或 NaOH溶 液 水、 盐酸 NaOH溶液 水 (2)容器内的液体由于受热挥发(如浓盐酸、 浓氨水、酒精等)或发生化学反应,产生气体。 容器内产生大量气体,容器内压强迅速 增大,促使容器内液体迅速向外流动,也能 形成喷泉。如喷雾器、人造喷泉、火山喷发 等均是利用了此原理。 能形成喷泉的气体不一定是极易溶于水的 气体,只要瓶内气体与挤入的液体能发生反应使 瓶中压强变小就可形成喷泉。 特别提醒 (2008年高考上海卷)如图的装置 中,干燥烧瓶内盛有某种气体,烧杯 和滴管内盛放某种溶液。挤压滴管的 胶头,下列与实验事实不相符的是( ) A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉 C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉 【解析】 气体与液体易发生反应或易溶即可形成喷泉。 CO2―→NaHCO3溶液,不反应,难溶,无喷泉 【答案】 A 若将A项中NaHCO3换为NaOH能形成喷泉吗? 换为水呢? 【提示】 将NaHCO3换为NaOH可以形成喷 泉,因CO2能溶于NaOH溶液;但若换为水则不能 形成喷泉,因CO2在水中的溶解度不大。 1.如图所示,锥形瓶内盛有 气体X,滴管内盛有液体Y。若挤压 胶头滴管,使液体Y滴入锥形瓶中, 振荡,过一会儿,可见小气球a鼓胀 起来。气体X和液体Y不可能是( ) X Y A NH3 H2O B SO2 NaOH溶液 C CO2 6 mol·L-1H2SO4溶液 D HCl 6 mol·L-1Na2SO4溶液 解析:选C。气球鼓胀,说明锥形瓶内压强变小,即挤入的液体Y能 溶解X或能与X发生反应,A中NH3溶于水,B中SO2与NaOH溶液反应,D中 Na2SO4溶液中含水,HCl也可以在其中完全溶解,A、B、D都满足要求,只 有C中CO2不与H2SO4溶液反应,也很少溶解,不能使小气球鼓胀起来,故选C。 1.药品的选择 (1)铵盐:制取NH3时,一般用NH4Cl而不用 NH4NO3、(NH4)2SO4或(NH4)2CO3,原因如下: 氨气的实验室制法 铵盐 不选用的理由 NH4NO3 受热分解,会发生爆炸,不安全 (NH4)2SO4 与Ca(OH)2反应时生成CaSO4,反应物呈块 状,不利于NH3逸出,且反应后试管难清 洗 (NH4)2CO3 受热分解会产生CO2,使收集到的NH3不纯 (2)碱:一般用熟石灰,不用NaOH或 KOH,因为NaOH或KOH易吸水结块,而 且对玻璃腐蚀性较强。 2.实验装置类型 与实验室用KClO3和MnO2制取O2的装 置相同。 3.操作时的注意事项 (1)收集装置和反应装置的试管和导管必须 是干燥的; (2)发生装置的试管口略向下倾斜; (3)由于氨气的密度比空气小,因此收集氨 气时,导管应插入试管的底部; (4)加热温度不宜过高,并用酒精灯外焰由 前向后逐渐加热。 4.NH3的干燥 通常使用碱石灰,不能使用P2O5或浓H2SO4, 也不能用无水CaCl2。 5.验满 (1)用湿润的红色石蕊试纸放在试管口附近, 若变蓝,说明已经收集满。 (2)用蘸取浓盐酸的玻璃棒靠近试管口,若 有白烟生成,说明已经收集满。 6.尾气处理 多余的氨要吸收掉(可在导管口放一团用水 或稀硫酸浸湿的棉花球)以避免污染空气。但多余 气体在尾气吸收时要防止倒吸。常用的装置有: 7.其他常见制取NH3的方法 (1)加热浓氨水制氨。在烧瓶中加入2 mL~4 mL浓氨水,加热即得氨气,可用制氯 气的装置。 (2)常温下,用浓氨水与固体烧碱或生 石灰混合制氨气。这种方法的原理是:固体 烧碱或生石灰溶于水时放出大量的热,促使 NH3·H2O分解放出氨气。 下面是实验室制取氨气的装置和选用的试 剂,其中错误的是( ) 【思路点拨】 解答本题要注意以下三 点: (1)原理是否正确。 (2)装置是否合理、安全。 (3)操作是否简单易行。 【解析】 要根据反应原理中反应物的状态和反应条件选择合适的气 体发生装置。 选项 内容指向·联系分析 结论 A NH4Cl受热时分解为NH3和HCl,但在管 口及导管中NH3、HCl又会重新化合为 NH4Cl,得不到NH3 错误 B CaO+NH3·H2O===Ca(OH)2+NH3↑放 出热量的同时使氨水温度升高,降低了 NH3的溶解度 正确 C 装置错误,应使试管口略向下倾斜 错误 D 浓氨水加热时发生反应:NH3·H2O NH3↑+H2O,放出氨气 正确 【答案】 AC 【规律方法】 判断实验装置图是否错误的 一般方法:一看主体(发生)装置是否有错:①实 验是否需要加热;②酒精灯部位是否有错;③是 否有石棉网;④仪器放置是否有错;⑤夹持仪器 的位置是否有错。二看试剂是否符合实验原理 (包括反应物、除杂试剂、干燥剂、尾气吸收剂)。 三看收集方法是否有错(排水法、向上排空气法、 向下排空气法、导管伸入的位置等)。四看是否 缺少尾气吸收装置。 2.实验室制氨气通常有三种方法:①用 固体氢氧化钙和氯化铵反应,装置同课本;② 称取7.9 g碳酸氢铵固体放入试管内,再加入8 g 氢氧化钠固体,常温下即能产生氨气,装置如 图甲;③在锥形瓶中注入50 mL浓氨水,再加 入10 g氢氧化钠固体,装置如图乙,选取三个 250 mL的干燥的烧瓶及瓶塞,用于收集三种制 法的氨气。 (1)写出②法制取氨气的化学方程式:_______ ________________________________________; (2)说明用③法制取氨气的原理______________ _____________________________________________ _________________________________________; (3)检验氨气已收集满的方法_______________ _____________________________________________ _________________________________________; (4)用集满氨气的烧瓶做喷泉实验,装置如图丙 (烧杯内盛酚酞溶液),其现象是______________ _____________________________________________ _________________________________________。 解析:本题主要考查NH3的性质,通过氨气的实验室制取也考查了NH4 +和OH -的反应,解题的关键是第②种方法和第①种相似,只是铵盐和碱不同,比第①种方 法反应快,不用加热;第③种制氨方法,一定要用浓氨水和固态NaOH。 答案:(1)NH4HCO3+2NaOH===Na2CO3+ NH3↑+2H2O (2)在浓氨水中存在着下列平衡: NH3+H2ONH3·H2ONH4 ++OH- 当加入氢氧化钠固体时,增大溶液中c(OH -),使氨水中的平衡向左移动;另外氢氧化钠固 体溶解时放热,使氨水的温度升高,氨气溶解度 减小而有大量氨气逸出 (3)用湿润的红色石蕊试纸靠近瓶口,试纸变 蓝说明已满(或用玻璃棒蘸取浓盐酸靠近集气瓶 口,若冒白烟,表示氨气已收集满) (4)图丙装置中圆底烧瓶内的长玻璃管喷出 “泉水”,原烧杯中的溶液是无色的,喷泉呈红色查看更多