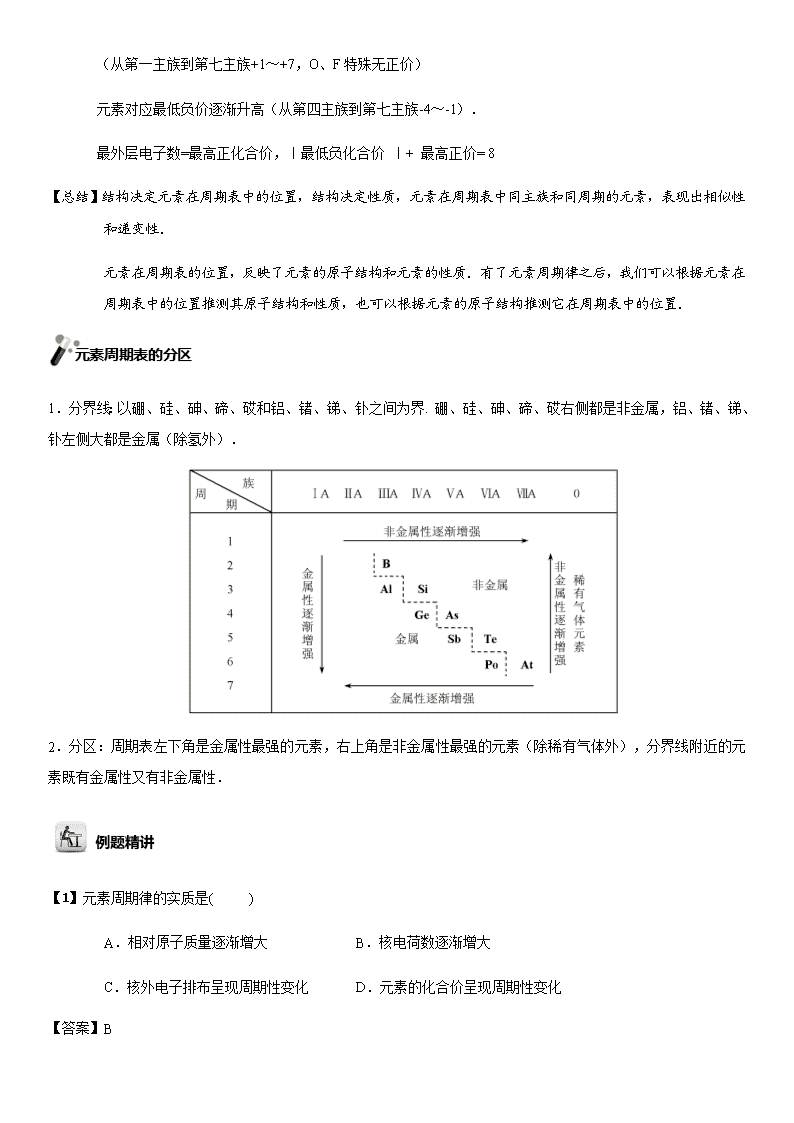
2020届高考化学一轮复习元素周期律学案
元素周期律
【1】依据元素周期表及元素周期律,下列推测正确的是 ( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
【答案】B
【2】下列粒子半径大小的比较正确的是 ( )
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Cs<Rb<K<Na
【答案】B
【3】三种短周期元素在周期表中的位置关系如右图所示。下列说法正确的是 ( )
X
Y
Z
A.Y的非金属性可能比Z的弱
B.三种元素均为非金属元素
C.Z形成简单离子的半径比Y形成简单离子的半径小
D.Y元素的最高正化合价比Z元素的最高正化合价高
【答案】B
【4】 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔、沸点最高
D.W的简单阴离子是同周期元素简单离子中半径最小的离子
【答案】C
【5】已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X
p则它们核内质子数(依次用x`、y`、z`表示)的关系为( )
A.x`=y`=z` B.y`>z`> x` C.x`>z`>y` D.z`= y`> x`
【答案】B
【5】下列各组元素性质递变规律不正确的是
A.Li、Be、B原子随原子序数的增加最外层电子数依次增多
B.P、S、Cl元素最高正价依次增高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
【答案】C
性质内容
同周期(从左到右)
同主族(从上到下)
原子半径
逐渐减小
逐渐增大
阴离子半径
逐渐减小
逐渐增大
阳离子半径
逐渐减小
逐渐增大
主要化合价
+1~+7,-4~-1
相似
非金属性
逐渐增强
逐渐减弱
金属性
逐渐减弱
逐渐增强
单质的氧化性
逐渐增强
逐渐减弱
阴离子的还原性
逐渐减弱
逐渐增强
氢化物的稳定性
逐渐增强
逐渐减弱
单质的还原性
逐渐减弱
逐渐增强
阳离子的氧化性
逐渐增强
逐渐减弱
最高价氧化物对应水化物的酸性
逐渐增强
逐渐减弱
最高价氧化物对应水化物的碱性
逐渐减弱
逐渐增强
非金属与氢气化合的难易程度
逐渐容易
逐渐困难
【1】可用来判断金属性强弱的依据是( )
A.原子电子层数的多少 B.最外层电子数的多少
C.最高价氧化物的水化物的碱性强弱 D.等物质的量的金属置换氢气的多少
【答案】C
【2】下列微粒半径之比大于1的是( )
A. B. C. D.
【答案】C
【3】下列各化合物中,阳离子与阴离子半径之比最小的是( )
A. LiI B.LiF C.NaCl D.KBr
【答案】A
【4】处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
【答案】右 大 3
【5】铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝同主族元素,元素符号是Tl,以下对铊的性质的推析不正确的是( )
A.铊是易导电的银白色金属 B.能生成+3价离子
C.氢氧化铊可能是两性氢氧化物 D.Tl3+的氧化能力比Al3+强
【答案】C
【6】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
【答案】D
【1】对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3 B.原子半径:Na<Mg<Al
C.离子半径:Na+<Mg2+<Al3+ D.单质的还原性:Al>Mg>Na
【答案】A
【2】(双选)下列各组元素最高正价氧化物对应水化物碱性逐渐减弱、酸性逐渐增强的是( )
A.NaOH、Mg(OH)2、H3PO4 、H2SO4 B.KOH、NaOH、HClO4、H2SO4
C.Ca(OH)2、Al(OH)3、HClO4、HBrO4 D.Mg(OH)2、Ca(OH)2、H3PO4 、H2SO4
【答案】AC
【3】电子层数相同的3种元素X、Y、Z已知最高价氧化物对应水化物的酸性HXO4>H2YO4>H3ZO4
则下列判断错误的是( )
A.原子半径X>Y>Z B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z D.气态氢化物还原性HX<H2Y<ZH3
【答案】A
【4】X、Y、Z三种主族元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、
碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是( )
A. X>Y>Z B.Y>X>Z C.X>Z>Y D.Y>Z>X
【答案】C
【5】A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
B
A
X
C
D
(1)各元素的符号:
A:_____,B:____,C:____, X:_____。
(2)C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______________。
【答案】(1)A:Si B:N C:S X:S (2) H2SO4>H3PO4>H3AsO4 (3)NH3>PH3>SiH4
【6】向溴化钠、碘化钠的混合溶液中通入足量氯气之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是( )
A.NaCl B.NaCl、NaBr、NaI C.NaBr、NaI D.NaCl、I2
【答案】A
【7】下列各组气态氢化物的稳定性按由强到弱的顺序排列的是( )
A.HI、HCl、H2S、PH3 B.PH3、H2S、HCl、HBr
C.HF、HCl、H2S、SiH4 D.NH3、PH3、H2S、HCl
【答案】C
【8】下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
1
A
2
D
E
G
I
3
B
C
F
H
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .
【答案】(1)Ne F F2 Na (2) NaOH HClO4 Al(OH)3 (3)HCl (4) B