2020高考化学二轮复习选择题标准练7含解析
选择题标准练(七)
满分:42分
每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与社会、技术、环境、生活密切相关,下列有关说法中错误的是( A )
A.石油裂解、煤的干馏和纳米银粒子的聚集都是化学变化
B.天然气、沼气都是比较清洁的能源,它们的主要成分都是烃类
C.碘酒、84消毒液、75%的酒精都可用于消毒
D.高纯硅广泛应用于太阳能电池和计算机芯片
解析:纳米银粒子的聚集是物理变化,A项错误;天然气、沼气的主要成分都是甲烷,它们都是比较清洁的能源,B项正确;碘酒、84消毒液、75%的酒精都可用于消毒,C项正确;高纯硅广泛应用于太阳能电池和计算机芯片,D项正确。
2.唐代《新修本草》中有如下描述:“本来绿色,新出窟未见风者,正如瑠璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。“绛矾”指( C )
A.硫酸铜晶体 B.硫化汞晶体
C.硫酸亚铁晶体 D.硫酸锌晶体
解析:根据“绛矾”本来为绿色,烧之变赤色可知“绛矾”的成分是硫酸亚铁晶体,其在空气中灼烧得到红棕色的Fe2O3,C项正确;硫酸铜晶体为蓝色,A项错误;硫化汞晶体为红色或黑色,B项错误;硫酸锌晶体为白色,D项错误。
3.a、b、c、d为短周期元素,原子序数依次增大。a的最外层电子数等于其电子层数的3倍,a和b能组成两种离子化合物,其中一种含两种化学键;d的最高价氧化物对应的水化物和气态氢化物的水溶液都是强酸。向d的氢化物的水溶液中逐滴加入bca2溶液,开始没有沉淀;随着bca2溶液的不断滴加,逐渐产生白色沉淀。下列推断正确的是( C )
A.简单离子半径:b>c>d>a
B.最高价氧化物对应水化物的碱性:b
O2->Na+>Al3+,A错误;最高价氧化物对应水化物的碱性:NaOH>Al(OH)3,B错误;工业上电解NaCl的饱和溶液可得到氯气,C正确;向过氧化钠中加入足量的氯化铝溶液一定能产生氢氧化铝沉淀,D错误。
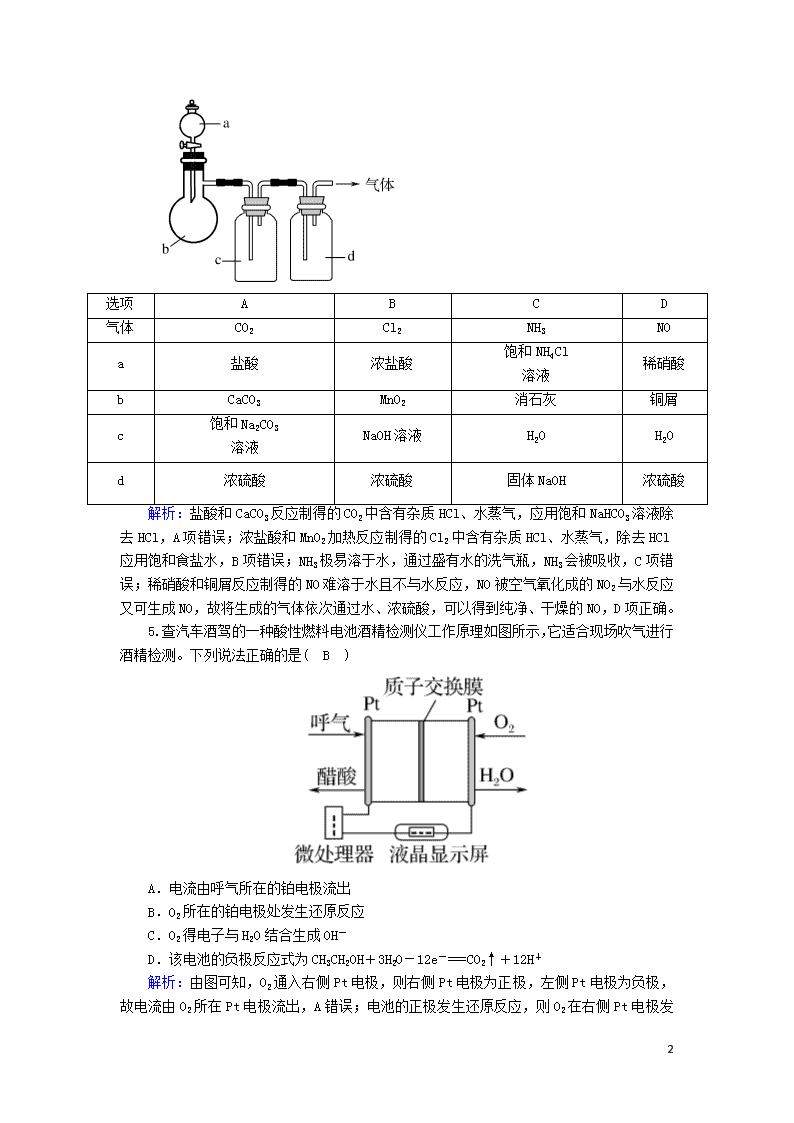
4.用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( D )
4
选项
A
B
C
D
气体
CO2
Cl2
NH3
NO
a
盐酸
浓盐酸
饱和NH4Cl
溶液
稀硝酸
b
CaCO3
MnO2
消石灰
铜屑
c
饱和Na2CO3
溶液
NaOH溶液
H2O
H2O
d
浓硫酸
浓硫酸
固体NaOH
浓硫酸
解析:盐酸和CaCO3反应制得的CO2中含有杂质HCl、水蒸气,应用饱和NaHCO3溶液除去HCl,A项错误;浓盐酸和MnO2加热反应制得的Cl2中含有杂质HCl、水蒸气,除去HCl应用饱和食盐水,B项错误;NH3极易溶于水,通过盛有水的洗气瓶,NH3会被吸收,C项错误;稀硝酸和铜屑反应制得的NO难溶于水且不与水反应,NO被空气氧化成的NO2与水反应又可生成NO,故将生成的气体依次通过水、浓硫酸,可以得到纯净、干燥的NO,D项正确。
5.查汽车酒驾的一种酸性燃料电池酒精检测仪工作原理如图所示,它适合现场吹气进行酒精检测。下列说法正确的是( B )
A.电流由呼气所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.O2得电子与H2O结合生成OH-
D.该电池的负极反应式为CH3CH2OH+3H2O-12e-===CO2↑+12H+
解析:由图可知,O2通入右侧Pt电极,则右侧Pt电极为正极,左侧Pt电极为负极,故电流由O2所在Pt电极流出,A错误;电池的正极发生还原反应,则O2
4
在右侧Pt电极发生还原反应,B正确;该电池的电解液呈酸性,则O2在正极上得电子与H+结合生成H2O,电极反应式为O2+4H++4e-===2H2O,C错误;呼出气体中CH3CH2OH在左侧Pt电极上发生氧化反应生成醋酸,则负极反应式为CH3CH2OH+H2O-4e-===CH3COOH+4H+,D错误。
6.固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
根据上述实验,以下说法正确的是( B )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有KAlO2、MgCl2
解析:A项,溶液甲中可能含有K2CO3,当其与稀硝酸反应时,可生成CO2气体,错误;B项,溶液A中加入BaCl2溶液有沉淀产生,说明溶液A中含有SO,则溶液甲中
必含有K2SO3,当甲与稀硝酸反应时SO被氧化为SO,正确;C项,当固体粉末X中含有足量的Fe时,Fe3+可以被还原为Fe2+,加入KSCN溶液时,不会出现血红色,错误;D项,溶液甲中加过量稀硝酸,生成沉淀A,说明溶液甲中一定含有K2SiO3,由于Mg2+与SiO不能共存,所以溶液甲中一定没有MgCl2,故D错误。
7.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:
4
下列说法正确的是( B )
A.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO)=c(CO)
B.反应HCO+H2OH2CO3+OH-的平衡常数为10-7.63
C.0.1 mol·L-1的NaHC2O4溶液中c(HC2O)+2c(C2O)+c(H2C2O4)=0.1 mol·L-1
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:CO+H2C2O4===HCO+HC2O
解析:在pH为6.37时c(H2CO3)=c(HCO),pH为10.25时,c(HCO)=c(CO),A错误;反应HCO+H2OH2CO3+OH-的
平衡常数为K===,由图象可得出Ka1(H2CO3)=10-6.37,则K==10-7.63,B正确;在0.1 mol·L-1的NaHC2O4溶液中有c(C2O)、c(HC2O)和c(H2C2O4),根据物料守恒c(C2O)+c(HC2O)+c(H2C2O4)=0.1 mol·L-1,C错误;草酸的酸性比碳酸强,往Na2CO3溶液中加入少量草酸溶液,能够生成HCO和C2O,发生反应:2CO+H2C2O4===2HCO+C2O,D错误。
4