- 2021-07-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习选择题标准练14含解析
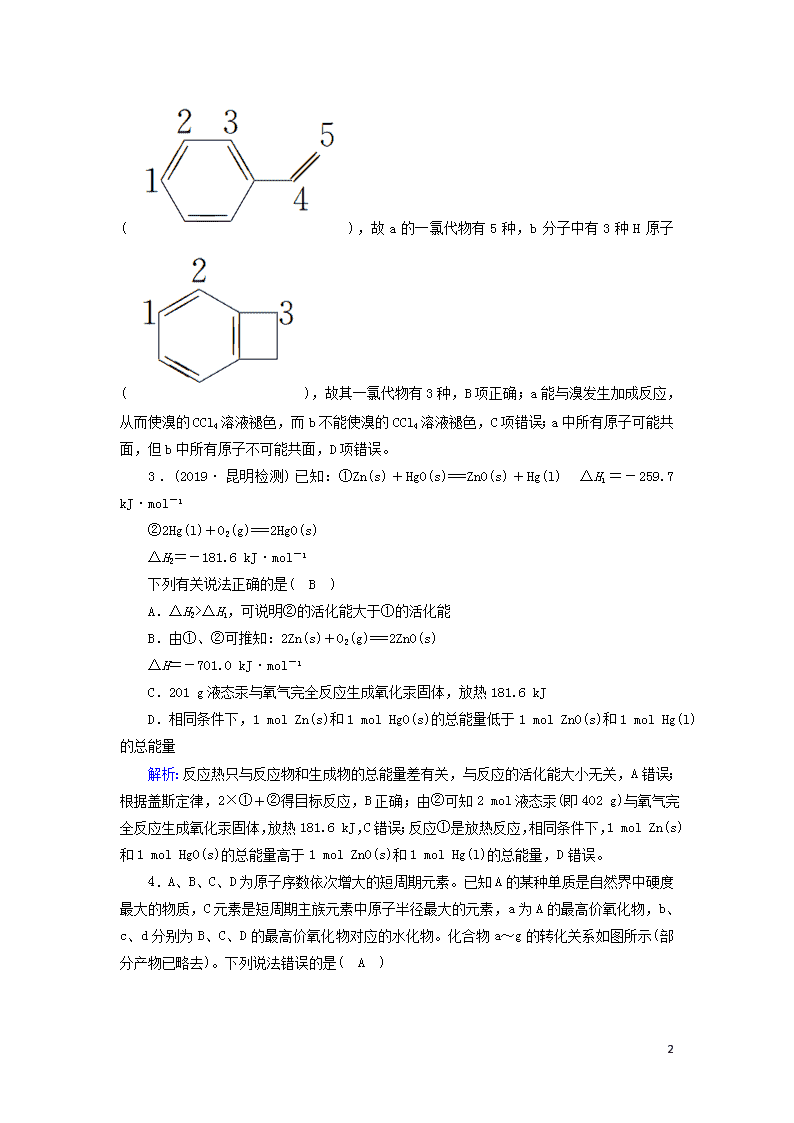
选择题标准练(十四) 满分:42分 每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.化学与生活密切相关,下列说法正确的是( B ) A.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋 B.《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还为丹砂”。该过程发生了氧化还原反应 C.酸雨样品露天放置一段时间,酸性减弱,是由于酸雨所含成分被氧化 D.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中 解析:硅胶具有吸水性,不具有还原性,可以用于食品干燥,不能用于防止富含油脂的月饼被氧化,A错误;根据题意,丹砂(HgS)烧之成水银——即红色的硫化汞(即丹砂)在空气中灼烧有汞生成,反应的化学方程式为HgSHg+S,汞和硫在一起又生成硫化汞,反应的化学方程式为Hg+S===HgS,此过程中存在化合价变化,发生氧化还原反应,B正确;二氧化硫导致酸雨,酸雨样品露天放置一段时间pH减小,生成的亚硫酸被氧化生成硫酸,酸性增强,C错误;含磷的污水虽然是很好的肥料,但是水中含量过高时会造成水体富营养化,使水生藻类大量繁殖,水中生物缺氧大量死亡,遗体腐败,水质恶化,所以不能直接排放,D错误。 2.(2019·济南模拟)已知 (a)、 (b)的分子式均为C8H8,下列说法正确的是( B ) A.a的同分异构体只有b一种 B.a、b的一氯代物分别有5种和3种(不考虑立体异构) C.a、b均可使溴的四氯化碳溶液褪色 D.a、b中所有原子均可能处于同一平面 解析: 5 a的同分异构体除了b外,还有立方烷等,A项错误;a分子中有5种H原子(),故a的一氯代物有5种,b分子中有3种H原子(),故其一氯代物有3种,B项正确;a能与溴发生加成反应,从而使溴的CCl4溶液褪色,而b不能使溴的CCl4溶液褪色,C项错误;a中所有原子可能共面,但b中所有原子不可能共面,D项错误。 3.(2019·昆明检测)已知:①Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH1=-259.7 kJ·mol-1 ②2Hg(l)+O2(g)===2HgO(s) ΔH2=-181.6 kJ·mol-1 下列有关说法正确的是( B ) A.ΔH2>ΔH1,可说明②的活化能大于①的活化能 B.由①、②可推知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1 C.201 g液态汞与氧气完全反应生成氧化汞固体,放热181.6 kJ D.相同条件下,1 mol Zn(s)和1 mol HgO(s)的总能量低于1 mol ZnO(s)和1 mol Hg(l)的总能量 解析:反应热只与反应物和生成物的总能量差有关,与反应的活化能大小无关,A错误;根据盖斯定律,2×①+②得目标反应,B正确;由②可知2 mol液态汞(即402 g)与氧气完全反应生成氧化汞固体,放热181.6 kJ,C错误;反应①是放热反应,相同条件下,1 mol Zn(s)和1 mol HgO(s)的总能量高于1 mol ZnO(s)和1 mol Hg(l)的总能量,D错误。 4.A、B、C、D为原子序数依次增大的短周期元素。已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物。化合物a~g的转化关系如图所示(部分产物已略去)。下列说法错误的是( A ) 5 A.简单离子半径的大小:C>D>B B.a中只含共价键,属于共价化合物 C.在水溶液中,b、g均呈酸性,c、f均呈碱性 D.工业上通过电解其氧化物的方法制取D的单质 解析:A、B、C、D为原子序数依次增大的短周期元素。已知A的某种单质是自然界中硬度最大的物质,A为碳元素;C元素是短周期主族元素中原子半径最大的元素,C为钠元素;a为A的最高价氧化物,a为CO2,b、c、d分别为B、C、D的最高价氧化物对应的水化物,即分别为HNO3、NaOH、Al(OH)3。A—C、B—N、C—Na、D—Al;a—CO2、b—HNO3、c—NaOH、d—Al(OH)3、e—可以是NH3·H2O、f—NaAlO2、g—Al(NO3)3。电子层结构相同的离子,核电荷数越大,半径越小,简单离子半径的大小:N3->Na+>Al3+,故A错误;a为CO2,只含共价键,属于共价化合物,故B正确;在水溶液中,b—HNO3、g—Al(NO3)3均呈酸性,c—NaOH、f—NaAlO2均呈碱性,故C正确;工业上通过电解Al2O3的方法制取Al的单质,D正确。 5.下列离子方程式中,能正确表达实验现象的是( D ) A.钠加入硫酸铜溶液中产生蓝色沉淀:2Na+Cu2+===2Na++Cu B.硫酸氢钠溶液中加入氢氧化钡溶液至恰好不再产生沉淀:Ba2++2OH-+2H++SO===BaSO4↓+2H2O C.磁性氧化铁溶于氢碘酸得到黄色溶液:Fe3O4+8H+===Fe2++2Fe3++4H2O D.饱和纯碱溶液中通入足量CO2产生沉淀:2Na++CO+H2O+CO2===2NaHCO3↓ 解析:钠加入硫酸铜溶液中产生蓝色沉淀的离子方程式为2Na+Cu2++2H2O===2Na++Cu(OH)2↓+H2↑,A项错误;硫酸氢钠溶液中加入氢氧化钡溶液至恰好不再产生沉淀的离子方程式为Ba2++OH-+H++SO===BaSO4↓+H2O,B项错误;磁性氧化铁溶于氢碘酸得到黄色溶液的离子方程式为Fe3O4+8H++2I-===3Fe2++4H2O+I2,C项错误;饱和纯碱溶液中通入足量CO2产生沉淀的离子方程式为2Na++CO+H2O+CO2===2NaHCO3↓,D项正确。 6.已知高能锂电池的总反应式为:2Li+FeS===Fe+Li2S[LiPF6·SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48 L。下列有关叙述不正确的是( C ) 5 A.从隔膜中通过的离子数目为0.4NA B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol·L-1 C.A电极为阳极 D.电源正极反应式为:FeS+2Li++2e-===Fe+Li2S 解析:本题考查电化学原理。由题意可知A极有0.4 mol H+放电,生成0.2 mol H2,A极为阴极,有0.4 mol K+由乙池通过隔膜进入甲池,即甲池中生成了0.4 mol KOH,甲池中KOH的浓度变为 mol·L-1=4 mol·L-1,则A、B项正确,C项错误;电源正极发生得电子的还原反应,D项正确。 7.常温下,下列有关指定溶液的说法中正确的是( A ) A.若NH4A溶液的pH=6,则c(A-)-c(NH)=9.9×10-7 mol·L-1 B.把0.2 mol·L-1的氨水与0.2 mol·L-1的盐酸混合,c(NH3·H2O)+c(NH)=c(Cl-) C.向0.01 mol·L-1的NH4HSO4溶液中滴加NaOH溶液至中性,则最后所得溶液中c(Na+)=c(SO)>c(H+)=c(OH-) D.将0.2 mol CO2缓慢通入含有0.3 mol NaOH的溶液中:c(CO)>c(HCO)>c(H2CO3) 解析:由电荷守恒原理得:c(NH)+c(H+)=c(OH-)+c(A-),c(A-)-c(NH)=c(H+)-c(OH-)=10-6 mol·L-1-10-8 mol·L-1=9.9×10-7 mol·L-1,A项正确;因氨水与盐酸的体积未知,故无法确定相应微粒浓度间的关系,B项错误;滴加溶液至中性,说明c(H+)=c(OH-),据电荷守恒分析,则最后所得溶液中c(Na+)+c(NH)=2c(SO)>c(H+)=c(OH-),C项错误;CO2与NaOH溶液反应得到0.1 mol NaHCO3、0.1 mol Na2CO3,因CO的水解程度大于HCO的水解程度,且CO水解会生成HCO,故溶液中c(HCO)>c(CO),D项错误。 5 5查看更多