2021届高考化学一轮复习课时作业16化学能与热能含解析鲁科版
课时作业16 化学能与热能
时间:45分钟
一、选择题
1.(2020·湖北八校联考)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是( C )
A.氧分子的活化包括O—O键的断裂与C—O键的生成
B.每活化一个氧分子放出0.29 eV的能量
C.水可使氧分子活化反应的活化能降低0.42 eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
解析:由题图可知,氧分子的活化是O—O键的断裂与C—O键的生成过程,A项正确;由题图可知反应物的总能量高于生成物的总能量,因此每活化一个氧分子放出的能量为0.29 eV,B项正确;无水时相对活化能为0.75 eV,有水时相对活化能为0.57 eV,活化能降低0.18 eV,C项错误;炭黑颗粒可以活化氧分子,而生成的活化氧可以快速氧化SO2,因此炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂,D项正确。
2.(2020·四川攀枝花统考)我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是( A )
A.图示显示:起始时的2个H2O都参与了反应过程
B.过程Ⅰ、过程Ⅱ均为放热过程
C.过程Ⅲ只生成了极性共价键
D.使用催化剂降低了水煤气变换反应的ΔH
8
解析:本题考查化学反应中水煤气变换反应中的能量变化,以及催化剂的催化机理。根据反应过程示意图,起始时的2个H2O分别在过程Ⅰ、过程Ⅱ中发生化学键的断裂,因此起始时的2个H2O都参与了反应过程,A项正确;根据反应过程示意图,过程Ⅰ、Ⅱ都发生了水分子中H—O键的断裂,化学键断裂为吸热过程,B项错误;过程Ⅲ中生成了H2,H2中的化学键为非极性共价键,C项错误;催化剂能改变反应的活化能,不能改变反应的ΔH,D项错误。
3.(2020·山西汾阳中学联考)化学键的键能是指气态基态原子形成1 mol化学键时所释放的能量,常用E表示。结合表中信息判断下列说法不正确的是( D )
共价键
H—H
F—F
H—F
C—F
C—Cl
C—I
E/(kJ·mol-1)
436
157
568
427
330
218
A.C—Br键键能的可能范围是218 kJ·mol-1
S(s),则等量的S(g)完全燃烧生成SO2(g)放出的热量多,故有ΔH1<ΔH2,A正确。等量H2S(g)完全燃烧生成SO2(g)放出的热量比不完全燃烧生成S(s)放出的热量多,则有ΔH3>ΔH4,B错误。根据盖斯定律,由③-②可得⑤,则有ΔH5=ΔH3-ΔH2,C正确。根据盖斯定律,由③×3-⑤×2可得④,则有2ΔH5=3ΔH3-ΔH4,D正确。
8
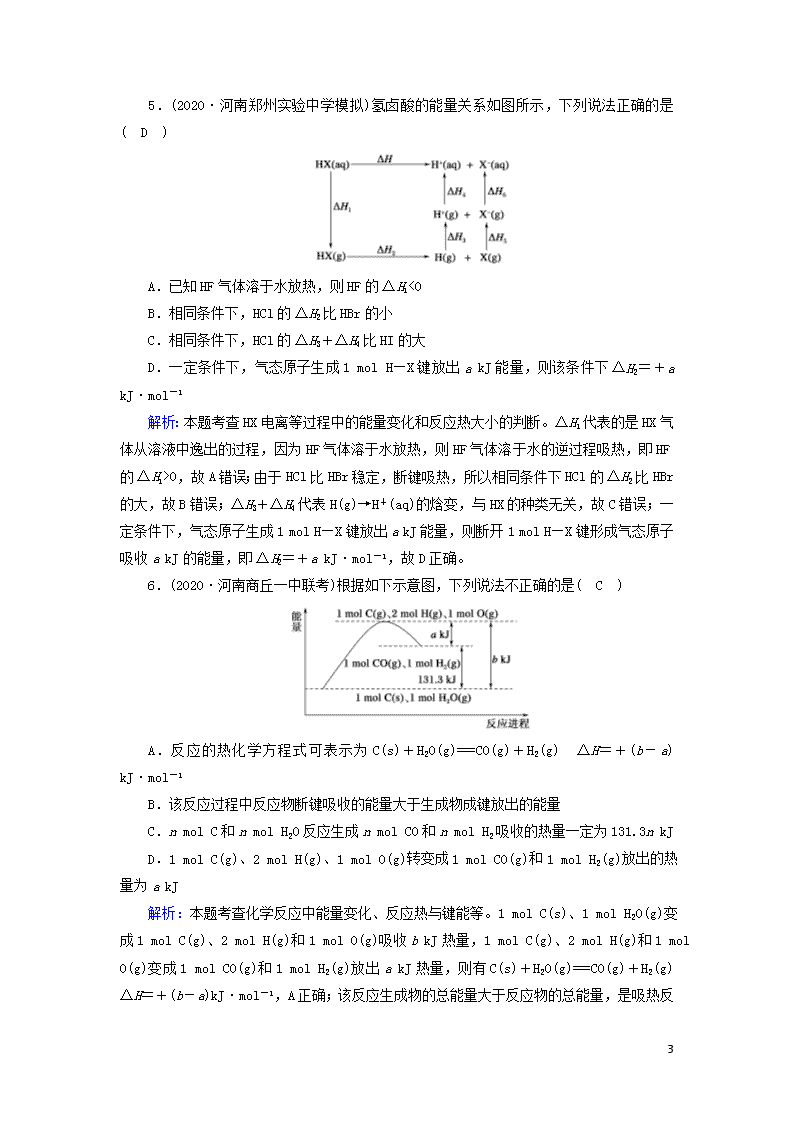
5.(2020·河南郑州实验中学模拟)氢卤酸的能量关系如图所示,下列说法正确的是( D )
A.已知HF气体溶于水放热,则HF的ΔH1<0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的ΔH3+ΔH4比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则该条件下ΔH2=+a kJ·mol-1
解析:本题考查HX电离等过程中的能量变化和反应热大小的判断。ΔH1代表的是HX气体从溶液中逸出的过程,因为HF气体溶于水放热,则HF气体溶于水的逆过程吸热,即HF的ΔH1>0,故A错误;由于HCl比HBr稳定,断键吸热,所以相同条件下HCl的ΔH2比HBr的大,故B错误;ΔH3+ΔH4代表H(g)→H+(aq)的焓变,与HX的种类无关,故C错误;一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则断开1 mol H—X键形成气态原子吸收a kJ的能量,即ΔH2=+a kJ·mol-1,故D正确。
6.(2020·河南商丘一中联考)根据如下示意图,下列说法不正确的是( C )
A.反应的热化学方程式可表示为C(s)+H2O(g)===CO(g)+H2(g) ΔH=+(b-a) kJ·mol-1
B.该反应过程中反应物断键吸收的能量大于生成物成键放出的能量
C.n mol C和n mol H2O反应生成n mol CO和n mol H2吸收的热量一定为131.3n kJ
D.1 mol C(g)、2 mol H(g)、1 mol O(g)转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
解析:本题考查化学反应中能量变化、反应热与键能等。1 mol C(s)、1 mol H2O(g)变成1 mol C(g)、2 mol H(g)和1 mol O(g)吸收b kJ热量,1 mol C(g)、2 mol H(g)和1 mol O(g)变成1 mol CO(g)和1 mol H2(g)放出a kJ热量,则有C(s)+H2O(g)===CO(g)+H2(g) ΔH=+(b-a) kJ·mol-1
8
,A正确;该反应生成物的总能量大于反应物的总能量,是吸热反应,则反应物断键吸收的能量大于生成物成键放出的能量,B正确;n mol C(s)和n mol H2O(g)反应生成n mol CO(g)和n mol H2(g)吸收的热量为131.3n kJ,若反应物和生成物的状态改变,则吸收热量的数值不同,C错误;由题图可知,1 mol C(g)、2 mol H(g)、1 mol O(g)转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ,D正确。
7.(2020·陕西汉中中学模拟)已知2H2O2(l)===2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法错误的是( C )
A.该反应是放热反应
B.途径Ⅱ与途径Ⅰ相比,可能是加入了催化剂
C.其他条件相同时,产生相同体积氧气放出的热量:途径Ⅰ>途径Ⅱ
D.其他条件相同时,产生相同体积氧气所需的时间:途径Ⅰ>途径Ⅱ
解析:本题考查化学反应中能量变化、活化能对化学反应速率的影响。由图可知,2 mol H2O2(l)具有的能量高于2 mol H2O(l)和1 mol O2(g)具有的总能量,则该反应是放热反应,A正确;途径Ⅱ与途径Ⅰ相比,途径Ⅱ的活化能降低,可能是加入了催化剂,B正确;催化剂只改变活化能,不改变ΔH,故相同条件时途径Ⅰ和途径Ⅱ产生相同体积氧气放出的热量相同,C错误;途径Ⅱ加入了催化剂,降低了活化能,反应速率加快,故相同条件时产生相同体积氧气所需时间:途径Ⅰ>途径Ⅱ,D正确。
8.(2020·河南豫南九校联考)下列说法正确的是( B )
A.氢气的燃烧热为285.8 kJ·mol-1,则分解水的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时,放出19.12 kJ热量,则Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1
C.500 ℃、30 MPa时,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出19.3 kJ热量,则N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则0.5 mol H2SO4和0.5 mol Ba(OH)2反应放出57.3 kJ热量
解析:本题考查燃烧热、中和热及热化学方程式的判断。氢气的燃烧热为285.8 kJ·mol-1,据此可得2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,根据热化学方程式的书写规则及方法,分解水的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1,A错误;9.6 g硫粉和11.2 g铁粉的物质的量分别为0.3 mol、0.2
8
mol,二者充分反应生成0.2 mol FeS(硫粉有剩余),放出19.12 kJ热量,则生成1 mol FeS(s)时放出的热量为19.12 kJ×5=95.6 kJ,B正确;N2和H2合成氨的反应是可逆反应,0.5 mol N2和1.5 mol H2充分反应放热19.3 kJ,此时生成的NH3(g)的物质的量小于1 mol,故N2(g)+3H2(g)2NH3(g)的ΔH≠-38.6 kJ·mol-1,C错误;0.5 mol H2SO4和0.5 mol Ba(OH)2反应生成1 mol H2O,同时生成0.5 mol BaSO4,生成BaSO4也会放热,故反应放出的热量大于57.3 kJ,D错误。
9.(2020·吉林长春田家炳实验中学月考)天然气可催化重整制备合成气(CO、H2),其有关反应如下:
①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1
②CH4(g)===C(s)+2H2(g) ΔH2=+75 kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH3=-111 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH4=-394 kJ·mol-1
下列说法正确的是( B )
A.反应②在较低温度下能自发进行
B.CO的燃烧热为283 kJ·mol-1
C.若3 mol C(s)燃烧生成1 mol CO(g)和2 mol CO2(g),则损失的热量为111 kJ
D.在上述反应①中,ΔH1=-247 kJ·mol-1
解析:本题考查燃烧热、反应热的计算、反应自发进行的方向等。反应②的正反应是气体分子数增加的吸热反应,则有ΔH>0、ΔS>0,欲使该反应自发进行,应满足ΔH-TΔS<0,故反应②在高温下能自发进行,A错误。根据盖斯定律,由④-③可得CO(g)+O2(g)===CO2(g),则该反应的ΔH=ΔH4-ΔH3=(-394 kJ·mol-1)-(-111 kJ·mol-1)=-283 kJ·mol-1,故CO的燃烧热为283 kJ·mol-1,B正确。3 mol C(s)燃烧生成1 mol CO(g)和2 mol CO2(g),损失热量等于1 mol CO(g)燃烧放出的热量,即283 kJ,C错误。根据盖斯定律,由②+③×2-④可得CH4(g)+CO2(g)===2CO(g)+2H2(g),则有ΔH1=(+75 kJ·mol-1)+(-111 kJ·mol-1)×2-(-394 kJ·mol-1)=+247 kJ·mol-1,D错误。
10.(2020·河南郑州外国语学校联考)已知几种共价键的键能数据如下表:
共价键
N—H
N≡N
Cl—Cl
H—Cl
Br—Br
H—Br
键能/(kJ·mol-1)
391
945
243
432
193
366
反应Ⅰ:2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH1
反应Ⅱ:2NH3(g)+3Br2(g)===N2(g)+6HBr(g) ΔH2
下列说法正确的是( A )
A.ΔH1=-462 kJ·mol-1
8
B.ΔH1>ΔH2
C.稳定性:HClHBr,C错误。根据盖斯定律,由×(Ⅰ-Ⅱ)可得2HBr(g)+Cl2(g)===Br2(g)+2HCl(g),则该反应的ΔH=,D错误。
二、非选择题
11.(2020·陕西韩城模拟)化学反应过程中发生物质变化的同时,常常伴有能量的变化。请回答下列问题:
(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
①第一步反应是放热(填“吸热”或“放热”)反应。
②1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。
(2)已知:
反应Ⅰ:CaSO4(s)+CO(g)===CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)===CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
反应Ⅲ:3CaSO4(s)+CaS(s)===4CaO(s)+4SO2(g) ΔH3
①反应Ⅲ中ΔH3=+1_049.2_kJ·mol-1。
②能使反应Ⅰ、Ⅱ速率加快的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙粉碎、搅拌等(写出其中的任意两条即可)(写出两条)。
解析:本题考查化学反应中能量的变化、热化学方程式的书写、反应速率的影响因素等。
8
(1)①第一步反应中,反应物具有的总能量高于生成物具有的总能量,则该反应是放热反应。
②由图可知,第一步、第二步反应的热化学方程式分别为ⅰ.NH(aq)+O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ·mol-1;ⅱ.NO(aq)+O2(g)===NO(aq) ΔH=-73 kJ·mol-1。根据盖斯定律,由ⅰ+ⅱ可得NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O(l),则该反应的ΔH=(-273 kJ·mol-1)+(-73 kJ·mol-1)=-346 kJ·mol-1。
(2)①分析题给热化学方程式,根据盖斯定律,由Ⅰ×4-Ⅱ可得反应Ⅲ,则反应Ⅲ中ΔH3=(+218.4 kJ·mol-1)×4-(-175.6 kJ·mol-1)=+1 049.2 kJ·mol-1。②欲使反应Ⅰ、Ⅱ速率加快,可采取的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙粉碎、搅拌等。
12.(2020·山东临沂平邑一中月考)氯及其化合物在生产、生活中应用广泛。
(1)已知:①Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔH1=-101.1 kJ·mol-1
②3NaClO(aq)===NaClO3(aq)+2NaCl(aq) ΔH2=-112.2 kJ·mol-1
则反应3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l)的ΔH=-415.5 kJ·mol-1。
(2)几种含氯离子的相对能量如下表所示:
离子
Cl-(aq)
ClO-(aq)
ClO(aq)
ClO(aq)
ClO(aq)
相对能量/
(kJ·mol-1)
0
60
101
63
38
①在上述五种离子中,最稳定的离子是Cl-(填离子符号,下同)最不稳定的离子是ClO。
②反应3ClO-(aq)===ClO(aq)+2Cl-(aq)的ΔH=-117_kJ·mol-1。
③写出ClO反应生成ClO和Cl-的热化学方程式:
4ClO(aq)===3ClO(aq)+Cl-(aq) ΔH=-138 kJ·mol-1。
(3)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.4 kJ·mol-1
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如图所示:
8
已知过程Ⅰ的反应为2HCl(g)+CuO(s)CuCl2(s)+H2O(g) ΔH1=-120.4 kJ·mol-1
①过程Ⅱ反应的热化学方程式为2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) ΔH2=+125.4 kJ·mol-1。
②过程Ⅰ流过的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为溶液由红色变为无色(或溶液红色变浅)。
解析:本题考查反应热的计算、热化学方程式的书写、盖斯定律的应用、实验现象的描述等。
(1)分析题给热化学方程式,根据盖斯定律,由①×3+②可得3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l),则有ΔH=3ΔH1+ΔH2=(-101.1 kJ·mol-1)×3+(-112.2 kJ·mol-1)=-415.5 kJ·mol-1。
(2)①物质具有的能量越高,其稳定性越弱,故最稳定的离子是Cl-,最不稳定的离子是ClO。
②ΔH=生成物的总能量-反应物的总能量,则反应3ClO-(aq)===ClO(aq)+2Cl-(aq)的ΔH=63 kJ·mol-1-3×60 kJ·mol-1=-117 kJ·mol-1。
③由ClO生成ClO和Cl-的反应为4ClO(aq)===3ClO(aq)+Cl-(aq),该反应的ΔH=3×38 kJ·mol-1-4×63 kJ·mol-1=-138 kJ·mol-1。
(3)①由图可知,过程Ⅱ(氧化)发生的反应为2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g)。将题给O2氧化HCl的热化学方程式编号为ⅰ,将过程Ⅰ反应的热化学方程式编号为ⅱ,其ΔH记为ΔH2,根据盖斯定律,由ⅰ-ⅱ×2可得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g),则有ΔH2=(-115.4 kJ·mol-1)-(-120.4 kJ·mol-1)×2=+125.4 kJ·mol-1。
②过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,则初期溶液呈红色,氯化结束时,HCl与NaOH溶液发生中和反应,溶液褪色。
8