吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试卷
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
3. 可能用到的相对原子质量:H—1 C—12 O—16 S—32 P—31 Al—27 Si—28
第I卷(选择题,共60分)
一、选择题(每小题只有一个选项,每题2分,共30分)
1.在恒温恒容下,某容器中进行如下反应:H22H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18s B.等于12s C.大于18s D.小于18s
2.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
A.2.5 μmol/( L·min)和2.0 μmol/L
B.2.5 μmol/( L·min)和2.5 μmol/L
C.3.0 μmol/( L·min)和3.0 μmol/L
D.5.0 μmol/( L·min)和3.0 μmol/L
3.甲、乙两容器均进行同一反应:A2B。甲容器内每分钟减少4 mol A,乙容器内每分钟减少2 mol A,则两者的化学反应速率相比( )
A.甲快 B.乙快 C.一样快 D.无法比较
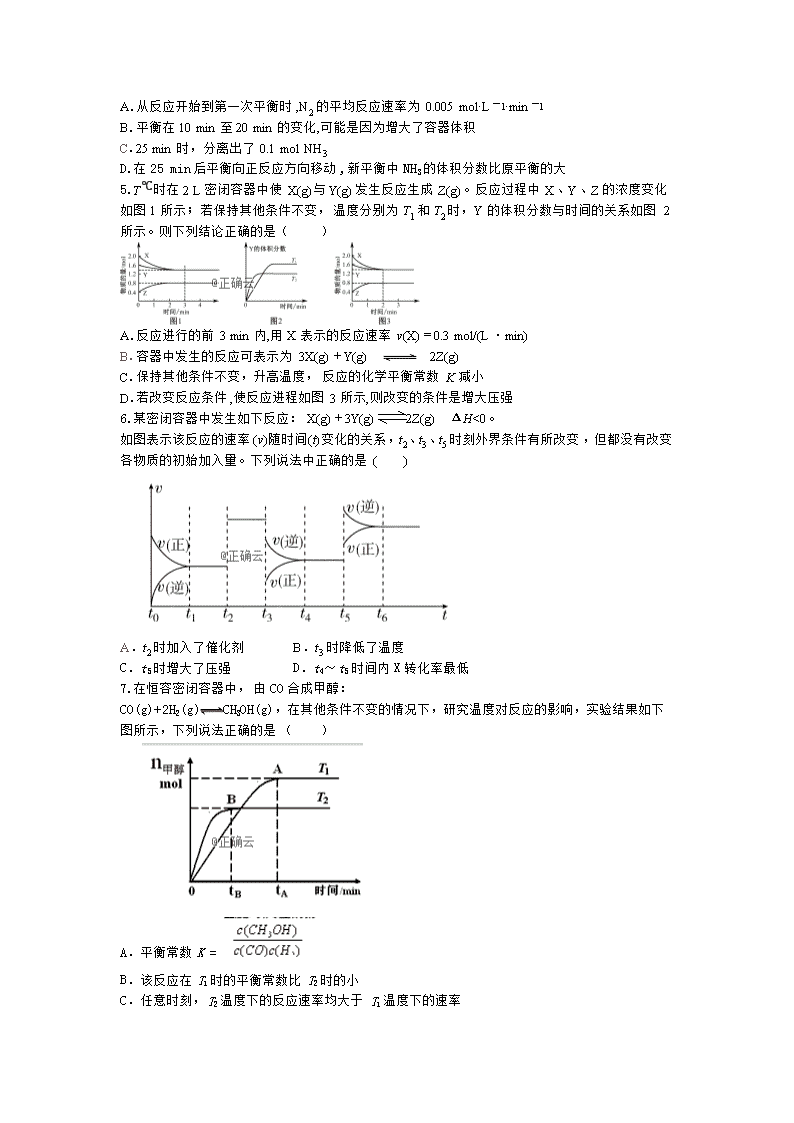
4.500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图所示,下列说法中正确的是( )
A.从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol·L-1·min-1
B.平衡在10 min至20 min的变化,可能是因为增大了容器体积
C.25 min时,分离出了0.1 mol NH3
D.在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的大
5.T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是( )
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
B.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
6.某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g) ΔH<0。
如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内X转化率最低
7.在恒容密闭容器中,由CO合成甲醇:
CO(g) + 2H2(g)CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是( )
A.平衡常数K =
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时
8.随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
9.反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是( )
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
10.一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤ C.③④⑤ D.①③④
11.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是( )
A.溶液中的Cl-起催化作用
B.溶液中的H+起催化作用
C.ClO2逸出,使反应的生成物浓度降低
D.在酸性条件下,亚氯酸钠的氧化性增强
12.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
① NaOH固体 ②H2O ③ NaCl固体 ④ CH3COONa固体 ⑤ KCl溶液
A.①② B.②③⑤ C.②④⑤ D.②④
13.可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2 ②a1
b2 ④b1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是( )
A. ②③⑤⑧ B.①④⑥⑧ C.②④⑤⑦ D.①③⑥⑦
14.在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/L B.Y2为0.45mol/L
C.X2为0.2mol/L D.Z为0.4mol/L
15.在体积一定的密闭容器中放入1L气体R和3L气体Q,在一定条件下发生反应R(g)+3Q(g)=X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的75%,则化学方程式中n的值是
A.2 B.3 C.4 D.5
二、选择题(每小题只有一个选项,每题3分,共30分)
16.将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2 B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3 D.3 mol SO2+1 mol SO3
17.在一真空密闭容器中盛有1 mol PCl5,加热到200 ℃,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
A.m>n B.mα1
D. A溶液的c(H+)是B溶液c(H+)的0.5α1倍
19.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
20.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2===HCN+NaNO2,
②NaCN+HF===HCN+NaF,
③NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
21.在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. B.c(H+)·c(OH-)
C. D.c(OH-)
22.下列所示的图与对应的叙述相符的是 ( )
a b c d
A.图a表示某吸热反应分别在有,无催化剂的情况下反应过程中的能量变化
B.图b表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,甲的压强比乙的压强大
C.图c表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.图d表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
23.下列有关实验原理、方法和结论都正确的是( )
A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42-
B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解
C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。
24.将氢氧化钠稀溶液滴到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
25.已知25℃时有关弱酸的电离平衡常数
弱酸
氢氟酸
硼酸[B(OH)3](一元酸)
草酸(H2C2O4)
电离平衡常数(25℃)
6.6×10-4
5.8×10-10
K1=5.9×10-2
K2=6.4×10-5
则下列有关说法不正确的是( )
A.硼酸为一元弱酸
B.amol·L-1 HF溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(F-),则b一定大于a
C.同温下,NaHC2O4溶液中HC2O4-的电离常数大于K2(草酸的二级电离)
D.NaHC2O4和Na2C2O4混合溶液中,一定存在
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
第II卷(非选择题,共40分)
26.(16分)在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为 (填化学式),V4+﹣O﹣H在反应过程中作 。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为 L。
(2) N2H4是发射航天火箭的常用燃料,已知:
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是 .
(3) 工业制硝酸时,会发生反应:
4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H<0。
① 若其它条件不变,则下列图象不正确的是 (填字母)。
②
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
c(NH3)/mol·L﹣1
c(O2)/mol·L﹣1
c(NO)mol·L﹣1
0
1.2
1.75
0
4min
0.4
0.75
0.8
6min
0.4
0.75
0.8
8min
0.6
1
0.6
9min
0.6
1
0.6
10min
1.05
1
1.05
12min
…
…
…
0~4min内,用O2表示该反应的平均反应速率为 mol·L﹣1·min﹣1。
反应6~8min时改变了反应条件,改变的反应条件可能是 。
27.(13分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
(1)定性分析:如图甲可通过观察______________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________。
(2)定量分析:如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________,为了减少实验误差,反应前后量气管两边液面的高度应保持一致,则在反应后应采取的操作方法是______________________。
28.(11分)在某一容积为2 L的密闭容器中,加入0.8 mol的H2和0.6 mol 的I2,在一定的条件下发生如下反应:
H2(g)+I2(g) 2HI(g) ΔH<0
反应中各物质的浓度随时间变化情况如图1:
图1 图2
(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为________。
(2)反应达到平衡后,第8 min时:①若升高温度,化学平衡常数K________(填“增大”、“减小”或“不变”),HI浓度的变化正确的是________(用图2中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是________(用图2中d~f的编号回答)。
(3)反应达到平衡后,第8 min时,若反应容器的容积扩大一倍,请在图3中画出8 min后HI浓度的变化情况。
第I卷(选择题 25小题 共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
C
B
D
C
B
A
D
B
A
B
A
C
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
A
A
C
B
A
D
B
A
D
A
D
B
第II卷(非选择题,共40分)
26.(16分) (1)N2;催化剂;44.8;
(2)190kJ;
(3)① D;
② 0.25;升高温度.
【解析】解:本题考查化学平衡的计算;有关反应热的计算;化学平衡的影响因素.
(1)由图1可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;V4+﹣O﹣H在反应前后不变,作催化剂;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:N2;催化剂;44.8;
(2)焓变=反应物总键能﹣生成物总键能,设断开1molN﹣N需要吸收的能量QkJ,则:Q+4×390+498﹣946﹣4×460=﹣538,解得Q=190;
故答案为:190kJ;
(3)①该反应是个气体体积增大、正反应放热的反应,
A、增大压强,反应逆向移动,氨气的转化率减小,且压强增大化学反应速率增大,缩短反应到达平衡的时间,所以图象符合,故A不选;
B、催化剂加快反应速率,但不改变平衡,所以图象符合,故B不选;
C、增大压强,逆向移动,NO的产率降低,所以图象符合,故C不选;
D、升高温度,反应逆向移动,水蒸气的含量降低,所以图象不符合,故D选;
故答案为:D;
②0~4min内,v(O2)=mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
故答案为:0.25;升高温度.
27.(13分)
(1)反应产生气泡快慢(或反应完成的先后,或试管壁的冷热程度) 将阴离子改为相同,排除阴离子的干扰
(2)分液漏斗 时间(或收集一定体积的气体所需要的时间) 慢慢将右面的量气管向下移动
【解析】(1)中的实验现象是看反应产生气泡的快慢;而为了确认其他离子不产生干扰,最好选择阴离子相同的可溶性铁盐和铜盐。
(2)定量分析,应比较相同时间内产生气体量的多少,所以选择量气管来测定单位时间内生成氧气的体积,对基本仪器的名称和操作要点的回答要准确无误。
28.(11分)
(1)0.167 mol/(L·min)
(2)①减小 c ②f
(3)
【解析】根据题中所给出的信息分析,本题重点考查的是影响化学反应速率的因素。