- 2021-07-07 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习常考题型大通关7化学反应与能量含解析
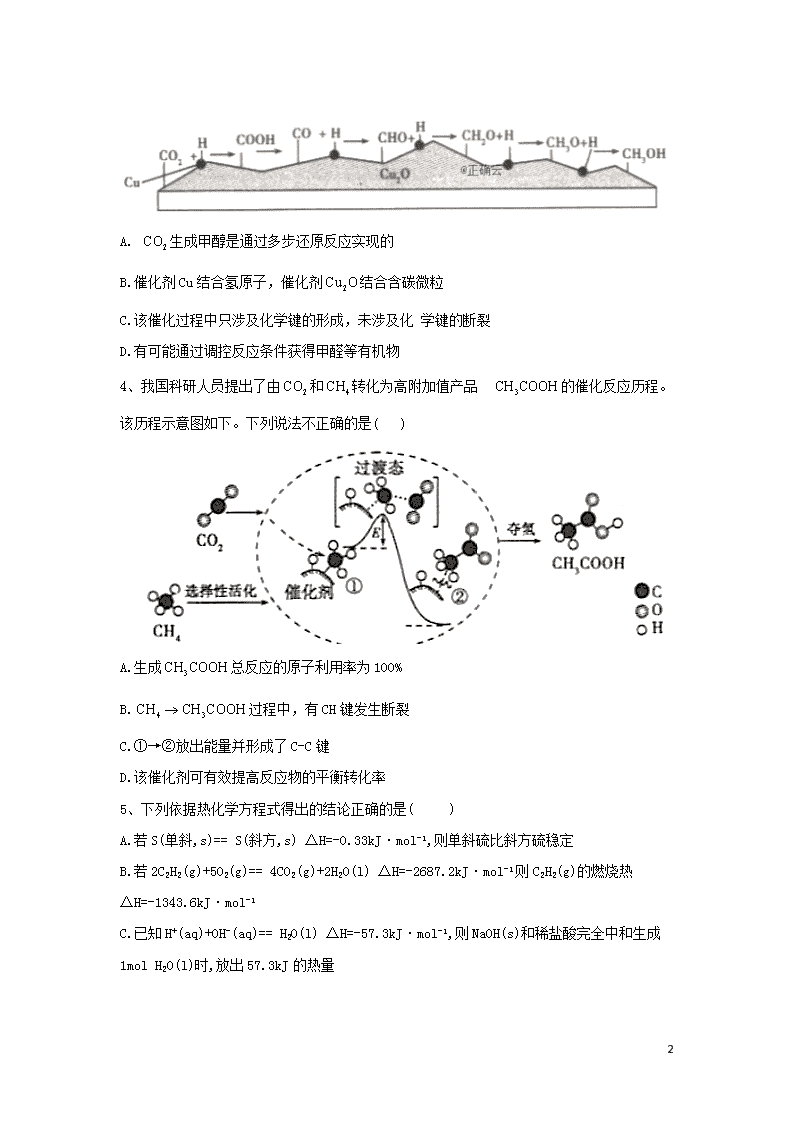
化学反应与能量 1、某科研人员提出HCHO与在羟基磷灰石(HAP)表面催化氧化生成、的历程,该历程示意图如下(图中只画出了HAP的部分结构): 下列说法不正确的是( ) A.HAP能提高HCHO与的反应速率 B.HCHO在反应过程中,有C—H键发生断裂 C.产物分子中的氧原子全部来自 D.该反应可表示为: 2、氮及其化合物的转化过程如下图所示。下列分析合理的是( ) A.催化剂a表面发生了极性共价键的断裂和形成 B.与反应生成的原子利用率为100% C.在催化剂b表而形成氮氧键时,不涉及电子转移 D.催化剂a、b能提高反应的平衡转化率 3、我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和,在 水溶液中用H原子将高效还原为重要工业原料之一的甲醇,反应机理如下图。下列有关说法不正确的是( ) 13 A. 生成甲醇是通过多步还原反应实现的 B.催化剂Cu结合氢原子,催化剂结合含碳微粒 C.该催化过程中只涉及化学键的形成,未涉及化 学键的断裂 D.有可能通过调控反应条件获得甲醛等有机物 4、我国科研人员提出了由和转化为高附加值产品 的催化反应历程。该历程示意图如下。下列说法不正确的是( ) A.生成总反应的原子利用率为100% B.过程中,有CH键发生断裂 C.①→②放出能量并形成了C-C键 D.该催化剂可有效提高反应物的平衡转化率 5、下列依据热化学方程式得出的结论正确的是( ) A.若S(单斜,s)== S(斜方,s) ΔH=-0.33kJ·mol-1,则单斜硫比斜方硫稳定 B.若2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(l) ΔH=-2687.2kJ·mol-1则C2H2(g)的燃烧热ΔH=-1343.6kJ·mol-1 C.已知H+(aq)+OH-(aq)== H2O(l) ΔH=-57.3kJ·mol-1,则NaOH(s)和稀盐酸完全中和生成1mol H2 13 O(l)时,放出57.3kJ的热量 D.已知2H2S(g)+O2(g)== 2S(g)+2H2O(l) ΔH1,2H2S(g)+3O2(g)== 2SO2(g)+2H2O(l) ΔH2,则ΔH1<ΔH2 6、断裂1mol化学键所需要的能量如下: 化学键 N-N O=O N≡N N-H 键能 a 500 942 194 肼()的有关反应能量变化如图所示,下列说法正确的是( ) A.该图表示:1mol与1mol反应生成1mol和2mol反应热△H=-2752 B.a=154 C. D.当有2mol (g)生成时,放出534的热量 7、四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下: ① ② 下列说法正确的是( ) 13 A.C的燃烧热是-110.45 B.若反应① 中使用催化剂加快反应速率,单位时间内吸收更多热量,则变大 C.反应① 中的能量变化如上图所示 D.反应 8、N2O和CO是环境污染性气体,可在表面转化为无害气体,其反应原理为△H,有关该反应的能量变化过程及物质变化过程如下,下列说法中不正确的是( ) A. B. C.该反应正反应的活化能小于逆反应的活化能 D.为了实现转化需不断向反应容器中补充和 9、一定条件下,在水溶液中1mol (x=0,1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法错误的是( ) 13 A.上述离子中结合H能力最强的是E B.上述离子中最稳定的是A C.C→B+D反应的热化学方程式为 △H=-76 kJ·mol-1 D.B→A+D的反应物的键能之和小于生成物的键能之和 10、“可燃冰”属于一种包合物类型的新能源,某种“可燃冰”结构模型如 图所示。包合物中的可燃性气体分子可以是甲烷 分子,也可以是其他烃类分子。下列说法不正确 的是( ) A.“可燃冰”是一种不可再生的清洁能源 B.“可燃冰”在常温常压下不能稳定存在 C.等质量的甲烷与气体分子为甲烷的“可燃冰”分 别完全燃烧,“可燃冰”放出热量多 D.“可燃冰”中水肝与气体分子之间不存在化学键 11、肼是一种常见的还原剂,不同条件下分解产物不同。60 ~300℃时,在等金属表面肼分解的机理如图。 已知200℃时: Ⅰ. Ⅱ. 13 下列说法不正确的是( ) A.肼属于共价化合物 B.图示过程①、②都是吸热反应 C.反应Ⅰ中氧化剂与还原荆的物质的量之比为2:1 D.200℃时,肼分解的热化学方程式为 12、某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成的效率,原理示意如下: 下列分析不合理的是( ) A.状态Ⅰ,吸收能量并有N≡N键发生断裂 B.合成总反应的原子利用率是100% C.“TM﹣LiH”能降低合成氨反应的△H D.生成: 13、研究表明CO与在Fe作用下发生反应的能量变化及反应历程如图所示,两步反应分別为: ① (慢):② (快)。下列说法正确的是( ) A.反应①是氧化还原反应,反应②是非氧化还原反应 B.两步反应均为放热反应,总反应的化学反应速率由反应②决定 C.使反应的活化能减小,是中间产物 13 D.若转移1 mol电子,则消耗11. 2 L 14、固体表面的化学过程研究对于化学工业非常重要。在Fe作催化剂、一定压强 和温度下合成氨的反应机理如下图所示:下列说法不正确的是( ) A.N2和H2分子被吸附在铁表面发生反应 B. 吸附在铁表面的N2断裂了键 C.NH3分子中的N—H键不是同时形成的 D.Fe催化剂可以有效提高反应物的平衡转化率 15、厌氧氨化法(Anammox)是一种新喷的氨氮去除技术,下列说法中不正确的是( ) A. 1 mol所含的质子总数为10 B.联氨()中含有极性键和非极性键 C.过程Ⅱ属于氧化反应,过程Ⅳ属于还原反应 D.过程I中,参与反应的与的物质的量之比为1 :1 13 答案以及解析 1答案及解析: 答案:C 解析:A项,由信息可知,HAP在反应中作催化剂,可以提高化学反应速率:B项,由信息可知,HCHO与反应生成和,因此一定涉及C—H键的断裂;C项,根据图示信息中的一个O原子源于,另一个O原子源于HCHO;D项,根据图示信息可知,该反应为 2答案及解析: 答案:B 解析: A项,观察图像知,在催化剂a的表面和发生反应合成氨 气,故催化剂a表面发生了非极性共价键的断裂和极性共价键的形成,错误;B项,与反应生成为化合反应,原子利用率为 100%,正确;C项,在催化剂b表面形成氮氧键时,氧元素的化合价发生了变化,涉及电子转移,错误;D项,催化剂a、b能改变化学反 应速率,但不能提高反应的平衡转化率,错误。 13 3答案及解析: 答案:C 解析: A项,根据图中提示可以发现甲醇的生成路径是一个逐渐加氢 的过程,在有机反应中,加氢属于还原反应过程,正确;B项,根据图示可知,“黑色圆球状”阁示代表Cu,与H原子结合,“灰色锯齿状” 图示代表,与含碳微粒结合,正确;C项,二氧化碳中的C = O键在流程中断裂,错误;D项,反应路径中产生醛基(一CHO),可以 控制反应条件使路径停在这一步产生甲醛,正确。 4答案及解析: 答案:D 解析:与转化为的总反应为,该反应的原子利用率为100%,A正确;由图示反应历程可知,反应过程中中四个C-H键中的一个发生了断裂,B正确;由图示反应历程可知,①→②的过程中形成了C-C键,且反应物的总能量高于生成物的总能量,则该过程放出能量,C正确催化剂通过改变反应的活化能来改变反应速率,而不能使平衡发生移动,即不能改变反应物的平衡转化率,D错误 5答案及解析: 答案:B 解析:A项,由热化学方程式可知单斜硫具有的能量比斜方硫高,而能量越高越活泼,所以斜方硫比单斜硫更稳定,错误;B项,燃烧热指的是在25℃、101kPa下,1mol纯物质完全燃烧生成稳定的化合物所放出的热量,正确;C项,NaOH溶解要释放热量,则该反应生成1mol H2O(l)时,放出的热量大于57.3kJ,错误;D项,因两个反应都是放热反应,放热反应的ΔH<0,而完全燃烧放出的热量多,所以ΔH1>ΔH2,错误。 6答案及解析: 答案:B 解析:该图能表示反应的热化学方程式为,A 不正确;结构式为 13 ,,a = 154, B 正确; ,C不正确;1 mol与 1 mol反应生成 1 mol和 2 mol时放出534 kJ的热量,D不正确。 7答案及解析: 答案:D 解析: C的燃烧热对应的燃烧产物为,A项错误;使用催化剂不能 改变焓变,B项错误;反应①是吸热反应,生成物总能量高于反应物总能量,C项错误;根据盖斯定律,①+2②得D 项正确。 8答案及解析: 答案:D 解析:① ②,结合盖斯定律,①+②可得,故A正确;由图示分析可知,反应杨的总能量高于生成物的总能量,为放热反应,△H=生成物总能量-反应物总能量=,故B正确;正反应的活化能小于逆反应的活化能,故C正确;① ② ,反应过程中和参与反应后又生成,不需要补充,故D错误 9答案及解析: 答案:A 解析:A.酸性越弱的酸,其结合氢离子能力越强,次氯酸是最弱的酸,所以结合氢离子能力最强的为B(CIO-),故A错误;B.A、B,C、D、E中A能量最低,所以A最稳定,故B正确;C.C 13 →B+D,由电子守恒得该反应方程式为,ΔH=(64 kJ/mol + 60 kJ/mol)-2× 100 kJ/mol=-76 kJ/mol,热化学方程式为 ΔH=-76 kJ.mol-1,故C正确;D.B→A+D,由电子守恒得该反应方程式为,ΔH = (64 kJ/mol+2×0 kJ/mol)-3 × 60 kJ/mol=-116 kJ/mol,为放热反应,反应物的键能之和小于生成物的键能之和,故D正确。 10答案及解析: 答案:C 解析:“可燃冰”属于化石能源,是一种不可再生的能源,烃类气体分 子完全燃烧生成和,属于清洁能源,A正确;“可燃冰”必 须在低温高压条件下形成.在常温常压下不能稳定存在,B正确;等 质量的甲烷与气体分子为甲烷的“可燃冰”,“可燃冰”含的物 质的量少,分别完全燃烧时.甲烷放出热量多,C错误;“可燃冰”的水分子与气体分子之间的相互作用属于分子间作用力,不存在化学键,D正确。 11答案及解析: 答案:B 解析:分子中含有N—H键、N—N键,均为共价键,肼属于共价 化合物,故 A 正确;,说明过程①是放热反应,故B错误;反应中,,N的化合价升高,作还原剂,,N的化合价降低,作氧化剂,生成和的物质的 量之比为4: 1,所以氧化剂与还原剂的物质的量之比为2 :1,故C 正确;根据盖斯定律:(Ⅰ)式-2 ( Ⅱ )式得,故D正确。 12答案及解析: 答案:C 13 解析: A项,观察原理示意图知,状态I为转化为氮原子的过程, 该过程发生:N≡N键的断裂.吸收能量;B项,合成氨反应是化合反应,原子利用率为100 %;C项,“ TM - LiH ”是催化剂,催化剂不能改变反应的;D项,结合原理示意图知,生成的反应为。 13答案及解析: 答案:C 解析:A.反应①、②均有元素化合价的升降,因此 都是氧化还原反应,A错误;B.由图可知,、两步中均为反应物总能量大于生成物总能量.所以两个反应都 是放热反应,总反应的化学反应速率由速率慢的反应 ①决定,B错误;C. 作催化剂,使反应的活化能减小,是反应过程中产生的物质,因此是中间产物,C正确;D.由于没有指明外界条件,所以不能确定 气体的体积,D错误。 14答案及解析: 答案:D 解析:A项,由2、3可知N2和H2分子被吸附在铁表面,而4、5、6、7表示 发生反应,所以N2和H2分子被吸附在铁表面发生反应,正确;B项, 由4可知氮气吸附在铁表面,并断裂了键,正确;C项,由5、6、7 可知,NH3分子中的N—H键不是同时形成的,正确;D项,催化剂能 改变化学反应速率,不能提高反应物的平衡转化率,错误。 15答案及解析: 答案:A 解析: N原子的质子数为7,H原子的质子数为1,1 中含有质子总数为11,故A错误;联氨()的结构式为,含有极性键和非极性键,故B正确;过程Ⅱ中,N元素化合价由-2 价升高到-1价,发生氧化反应,过程IV中,N元素化合价由 + 3价降低到-1价,发生还原反应,故C正确:中N元素显-3价,中N元素显-1价, 中N元素显-2价,根据得失电子守恒可 知过程I中与的物质的量之比为1:1,故D正确。 13 13查看更多