- 2021-07-07 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习第7章化学反应速率化学平衡第21讲化学反应速率教学案新人教版
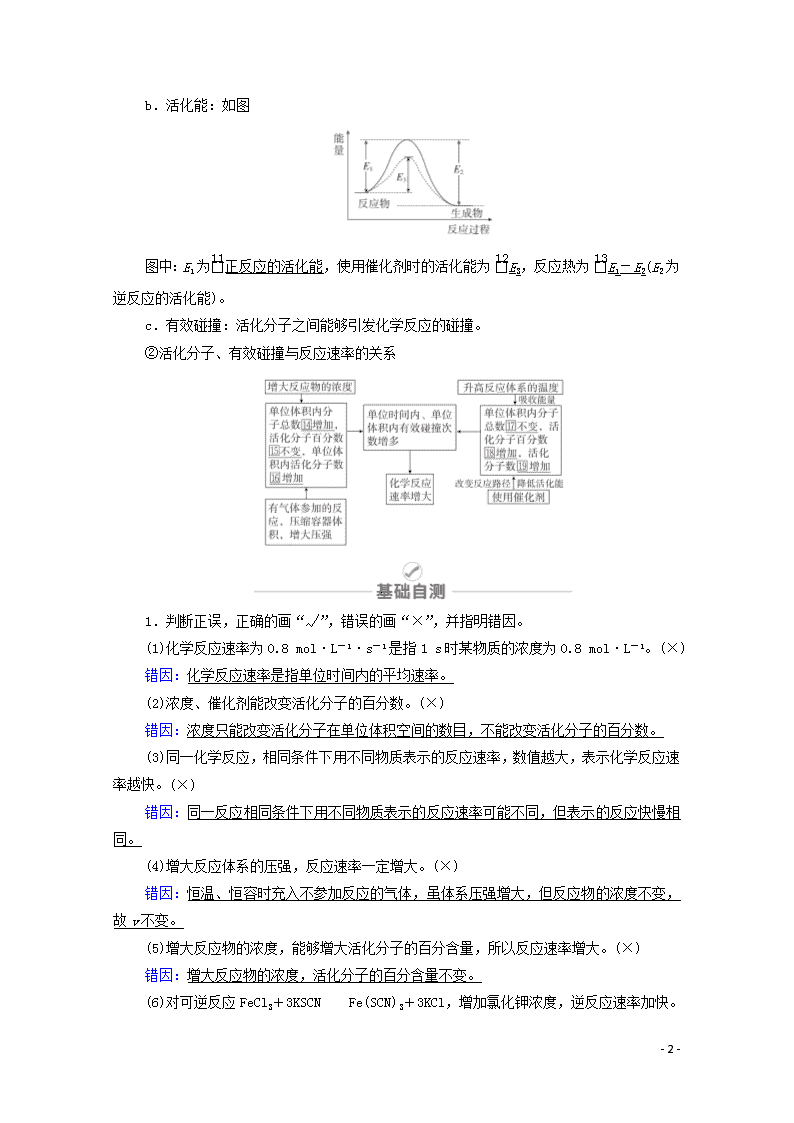
第七章 化学反应速率 化学平衡 [考纲解读] 1.了解化学反应速率的概念、反应速率的定量表示方法。能正确计算化学反应的转化率(α)。2.了解反应活化能的概念,了解催化剂的重要作用。3.了解化学反应的可逆性及化学平衡的建立。4.掌握化学平衡的特征。了解化学平衡常数(K)的含义。能利用化学平衡常数进行相关计算。5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。6.了解化学反应速率和化学平衡的调控在生产、生活和科学研究领域中的重要作用。 第21讲 化学反应速率 1.化学反应速率 2.化学反应速率的影响因素 (1)内因(根本因素) 反应物本身的性质。 (2)外因(其他条件不变,只改变一个条件) (3)理论解释——有效碰撞理论 ①活化分子、活化能、有效碰撞 a.活化分子:能够发生有效碰撞的分子。 - 13 - b.活化能:如图 图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2(E2为逆反应的活化能)。 c.有效碰撞:活化分子之间能够引发化学反应的碰撞。 ②活化分子、有效碰撞与反应速率的关系 1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1。(×) 错因:化学反应速率是指单位时间内的平均速率。 (2)浓度、催化剂能改变活化分子的百分数。(×) 错因:浓度只能改变活化分子在单位体积空间的数目,不能改变活化分子的百分数。 (3)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快。(×) 错因:同一反应相同条件下用不同物质表示的反应速率可能不同,但表示的反应快慢相同。 (4)增大反应体系的压强,反应速率一定增大。(×) 错因:恒温、恒容时充入不参加反应的气体,虽体系压强增大,但反应物的浓度不变,故v不变。 (5)增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大。(×) 错因:增大反应物的浓度,活化分子的百分含量不变。 (6)对可逆反应FeCl3+3KSCNFe(SCN)3 - 13 - +3KCl,增加氯化钾浓度,逆反应速率加快。(×) 错因:该反应的离子方程式为Fe3++3SCN-Fe(SCN)3,所以改变KCl的量对该反应无影响。 (7)已知反应①N2+3H22NH3 ΔH<0,反应②C+CO2===2CO ΔH>0,升温时,反应①速率增大,反应②速率减小。(×) 错因:升高温度时,反应①、②的速率均增加。 2.教材改编题 (据人教选修四P19T5)某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经t min后,测得各物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.6 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的化学方程式可表示为( ) A.2X2+3Y22X2Y3 B.3X2+2Y22X3Y2 C.X2+2Y22XY2 D.2X2+Y22X2Y 答案 B 解析 量减少的是反应物、量增多的是生成物,且改变量的比值等于方程式中的系数之比。即:aX2(g)+bY2(g)=cZ(g),a∶b∶c=(1-0.4)∶(1-0.6)∶0.4=0.6∶0.4∶0.4=3∶2∶2。 考点一 化学反应速率及有关的计算 [解析] 设4 min时,生成6x mol H2O(g) 4NH3(g)+3O2(g)2N2(g)+6H2O(g) 起始量(mol) 4 3 0 0 变化量(mol) 4x 3x 2x 6x 4 min量(mol) 4-4x 3-3x 2x 6x 据题意,则有:=0.4 解得:x=0.5 则4 min内H2O的变化浓度为Δc(H2O)==1.5 mol·L-1 v(H2O)==0.375 mol·L-1·min-1, - 13 - 再由各物质表示的速率之比等于各物质的化学计量数之比,可得各物质表示的反应速 率分别为v(N2)=0.125 mol·L-1·min-1,v(NH3)=0.250 mol·L-1·min-1, v(O2)=0.1875 mol·L-1·min-1。 [答案] C 1.有关化学反应速率的注意事项 (1)化学反应速率一般指平均速率而不是某一时刻的瞬时速率,且无论用反应物还是用生成物表示均取正值。 (2)不能用固体或纯液体物质表示化学反应速率,因为固体或纯液体物质的浓度视为常数。 2.化学反应速率计算的三个方法 (1)定义式法:v(B)==。 (2)比例关系法:化学反应速率之比等于化学计量数之比,如mA(g)+nB(g)===pC(g)中,v(A)∶v(B)∶v(C)=m∶n∶p。 (3)三段式法:列起始量、转化量、最终量,再根据定义式或比例关系计算。 例如:反应mA(g)+nB(g)pC(g) 起始浓度(mol·L-1) a b c 转化浓度(mol·L-1) x 某时刻浓度(mol·L-1) a-x b- c+ 3.化学反应速率大小的比较方法 (1)同一物质比较法。换算成同一物质且相同单位表示的速率,再比较数值的大小。 (2)归一法。当化学反应速率单位一致时,可用各物质的速率除以该物质前面的化学计量数,即全部“归一”,然后比较,数值大的反应速率最大。 注意 无论采用何种方法,都要确保所比较物质的速率单位统一。 1.反应4A(s)+3B(g)2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( ) A.用A表示的反应速率是0.8 mol·L-1·s-1 B.分别用B、C、D表示的反应速率,其比值是3∶2∶1 C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1 D.在这2 min内用B和C表示的反应速率的值相同 答案 B 解析 - 13 - A项,A物质是固体,浓度视为常数,不能用来表示反应速率,错误;化学反应速率之比等于相应物质的化学计量数之比,即分别用B、C、D表示的反应速度比值为3∶2∶1,B正确、D错误;C项,v(B)= mol·L-1·min-1=0.3 mol·L-1·min-1,但化学反应速率是平均速率,不是瞬时速率,错误。 2.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1。 下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>① 答案 B 解析 用归一法进行反应速率大小的比较,v(A)=0.45 mol·L-1·s-1;v(B)=×0.6=0.2 mol·L-1·s-1;v(C)=×0.4=0.2 mol·L-1·s-1;v(D)=×0.45=0.225 mol·L-1·s-1,故①>④>②=③,B正确。 考点二 化学反应速率的影响因素 [解析] 从图中四条曲线可判断a反应最快,d反应最慢,A正确;第1、2、4组实验温度相同,1、2组铁为粉末状,反应速率:1>2>4,故第1组实验中盐酸浓度大于2.5 mol·L-1,第2组实验中盐酸的浓度等于2.5 mol·L-1,B、C正确;若第3组实验的温度低于30 ℃,在其他条件都相同的情况下反应速率应该比第4组慢,与实验事实不符,D错误。 [答案] D 1.外界因素对速率的影响的几点说明(其他条件不变,只改变一个条件) (1)升高温度,不论是放热反应还是吸热反应,化学反应速率均加快。 - 13 - (2)催化剂能同等程度的改变正、逆化学反应速率,但不能改变反应进行的程度。 (3)压强及惰性气体对化学反应速率的影响 ①改变压强,实质是通过改变物质的浓度来实现化学反应速率改变的。若压强改变导致了反应物浓度增大或减小,则化学反应速率会增大或减小。 ②根据上述第①条原则,充入惰性气体对化学反应速率的影响可分为以下两种情况: 恒温恒容 充入“惰性气体”总压强增大,但各物质的浓度不变(活化分子浓度不变),反应速率不变 恒温恒压 充入“惰性气体”体积增大各反应物浓度减小(活化分子浓度减小)反应速率减慢 ③对于没有气体参加的反应,改变体系压强,反应物的浓度不变,则化学反应速率不变。 (4)固体反应物量的增减,不能改变化学反应速率,固体的表面积改变才能改变化学反应速率。 2.“控制变量法”的解题方法 3.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 ( ) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A.①④ B.②③ C.①③ D.②④ 答案 C 解析 ①固体用量的改变对速率几乎没有影响,符合题意;②容器的体积缩小一半,压强增大各物质的浓度增大,速率增大,不符合题意;③保持体积不变,充入N2使体系压强增大,但各物质的浓度保持不变,速率不变,符合题意;④保持压强不变,充入N2 - 13 - 使容器体积变大,各物质的浓度减小,速率减小,不符合题意。 4.(2019·北京海淀高三期末)含氮、磷污水过量排放引起的水体富营养化是当前备受关注的环境问题。 氮的化合物在水中被细菌分解,当氧气不充足时,在反硝化细菌的作用下,细菌利用有机物(又称碳源,如甲醇)作为电子供体,将硝态氮的化合物(含NO)连续还原最终生成N2,发生反硝化作用。 (1)某小组研究温度对反硝化作用的影响。在反应器内添加等量的相同浓度的甲醇溶液,从中取污泥水混合液分置于4个烧杯中,使4个烧杯内的温度不同,将实验数据作图(如图)。由图像分析产生差异的原因是____________________________________________。 (2)某小组研究浓度对反硝化作用的影响。 ①保持其他条件相同,在反应器内添加不等量的甲醇溶液,使4个烧杯碳源浓度依次为183 mg·L-1、236 mg·L-1、279 mg·L-1和313 mg·L-1。该小组预测反硝化速率变化的趋势是增大,预测依据是________________________________________________________。 ②碳源为183 mg·L-1的污水经过2 h的反硝化试验,可使NO由15.0 mg·L-1降至8.8 mg·L-1。已知M(NO)=62 g·mol-1,NO的转化速率是________mol·(L·h)-1。 答案 (1)其他条件不变时,温度升高,反硝化细菌活性随之增强,对NO的降解(或反硝化作用)速率也加快 (2)①甲醇是反硝化反应的反应物(还原剂),其他条件不变时,增大反应物的浓度,反应速率加快 ②5×10-5 解析 (2)②令溶液的体积为1 L,消耗n(NO)==1×10-4 mol,NO的转化速率=1×10-4 mol÷(1 L×2 h)=5×10-5mol·(L·h)-1。 建议用时:40分钟 满分:100分 一、选择题(每题9分,共72分) 1.下列有关化学反应速率的认识正确的是( ) A.对于任何化学反应来说,化学反应速率越大,反应现象就越明显 - 13 - B.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故化学反应速率增大 D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成 答案 D 解析 反应速率的大小与反应现象是否明显没有直接关系,如H+和OH-的反应几乎在瞬间完成,没有明显现象,A错误,D正确;固体或纯液体的浓度是常数,即Δc=0,所以一般不用固体或纯液体表示化学反应速率,B错误;催化剂不改变分子的能量,分子运动没有加快,C错误。 2.在一定条件下发生反应2A(g)===2B(g)+C(g),将2 mol A通入2 L容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A的物质的量为0.8 mol。用B的浓度变化来表示该反应的速率为 ( ) A.0.24 mol/(L·min) B.0.08 mol/(L·min) C.0.06 mol/(L·min) D.0.12 mol/(L·min) 答案 D 解析 v(A)===0.12 mol/(L·min),v(B)=v(A)=0.12 mol/(L·min)。 3.下列说法正确的是( ) ①活化分子间的碰撞一定能发生化学反应 ②普通分子有时也能发生有效碰撞 ③升高温度会加快反应速率,原因是增加了单位时间、单位体积活化分子的有效碰撞次数 ④增大反应物浓度会加快反应速率的原因是单位时间、单位体积内有效碰撞的次数增多 ⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大 ⑥化学反应实质是活化分子有合适取向时的有效碰撞 A.①②⑤ B.③④⑥ C.③④⑤⑥ D.②③④ 答案 B 解析 - 13 - ①活化分子间的碰撞不一定为有效碰撞,则不一定发生化学反应,错误;②普通分子间的碰撞,达不到反应所需的能量,则不能发生化学反应,错误;③升高温度会加快反应速率,原因是增加了单位时间、单位体积活化分子的有效碰撞次数,正确;④增大反应物浓度会加快反应速率的原因是单位时间、单位体积内有效碰撞的次数增多,正确;⑤使用催化剂能提高反应速率,原因是降低了活化能,使有效碰撞频率增大,错误;⑥活化分子有合适取向时发生的碰撞一定发生化学反应,正确。 4.在四个不同的容器中,在不同的条件下进行合成氨反应:N2+3H22NH3。根据在相同时间内测定的结果判断,生成氨的速率最快的是( ) A.v(H2)=0.01 mol·L-1·s-1 B.v(N2)=0.3 mol·L-1·min-1 C.v(NH3)=0.15 mol·L-1·min-1 D.v(H2)=0.3 mol·L-1·min-1 答案 B 解析 在速率单位相同时,把速率除以其相应物质的化学计量数,数值大者,反应速率快。由此可知,B项中表示的反应速率最快。 5.一定温度下,在某密闭容器中发生反应:2HI(g)H2(g)+I2(s) ΔH>0,若在15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( ) A.0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1 B.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s C.升高温度正反应速率加快,逆反应速率减慢 D.减小反应体系的体积,化学反应速率加快 答案 D 解析 该温度下,I2为固体,不能用来表示化学反应速率,A错误;0~15 s内,v(HI)==0.002 mol·L-1·s-1,若反应速率不变,c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需反应时间应为10 s,但随着反应的进行,c(HI)减小,v(HI)也减小,故所需时间应大于10 s,B错误;升高温度,正逆反应速率都增大,C错误;减小反应体系的体积,反应物浓度增大,反应速率加快,D正确。 6.少量铁片与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( ) ①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol·L-1盐酸 A.①⑥⑦ B.②③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧ 答案 C 解析 铁片与稀盐酸反应的实质是Fe+2H+===Fe2++H2↑。加水稀释,c(H+)减小,反应速率减慢,①错误;加KNO3溶液,溶液中含有NO、H+,与Fe发生反应生成NO,得不到H2,②错误;滴加浓盐酸后,c(H+)增大,反应速率加快,由于铁片不足量,产生H2的量不变,③正确;加入少量铁粉,Fe的质量增加,则生成H2 - 13 - 的量增加,④错误;加NaCl溶液,相当于加水稀释,c(H+)减小,反应速率减慢,⑤错误;滴加CuSO4溶液,Fe与CuSO4发生置换反应析出Cu,形成原电池,反应速率加快,但由于置换Cu时消耗一部分Fe,生成H2的量减少,⑥错误;升高温度,反应速率加快,反应物的量不变,则生成H2的量不变,⑦正确;改用10 mL 0.1 mol·L-1盐酸,c(H+)增大,反应速率加快,且经分析可知生成H2的量不变,⑧正确;故可使用的方法有③⑦⑧。 7.三氯乙烯(C2HCl3)是地下水中有机污染物的主要成分,研究显示,在地下水中加入高锰酸钾溶液可将其中的三氯乙烯除去,发生反应如下:2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2↓+HCl。常温下,在某密闭容器中进行上述反应,测定c(KMnO4)与时间的关系如表所示: 时间/min 0 2 4 6 7 … c(KMnO4)/(mol·L-1) 1.0 0.70 0.50 0.40 0.35 … 下列推断合理的是( ) A.上述反应先慢后快 B.0~4 min时v(Cl-)=mol·L-1·min-1 C.若高锰酸钾完全反应,所用时间为8 min D.随着反应的进行,c(K+)逐渐降低 答案 B 解析 A项,分析表格中的数据,题述反应先快后慢,错误;B项,每消耗2 mol KMnO4会生成3 mol Cl-,v(Cl-)=×= mol·L-1·min-1,正确;C项,高锰酸钾完全反应,其浓度为0,消耗时间大于8 min,错误;D项,钾离子未参与反应,故钾离子浓度不变,错误。 8.(2019·江西宜春奉新一中月考)为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图(a)、图(b)所示的实验。下列叙述中不正确的是( ) A.图(b)中的A为分液漏斗 B.图(b)实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率 C.图(a)实验可通过观察产生气泡的快慢来比较反应速率 D.若图(a)实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好 答案 D - 13 - 解析 因为氯化铁、硫酸铜阴离子不同,若图(a)实验中反应速率为①>②,不能说明Fe3+对H2O2分解的催化效果一定比Cu2+好,D错误。 二、非选择题(共28分) 9.(2019·北京师大附中高三期中)(14分)硫化氢气体在资源利用和环境保护等方面均有重要应用。 (1)工业上采用高温分解H2S制取氢气,2H2S(g)2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2 L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1 mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。 ①反应2H2S(g)2H2(g)+S2(g)的ΔH________(填“>”“<”或“=”)0。 ②985 ℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=________。 ③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是______________________。 (2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。 ①在图示的转化中,化合价不变的元素是________。 ②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有__________________________。 答案 (1)①> ②0.04 mol/(L·s) ③温度升高,反应速率加快,达到平衡所需时间缩短 (2)①Cu、Cl、H ②增加氧气的通入量或增加起始时c(Fe3+) 解析 - 13 - (1)①由图像可知,温度升高,转化率增大,则平衡正移,所以正反应方向为吸热方向,即ΔH>0; ②达到平衡时H2S的转化率为40%,则参加反应的硫化氢为×40%=0.2 mol/L,生成的H2为0.2 mol/L,v(H2)===0.04 mol/(L·s); ③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近。 (2)①通过图示可以看出来Fe的化合价由+3变为+2又变为+3,S的化合价由-2变为0,O的化合价由0变为-2,化合价没有变的元素是Cu、Cl和H三种元素; ②由图示可知CuS+2Fe3+===Cu2++2Fe2++S,增加c(Fe3+)可使生成的硫单质中尽可能不含CuS,或者增加O2的通入量,使Fe2+转化为Fe3+,从而增大c(Fe3+)。 10.(2019·广州高三调研测试)(14分)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。 (1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________________。 (2)在一定温度下的恒容容器中,反应2N2O(g)===2N2(g)+O2(g)的部分实验数据如下: 反应时间/min 0 10 20 30 40 50 c(N2O)/(mol·L-1) 0.100 0.090 0.080 0.070 0.060 0.050 反应时间/min 60 70 80 90 100 c(N2O)/(mol·L-1) 0.040 0.030 0.020 0.010 0.000 ①在0~20 min时间段,反应速率v(N2O)为________mol·L-1·min-1。 ②其他条件不变,若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min时N2O的转化率α=________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1)________(填“>”“=”或“<”)v(c0=0.100 mol·L-1)。 ③不同温度(T)下,N2O分解的半衰期随起始压强的变化如图所示(图中半衰期指任一浓度下N2O消耗一半时所需的相应时间),则T1________(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p=________(用p0表示)。 (3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为: 第一步 I2(g)2I(g)(快反应) 第二步 I(g)+N2O(g)―→N2(g)+IO(g) (慢反应) - 13 - 第三步 IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应) 实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。 A.N2O分解反应中,v(第一步的逆反应)>v(第二步反应) B.第一步对总反应速率起决定作用 C.第二步反应的活化能比第三步的大 D.I2浓度与N2O分解速率无关 答案 (1)NH4NO3N2O↑+2H2O (2)①1.0×10-3 ②20.0% = ③> ④1.25p0 (3)AC 解析 (1)NH4NO3分解为N2O和另一种产物,另一产物必含氢元素,由于NH4NO3中氧原子数大于氮原子数,而N2O中氧原子数小于氮原子数,则另一产物必含氧元素,故另一产物为H2O,配平化学方程式为NH4NO3N2O↑+2H2O。 (2)①在0~20 min时间段,v(N2O)= =1.0×10-3 mol·L-1·min-1。 ②根据表格中数据可知,该反应不是可逆反应,且每个时间段内v(N2O)相同,即每10 min N2O的浓度减少0.010 mol·L-1,故N2O起始浓度c0为0.150 mol·L-1,反应至30 min时N2O的转化浓度为0.030 mol·L-1,N2O的转化率α=×100%=20.0%。由于每个时间段内v(N2O)相同,则N2O的分解速率与N2O的起始浓度无关,故v(c0=0.150 mol·L-1)=v(c0=0.100 mol·L-1)。 ③根据图示,起始压强相同时,T1时的半衰期比T2时的半衰期小,即T1条件下反应速率快,故T1>T2。当温度为T1、起始压强为p0时,设N2O的起始浓度为c,反应至t1 min时,N2O的浓度为0.5c,N2的浓度为0.5c,O2的浓度为0.25c,则t1 min时气体的总浓度为1.25c,根据恒温恒容时,气体的压强之比等于气体的物质的量之比,也等于气体的物质的量浓度之比,t1 min时体系压强为起始压强的1.25倍。 (3)A项,第一步反应为快反应,快速达到平衡,第二步反应为慢反应,则v(第一步的逆反应)>v(第二步反应),正确;B项,总反应的反应速率由分步反应中反应速率慢的一步决定,故第二步对总反应速率起决定作用,错误;C项,第二步反应速率慢,第三步反应速率快,说明第二步反应的活化能比第三步的大,正确;D项,由N2O的分解速率方程可知I2浓度与N2O分解速率有关,错误。 - 13 -查看更多