- 2021-07-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽适东县高级中学2021届新高三化学暑假特训卷4
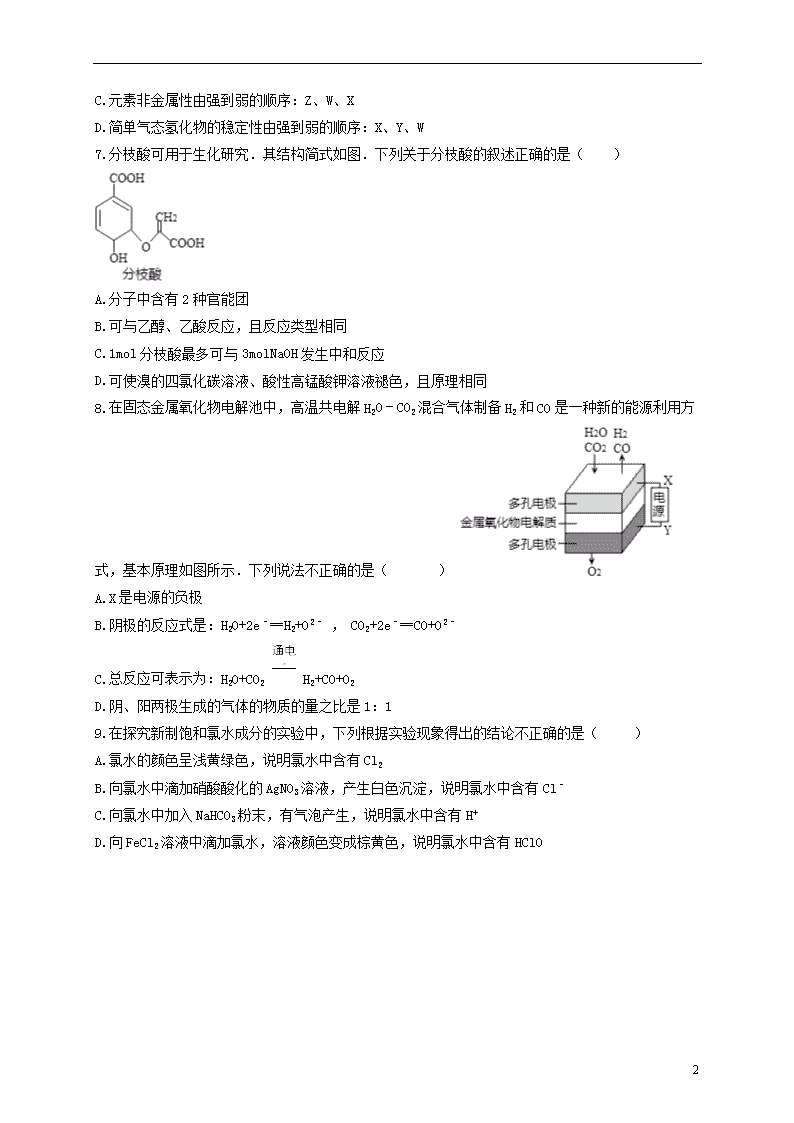
肥东县高级中学2021届新高三化学暑假特训卷4 一、选择题 1.2020 年春节前后,新冠病毒肆虐全球,防控疫情已成为国际首要大事。按照以往对冠状病毒的经验,乙醚、75%乙醇、含氯的消毒剂、过氧乙酸等均可有效灭活病毒,下列有关说法错误的是( ) A.因乙醇易燃,不可使用酒精溶液大面积对室内空气进行消毒 B.过氧乙酸(CH3COOOH)用于杀灭病毒是因为其含有羧基 C.次氯酸钠具有一定的腐蚀性和刺激性,使用时需带手套,并稀释使用 D.不能将“84 消毒液”和酒精混合进行环境消毒 2.下列关于阿伏加德罗常数NA的说法正确的是( ) A.标况下11.2LHCl气体溶于0.5L水中,所得溶液中含Cl-数为NA B.NA个Fe(OH)3胶体粒子的质量为107g C.电解精炼铜时转移了NA个电子,阳极溶解了32g铜 D.20gD2O和H218O中含有的质子数为10NA 3.1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( ) A.168mL B.224mL C.504mL D.336mL 4.将2.1g镁铝合金的碎片加入50mL盐酸中,待合金完全溶解后,生成0.1mol H2 , 得到溶液X.下列分析一定正确的是( ) A.开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜 B.过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度 C.该盐酸的物质的量浓度一定为4.0 mol•L﹣1 D.溶液X中Mg2+与Al3+的物质的量之比一定为1:1 5.分类是化学学习与研究的常用方法,下列分类正确的是( ) A.Cl2O7、P2O5、SO3、CO2均属于酸性氧化物 B.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 D.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 10 6.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( ) A.原子最外层电子数由多到少的顺序:Y、X、W、Z B.原子半径由大到小的顺序:W、Z、Y、X C.元素非金属性由强到弱的顺序:Z、W、X D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W 7.分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) A.分子中含有2种官能团 B.可与乙醇、乙酸反应,且反应类型相同 C.1mol分枝酸最多可与3molNaOH发生中和反应 D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 8.在固态金属氧化物电解池中,高温共电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( ) A.X是电源的负极 B.阴极的反应式是:H2O+2e﹣═H2+O2﹣ , CO2+2e﹣═CO+O2﹣ C.总反应可表示为:H2O+CO2 H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1:1 9.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( ) A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣ C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 10 10.海水开发利用的部分过程如图所示.下列说法错误的是( ) A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 11.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) A.用装置甲制取氯气 B.用装置乙除去氯气中混有的少量氯化氢 C.用装置丙分离二氧化锰和氯化锰溶液 D.用装置丁蒸干氯化锰溶液制MnCl2•4H2O 12.40℃时,在氨﹣水体系中不断通入CO2 , 各种离子的变化趋势如图所示.下列说法不正确的是( ) A.在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣ 10 ) B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣) C.随着CO2的通入, 不断增大 D.在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成 13.标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H﹣H,H﹣O和O=O键的键焓△H分别为436kJ•mol﹣1、463kJ•mol﹣1和495kJ•mol﹣1 . 下列热化学方程式正确的是( ) A.H2O(g)═H2(g)+ O2(g)△H=﹣485kJ?mol﹣1 B.H2O(g)═H2(g)+ O2(g)△H=+485kJ?mol﹣1 C.2H2(g)+O2(g)═2H2O(g)△H=+485kJ?mol﹣1 D.2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ?mol﹣1 14.下表中离子方程式及其评价均合理的是( ) 选项 化学反应及离子方程式 评价 A 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O 碱性氧化物与酸反应生成盐和水,正确 B 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO=BaSO3↓ 复分解反应,有沉淀生成,正确 C 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 D 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 复分解反应,无气体生成,无沉淀生成,不正确 15.已知某物质X能发生如下转化: 下列有关上述转化关系中物质及其反应的叙述错误的是( ) A.若X为或,则A为硝酸 B.若X为或,则A为硫酸 C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 二、非选择题 10 16.《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下: (1)检测锈蚀产物 主要成分的化学式 Fe3O4 Fe2O3·H2O FeO(OH) FeOCl 铁器在具有O2、________等环境中容易被腐蚀。 (2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。 ①Fe转化为Fe2+。 ②Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为________。 ③FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是________(填字母)。 a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂 ④Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀:Fe3O4+____O2+____H2O=____FeO(OH)(将反应补充完全)。 (3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下: 将铁器浸没在盛有0.5mol·L-1Na2SO3、0.5mol·L-1NaOH溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用NaOH溶液洗涤至无Cl-。 ①检测洗涤液中Cl-的方法是__________________________________________________。 ②脱氯反应:FeOCl+OH-=FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl与FeO(OH)溶解度的大小:________________。 ③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是 ______SO32-+______FeO(OH)=______SO42-+_____Fe3O4+______H2O(将反应补充完全)。 17.某实验小组对KSCN的性质进行探究,设计如下实验: (1)①用离子方程式表示实验I溶液变红的原因___。 ②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42- 10 ,并设计如图实验装置证实了猜想是成立的。 其中X溶液是___,检验产物SO42-的操作及现象是___。 (2)针对实验II“红色明显变浅”,实验小组提出预测。 原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。 原因②:SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-[Fe(SCN)]2+平衡左移,红色明显变浅。 已知:Mg2+与SCN-难络合,于是小组设计了如下实验: 由此推测,实验II“红色明显变浅”的原因是___。 18.以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下 步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。 步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅, 步骤III、过滤得MnSO4溶液 10 (1)仪器R的名称是_______。 (2)装置A用于制取SO2,反应的化学方程式为_________。 (3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________。 (4)装置C的作用是______________________。 (5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________,用MnCO3调节溶液pH时,需调节溶液pH的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表) 金属离子 Fe2+ Fe3+ Al3+ Mn2+ 开始沉淀的pH 7.04 1.87 3.32 7.56 沉淀完全的pH 9.18 3.27 4.9 10.2 (6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O22Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示 ②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________,真空干燥6小时得产品Mn3O4。 19.甲图是部分短周期元素的常见化合价与原子序数的关系图: 10 请回答下列问题: (1)甲图中C元素的中子数为7,其原子符号为_____,元素I与G同主族,位于第四周期则元素I的原子结构示意图______。 (2)F、G、H元素气态氢化物的稳定性由强到弱的顺序为_______________(用化学式表示) (3)化合物X是B元素的最高价氧化物,其电子式为_________,甲图中C元素的一种氢化物Y是10电子微粒, Y与O2发生置换反应的化学方程式为_________。 (4)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,恢复至室温共产生9mol气体,写出该反应的化学方程式__________。 (5)由上述元素中的几种组成a、b、c、d各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。 ①溶液a和b分别为_____,___(填化学式)。 ②溶液c中的离子方程式为_________。 ③请从原子结构的角度解释非金属性C>B的原因_________。 10 参考答案 1.B 2.D 3.D 4.A 6.A 7.B 8.D 9.D 10.C 11.C 12.C 13.D 14.C 15.D 16.H2O(潮湿) +3 c 4 1 6 12 取少量最后一次洗涤液于试管中,加入稀硝酸和硝酸银的混合液,若无白色沉淀产生说明无Cl- S(FeOCl)>S[FeO(OH)] 6 1 2 3 【解析】 (1)铁器在潮湿环境中很容易发生吸氧腐蚀。 (2)②根据化合物中化合价代数和为0进行计算。 ③反应中元素的化合价均不变化。 ④根据电子得失守恒和原子守恒配平方程式。 (3) ①检验Cl-的存在,通常向最后一次洗涤液中加入硝酸银,观察是否有白色沉淀生成; ②离子反应的本质是离子浓度的减小; ③根据电子得失守恒、原子守恒以及电荷守恒配平方程式。 (1)铁器在潮湿环境中很容易发生吸氧腐蚀,则具有O2、H2O等环境中容易被腐蚀。 (2)②根据化合物中化合价代数和为0,可知FeO(OH)中铁元素的化合价为+3。 ③反应中元素的化合价均不变化,所以Fe2+的作用是既不是氧化剂也不是还原剂。 ④1mol四氧化三铁中含有1mol亚铁离子,反应中失去1mol电子,根据电子得失守恒和原子守恒可知,方程式为4Fe3O4+O2+6H2O=12FeO(OH)。 (3) ①检验Cl-的存在,通常向最后一次洗涤液中加入硝酸银,观察是否有白色沉淀生成,故方法为取少量最后一次洗涤液于试管中,加入稀硝酸和硝酸银的混合液,若无白色沉淀产生说明无Cl-; ②离子反应的本质是离子浓度的减小,这说明FeO(OH)更难溶,因此FeOCl的溶解度大于FeO(OH)的溶解度。 ③1mol四氧化三铁中含有1mol亚铁离子,亚硫酸钠的氧化产物是硫酸钠,根据电子得失守恒、原子守恒以及电荷守恒可知Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是SO32-+6FeO(OH)=SO42-+2Fe3O4+3H2O。 17. ⑴MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O,Fe3++ 3SCN- Fe(SCN)3 0.1mol/L KSCN溶液 取少量X反应后的溶液于试管,先加盐酸,再加氯化钡,有白色沉淀,则证明产物中含有硫酸根离子,反之则无 ⑵两个原因都可能 18. (1)三颈烧瓶 (2)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O (3)用90-100℃的水浴加热 10 (4) 吸收未反应的SO2,防止污染环境 (5)将Fe2+氧化为Fe3+ 4.9≤pH≤7.56 (6)将滤液加热并保温在60-80℃,用氨水调节溶液pH并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出 19. (1) (2)HCl>H2S>SiH4 (3) 4NH3+3O22N2+6H2O (4)4HClO4═2Cl2↑+7O2↑+2H2O (5) HNO3 NaHCO3 +CO2+H2O=H2SiO3↓+ 碳和氮两元素位于同一周期,电子层数相同,氮比碳的原子序数大,原子半径小,原子核对最外层电子的吸引能力强,所以氮比碳的非金属性强。 10查看更多