- 2021-07-06 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业23电解原理的应用含解析 人教版选修4
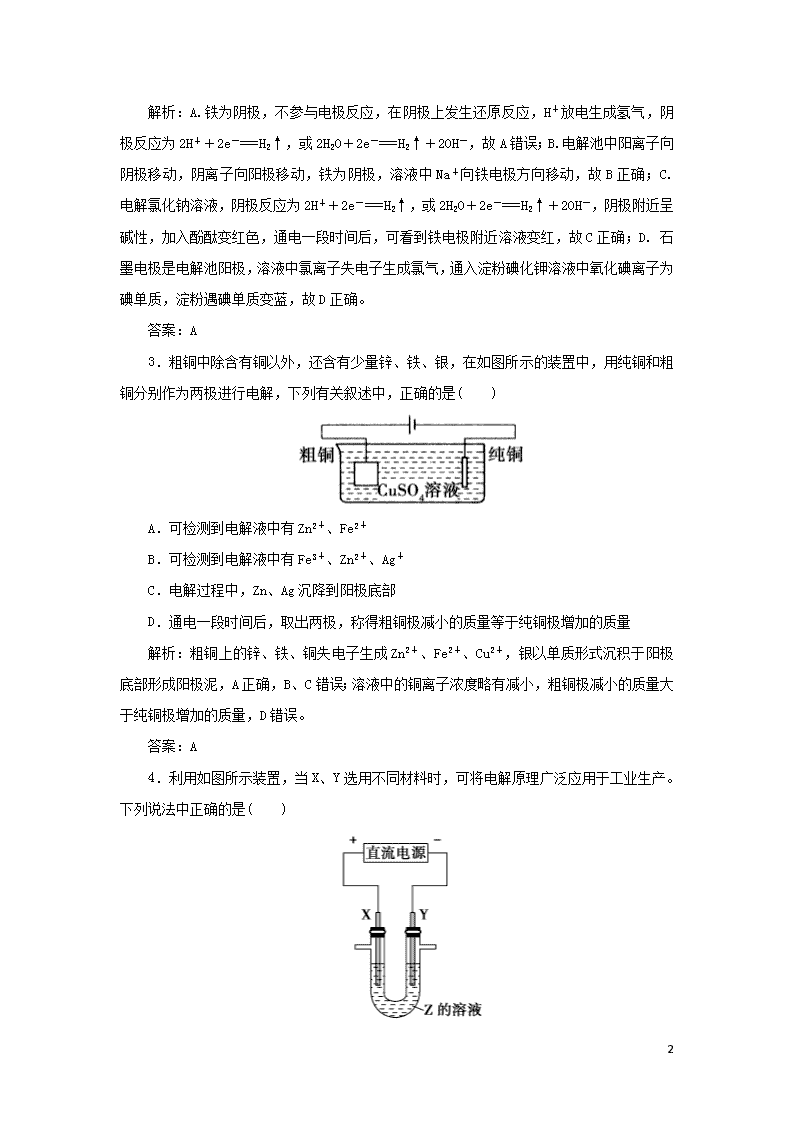
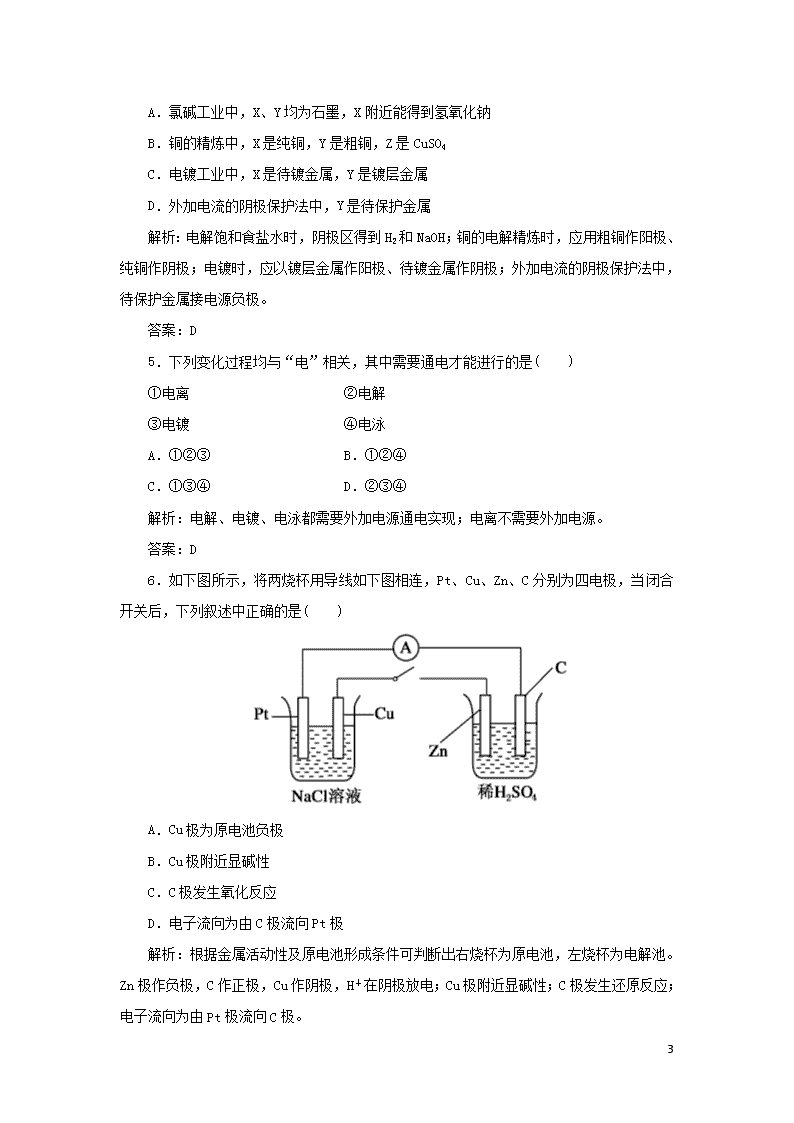
课时作业23 电解原理的应用 基础训练 1.(2019年云南省保山市模拟)下列叙述中,正确的是( ) ①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置 ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤电镀过程相当于金属的“迁移”,可视为物理变化. A.①②③④ B.③④ C.③④⑤ D.④ 解析:①电解池是将电能转变成化学能的装置,故①错误; ②原电池是将化学能转变成电能的装置,故②错误; ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化,发生电能和化学能的转化,一定发生化学变化,故③正确; ④不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应,铜为阳极被氧化,可生成硫酸铜,故④正确; ⑤电镀过程相当于金属的“迁移”,发生氧化还原反应,为化学反应,故⑤错误。 答案:B 2.(2019年烟台二中高二开学考试)电解NaCl溶液的装置如图所示,下列说法不正确的是( ) A.铁电极上的电极反应式为Fe-2e-===Fe2+ B.溶液中Na+由石墨电极向铁电极移动 C.通电一段时间后,可看到铁电极附近溶液变红 D.通电一段时间后,可看到试管中溶液变蓝 11 解析:A.铁为阴极,不参与电极反应,在阴极上发生还原反应,H+放电生成氢气,阴极反应为2H++2e-===H2↑,或2H2O+2e-===H2↑+2OH-,故A错误;B.电解池中阳离子向阴极移动,阴离子向阳极移动,铁为阴极,溶液中Na+向铁电极方向移动,故B正确;C. 电解氯化钠溶液,阴极反应为2H++2e-===H2↑,或2H2O+2e-===H2↑+2OH-,阴极附近呈碱性,加入酚酞变红色,通电一段时间后,可看到铁电极附近溶液变红,故C正确;D. 石墨电极是电解池阳极,溶液中氯离子失电子生成氯气,通入淀粉碘化钾溶液中氧化碘离子为碘单质,淀粉遇碘单质变蓝,故D正确。 答案:A 3.粗铜中除含有铜以外,还含有少量锌、铁、银,在如图所示的装置中,用纯铜和粗铜分别作为两极进行电解,下列有关叙述中,正确的是( ) A.可检测到电解液中有Zn2+、Fe2+ B.可检测到电解液中有Fe3+、Zn2+、Ag+ C.电解过程中,Zn、Ag沉降到阳极底部 D.通电一段时间后,取出两极,称得粗铜极减小的质量等于纯铜极增加的质量 解析:粗铜上的锌、铁、铜失电子生成Zn2+、Fe2+、Cu2+,银以单质形式沉积于阳极底部形成阳极泥,A正确,B、C错误;溶液中的铜离子浓度略有减小,粗铜极减小的质量大于纯铜极增加的质量,D错误。 答案:A 4.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( ) 11 A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C.电镀工业中,X是待镀金属,Y是镀层金属 D.外加电流的阴极保护法中,Y是待保护金属 解析:电解饱和食盐水时,阴极区得到H2和NaOH;铜的电解精炼时,应用粗铜作阳极、纯铜作阴极;电镀时,应以镀层金属作阳极、待镀金属作阴极;外加电流的阴极保护法中,待保护金属接电源负极。 答案:D 5.下列变化过程均与“电”相关,其中需要通电才能进行的是( ) ①电离 ②电解 ③电镀 ④电泳 A.①②③ B.①②④ C.①③④ D.②③④ 解析:电解、电镀、电泳都需要外加电源通电实现;电离不需要外加电源。 答案:D 6.如下图所示,将两烧杯用导线如下图相连,Pt、Cu、Zn、C分别为四电极,当闭合开关后,下列叙述中正确的是( ) A.Cu极为原电池负极 B.Cu极附近显碱性 C.C极发生氧化反应 D.电子流向为由C极流向Pt极 解析:根据金属活动性及原电池形成条件可判断出右烧杯为原电池,左烧杯为电解池。Zn极作负极,C作正极,Cu作阴极,H+在阴极放电;Cu极附近显碱性;C极发生还原反应;电子流向为由Pt极流向C极。 11 答案:B 7.电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( ) A.电解时以硫酸铜溶液作电解液,精铜作阳极 B.粗铜与电源负极相连,发生氧化反应 C.阴极上发生的反应是 Cu2++2e-===Cu D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 解析:根据电解原理,粗铜作阳极,比铜活泼的Zn、Fe等杂质发生氧化反应,比Cu不活泼的金属单质,如Ag等在阳极底部沉积;精铜作阴极,只发生Cu2++2e-===Cu。 答案:C 8.电镀在工业上有着广泛的应用,可以镀锌、镀铜、镀金等。如利用下图所示装置可以使铜牌摇身一变为银牌,即在铜牌表面电镀一层银。下列有关说法中正确的是( ) A.通电后,Ag+向阳极移动 B.银片与电源负极相连 C.该电解池的阴极反应可表示为Ag++e-===Ag D.当电镀一段时间后,将电源反接,铜牌可恢复如初 解析:由电解原理可知,在电镀时,镀层金属作阳极,待镀金属制品作阴极。要想在铜上镀银,说明银为阳极,与电源的正极相连,B项错误;在电解液中,Ag+向阴极移动,A项错误;阴极反应为Ag++e-===Ag,C项正确;将电源反接,则铜牌作阳极,由放电顺序可知,铜牌上的Cu、Ag均能溶解,铜牌不可能恢复如初,D项错误。 答案:C 提高训练 9.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( ) 11 A.M室发生的电极反应式:2H2O-4e-===O2↑+4H+ B.N室:a查看更多
相关文章
- 当前文档收益归属上传用户