- 2021-07-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业18乙酸含解析 人教版必修
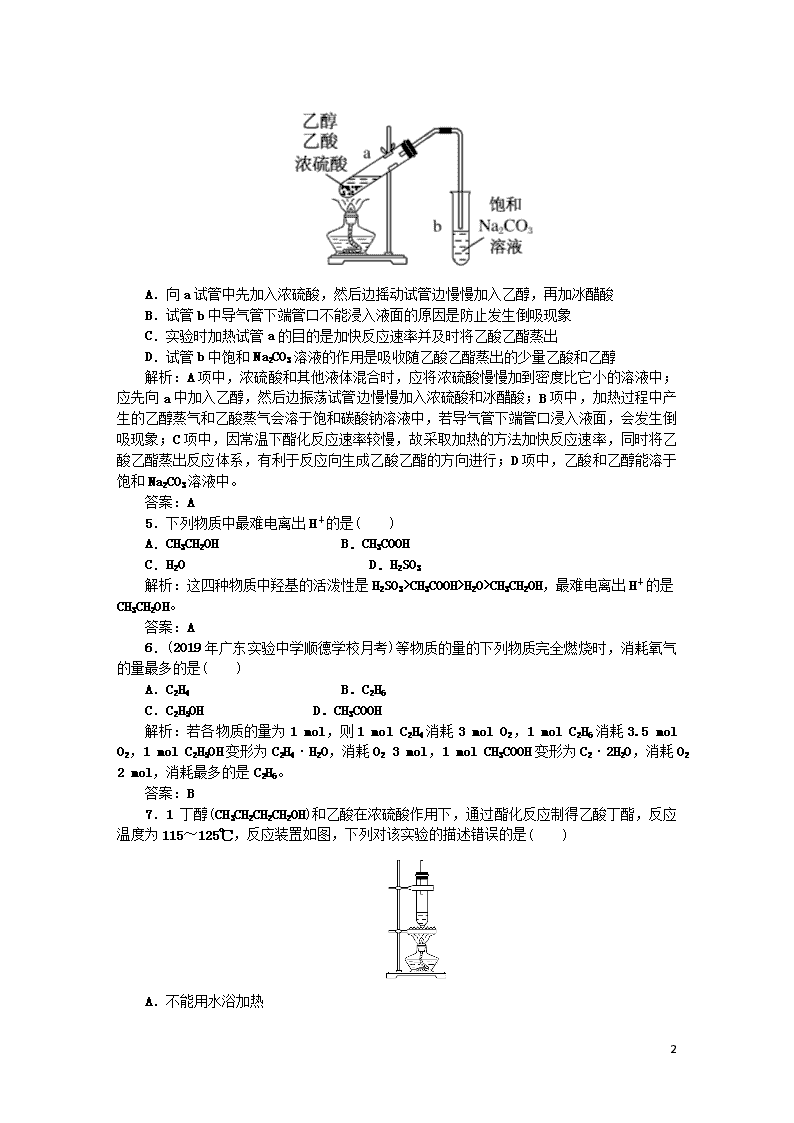
课时作业18 8 基础巩固 1.(2019年广州高一检测)如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是( ) A.C2H5OH B.C2H6 C.CH3CHO D.CH3COOH 解析:由该分子的比例模型可知该分子是CH3COOH,是乙酸分子。 答案:D 2.下列说法错误的是( ) A.乙醇和乙酸都是常用调味品的主要成分 B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 C.乙醇和乙酸都能发生氧化反应 D.乙醇和乙酸之间能发生酯化反应,加入过量的乙醇充分反应后,乙酸全部反应生成酯 解析:乙醇和乙酸都是常用调味品的主要成分,A正确;C2H6、C2H4常温是气体,乙醇和乙酸是液体,B正确;乙醇和乙酸都能燃烧,被氧气氧化,C正确;乙醇和乙酸之间能发生酯化反应,酯化反应是可逆反应,可逆反应是有限度的,不能进行完全,D错误。 答案:D 3.关于乙酸的叙述不正确的是( ) A.可与乙醇反应 B.能溶解鸡蛋壳 C.食醋中含有乙酸 D.为一种无色无味的液体 解析:A项,乙酸能与乙醇发生酯化反应,正确;B项,乙酸的酸性比碳酸强,能溶解鸡蛋壳,正确;C项,食醋中含有乙酸,正确;D项,乙酸为一种无色有强烈刺激性气味的液体,错误。 答案:D 4.如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( ) 8 A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 B.试管b中导气管下端管口不能浸入液面的原因是防止发生倒吸现象 C.实验时加热试管a的目的是加快反应速率并及时将乙酸乙酯蒸出 D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 解析:A项中,浓硫酸和其他液体混合时,应将浓硫酸慢慢加到密度比它小的溶液中;应先向a中加入乙醇,然后边振荡试管边慢慢加入浓硫酸和冰醋酸;B项中,加热过程中产生的乙醇蒸气和乙酸蒸气会溶于饱和碳酸钠溶液中,若导气管下端管口浸入液面,会发生倒吸现象;C项中,因常温下酯化反应速率较慢,故采取加热的方法加快反应速率,同时将乙酸乙酯蒸出反应体系,有利于反应向生成乙酸乙酯的方向进行;D项中,乙酸和乙醇能溶于饱和Na2CO3溶液中。 答案:A 5.下列物质中最难电离出H+的是( ) A.CH3CH2OH B.CH3COOH C.H2O D.H2SO3 解析:这四种物质中羟基的活泼性是H2SO3>CH3COOH>H2O>CH3CH2OH,最难电离出H+的是CH3CH2OH。 答案:A 6.(2019年广东实验中学顺德学校月考)等物质的量的下列物质完全燃烧时,消耗氧气的量最多的是( ) A.C2H4 B.C2H6 C.C2H5OH D.CH3COOH 解析:若各物质的量为1 mol,则1 mol C2H4消耗3 mol O2,1 mol C2H6消耗3.5 mol O2,1 mol C2H5OH变形为C2H4·H2O,消耗O2 3 mol,1 mol CH3COOH变形为C2·2H2O,消耗O2 2 mol,消耗最多的是C2H6。 答案:B 7.1丁醇(CH3CH2CH2CH2OH)和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( ) A.不能用水浴加热 8 B.长玻璃管起冷凝回流作用 C.1丁醇和乙酸能反应完或者其中一种能消耗完 D.为了提高反应速率,所以要加入浓硫酸作催化剂并加热 解析:因加热温度超过100℃,故不能用水浴加热,A项正确;受热时1丁醇和乙酸均易挥发,故长玻璃管有冷凝回流的作用,B项正确;因酯化反应是可逆反应,所以任何一种反应物均不可能被消耗完,C项错误;加入催化剂和加热均能提高反应速率,D项正确。 答案:C 8.巴豆酸的结构简式为CH3—CH===CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( ) A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部 解析:根据有机物的结构简式可知,该分子中含有的官能团是碳碳双键和羧基,碳碳双键能与HCl、溴水发生加成反应,能与酸性高锰酸钾溶液发生氧化反应,羧基能与纯碱反应生成CO2,能与乙醇发生酯化反应,所以①~⑤与巴豆酸的反应都能发生,答案选D。 答案:D 9.乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品。已知乙烯能发生以下转化: (1)乙烯的结构简式为____________________。 (2)反应①的反应类型是________,D中含官能团名称为________。 (3)写出以下反应的化学方程式: ①_______________________________________。 ②_____________________________________________。 ③_________________________________________________。 解析:乙烯与水发生加成反应产生B:乙醇(CH3CH2OH);乙醇催化氧化产生C:乙醛(CH3CHO);乙醛催化氧化产生D:乙酸(CH3COOH);乙醇与乙酸发生酯化反应产生乙酸乙酯和水;乙烯发生加聚反应产生聚乙烯。(1)乙烯的结构简式为CH2===CH2。(2)反应①的反应类型是加成反应;D乙酸(CH3COOH)中含官能团名称为羧基。(3)①反应的化学方程式是CH2===CH2+H2OCH3CH2OH。②反应的化学方程式是C2H5OH+CH3COOHCH3COOC2H5+H2O。③反应的化学方程式是nCH2===CH2CH2—CH2 答案:(1)CH2===CH2 (2)加成反应 羧基 (3)①CH2===CH2+H2OCH3CH2OH 8 ②C2H5OH+CH3COOHCH3COOC2H5+H2O 能力提升 10.(2019年卓越联盟月考)酸和醇可以发生酯化反应,生成酯类物质,下列酸和醇能生成相对分子质量为90的酯的是( ) A.CH3C18OOH与C2HOH B.CH3C18O18OH与C2HOH C.CH3CO18OH与C2HOH D.CH3CO18OH与C2H5OH 解析:在酯化反应中羧酸提供羟基,醇提供氢原子,则CH3C18OOH与C2HOH生成的酯类为CH3C18O18OC2H5,相对分子质量是92,A错误;CH3C18O18OH与C2HOH生成的酯类为CH3C18O18OC2H5,相对分子质量是92,B错误;CH3CO18OH与C2HOH生成的酯类为CH3CO18OC2H5,相对分子质量是90,C正确;CH3CO18OH与C2H5OH生成的酯类为CH3COOC2H5,相对分子质量是88,D错误。 答案:C 11.(2019年南宁高一检测)山梨酸(CH3—CH===CH—CH===CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是( ) A.可与钠反应 B.可与碳酸钠溶液反应 C.可与溴的四氯化碳溶液发生取代反应 D.可生成高分子化合物 解析:山梨酸含有羧基,因此可以与Na发生反应,可与碳酸钠溶液反应生成CO2;山梨酸含有碳碳双键,可与溴的四氯化碳溶液发生加成反应,可发生加聚反应生成高分子化合物。 答案:C 12.如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图: 在上述实验过程中,所涉及的三次分离操作分别是( ) A.①蒸馏、②过滤、③分液 B.①分液、②蒸馏、③蒸馏 C.①蒸馏、②分液、③分液 D.①分液、②蒸馏、③结晶、过滤 解析:乙酸乙酯、乙酸、乙醇在饱和碳酸钠溶液中分层,乙酸与碳酸钠反应生成乙酸钠,乙醇溶解在水中,乙酸乙酯因难溶而分层,故通过操作①分液可得到乙酸乙酯,A为乙酸钠和乙醇的混合物,通过操作②蒸馏可得到乙醇,B为乙酸钠溶液, 8 加稀硫酸酸化后蒸馏可得到乙酸。 答案:B 13.在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有机物可能是( ) A. B.HOOC—COOH C.HOCH2CH2OH D.CH3COOH 解析:相同条件下气体的物质的量之比等于体积之比。设n1、n2分别为该状况下所得到的氢气、二氧化碳的物质的量,同时设选项中各物质的物质的量均为1 mol,则各物质与n1、n2的对应关系如表: 由表中数据可知,若V1=V2≠0即n1=n2≠0,故该有机物为。 答案:A 14.有X、Y、Z 3种元素,X是有机化合物中必含的元素,Y是地壳里含量最多的元素,Z是质量最轻的元素。X与Y能结合成两种化合物A和B,A可以燃烧,B不可以燃烧,也不支持燃烧;X与Z结合的最简单的化合物C有可燃性;X、Y与Z三种元素结合的化合物D常用作实验室加热的燃料,D被酸性高锰酸钾氧化生成E。 (1)试判断X、Y、Z分别是(填元素符号) X____________,Y____________,Z____________。 (2)试判断A、B、C、D、E各是什么物质(用化学式表示) 8 A____________,B____________,C____________, D____________,E____________。 (3)完成化学方程式 ①C燃烧的化学方程式:____________________。 ②D在铜作催化剂且加热条件下与氧气反应的化学方程式:______________________________________。 ③D与E在浓硫酸加热条件下反应的化学方程式:___________________________________________________________________________________________________________。 解析:据题意易推知X为碳元素,Y为氧元素,Z为氢元素,A为CO,B为CO2,C为CH4,D为CH3CH2OH,E为CH3COOH。 答案:(1)C O H (2)CO CO2 CH4 CH3CH2OH CH3COOH (3)①CH4+2O2CO2+2H2O ②2CH3CH2OH+O22CH3CHO+2H2O ③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 探究拓展 15.乙酸分子的结构式为下列反应及断键部位正确的是( ) (1)乙酸的电离,是①键断裂 (2)乙酸与乙醇发生酯化反应,是②键断裂 (3)在红磷存在时,Br2与CH3COOH的反应CH3COOH+Br2CH2Br—COOH+HBr,是③键断裂 (4)乙酸变成乙酸酐的反应2CH3COOH―→,是①②键断裂 A.(1)(2)(3) B.(1)(2)(3)(4) C.(2)(3)(4) D.(1)(3)(4) 解析:乙酸电离出H+时,断裂①键;在酯化反应时酸脱羟基,断裂②键;与Br2的反应, 8 Br取代了甲基上的氢,断裂③键;生成乙酸酐的反应,一个乙酸分子断裂①键,另一个乙酸分子断裂②键。所以B正确。 答案:B 16.(2019年上海宝山区高三一模)实验室制取乙酸丁酯的实验装置有如图所示两种装置供选用。 其有关物质的物理性质如下表: 乙酸 1丁醇 乙酸丁酯 熔点/℃ 16.6 -89.5 -73.5 沸点/℃ 117.9 117 126.3 密度/(g·cm-3) 1.05 0.81 0.88 水溶性 互溶 可溶(9 g/100 g水) 微溶 (1)制取乙酸丁酯的装置应选用________(填“甲”或“乙”)。不选另一种装置的理由是____________________。 (2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有________、________。(写出结构简式) (3)酯化反应是一个可逆反应,为提高1丁醇的利用率,可采取的措施是____________________________________。 (4)从制备乙酸丁酯所得的混合物中分离提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________(填字母)。 (5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须________(填写操作);某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能是________________________________(写出一点)。 答案:(1)乙 由于反应物(乙酸和1丁醇)的沸点低于产物乙酸丁酯的沸点, 8 若采用甲装置会造成反应物的大量挥发降低了反应物的利用率,乙装置则可以冷凝回流反应物,提高反应物的利用率 (2)CH3CH2CH2CH2OCH2CH2CH2CH3 CH3CH2CH===CH2 (3)增加乙酸浓度、及时移走生成物(或减小生成物浓度) (4)ac (5)检查是否漏水或堵塞 分液漏斗上口玻璃塞上的凹槽未与漏斗口上的小孔对准(或漏斗内部未与外界大气相通,或玻璃塞未打开) 8 9查看更多