- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省本溪高中2019-2020学年高二下学期期末考试化学试题 Word版含答案
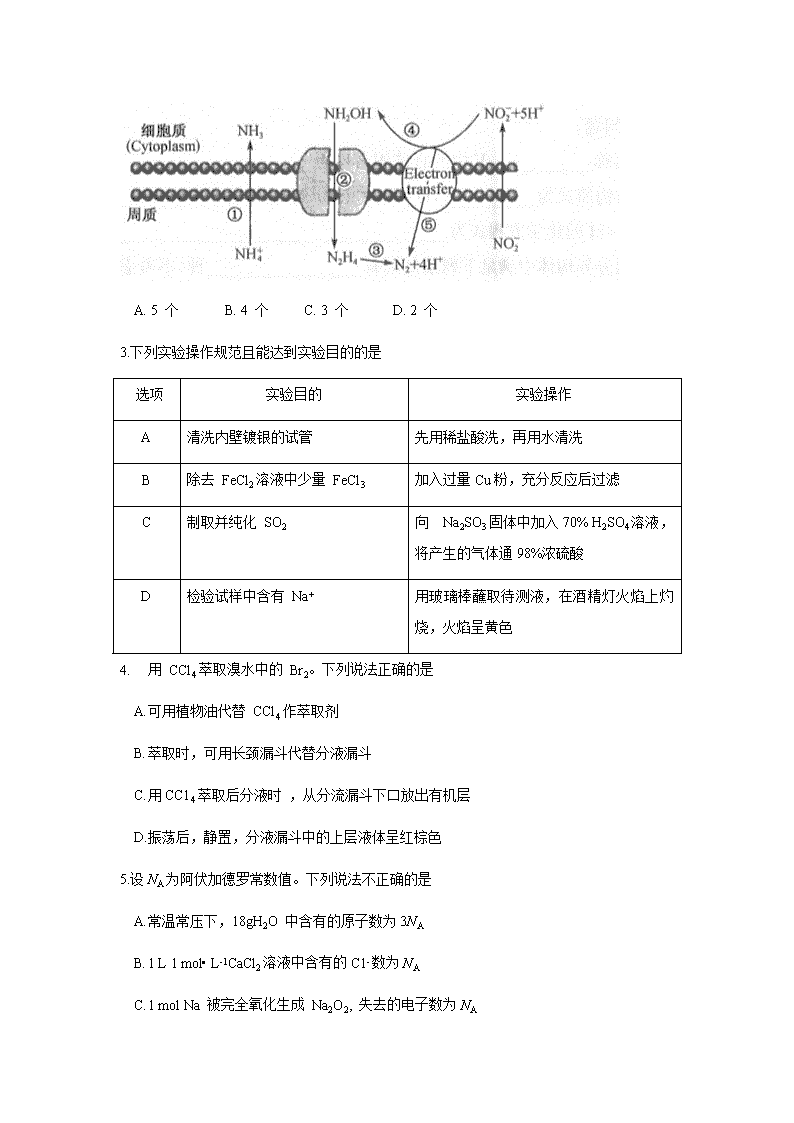
本溪县高中高二下学期期未考试试题 化 学 考生注意: 1. 本试卷分选择题和非选择题两部分。 满分 100 分,考试时间 90 分钟。 2. 答题前,考生务必用直径 0. 5 毫米黑色墨水签字笔将密封线内项目填写清楚。 3. 考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径 0. 5 毫米黑色墨 水签字笔在答题卡上各题的答题区域内作答 ,超出答题区域书写的答案无效 ,在试题卷、草稿纸上作 答无效。 4. 本卷命题范围:高考范围。 5. 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Al 27 S32 Mn 55 Fe 56 Cu 64 Ba 137 一、选择题(本 题共 20 小题,第1~10 题,每小 题 2 分,第 11 ~20 题,每小题 3 分,共50 分。在每小题列出的四个选项中,只有一项是最符合题目要求的) 1.化学与生活密切相关。下列叙述错误的是 A. 干冰可用于人工降雨 B. 硅单质可用于制造计算机芯片 C. 氯水可用于杀菌消毒 D. 纯碱可用作口服制酸剂 2.海水中的氮循环如图所示,其中反应①~⑤中属于氧化还原反应的有 A. 5 个 B. 4 个 C. 3 个 D. 2 个 3.下列实验操作规范且能达到实验目的的是 选项 实验目的 实验操作 A 清洗内壁镀银的试管 先用稀盐酸洗,再用水清洗 B 除去 FeCl2溶液中少量 FeCl3 加入过量Cu粉,充分反应后过滤 C 制取并纯化 SO2 向 Na2SO3固体中加入70% H2SO4溶液,将产生的气体通98%浓硫酸 D 检验试样中含有 Na+ 用玻璃棒蘸取待测液,在酒精灯火焰上灼烧,火焰呈黄色 4. 用 CCl4萃取溴水中的 Br2。下列说法正确的是 A. 可用植物油代替 CCl4作萃取剂 B. 萃取时,可用长颈漏斗代替分液漏斗 C. 用CC14萃取后分液时 ,从分流漏斗下口放出有机层 D. 振荡后,静置,分液漏斗中的上层液体呈红棕色 5.设NA为阿伏加德罗常数值。下列说法不正确的是 A. 常温常压下,18gH2O 中含有的原子数为3NA B. 1 L 1 mol• L-1CaCl2溶液中含有的C1- 数为NA C. 1 mol Na 被完全氧化生成 Na2O 2, 失去的电子数为NA D. 2. 7 g Al 与足量 NaOH 溶液反应,生成 H2的分子数为 0. 15NA 6.下列各组物质的转化关系中不能全部通过一步反应完成的是 A. Na NaOH Na2CO3 NaCl B. Mg MgCl2 Mg( OH)2 MgSO4 C. Al Al2O3Al(OH)3 NaA1O2 D. Fe FeCl2Fe ( OH )2 Fe(OH)3 7.下列操作或叙述正确的是 A. 配制 NaOH 溶液时,将称量后的NaOH 加入容量瓶中,再加水溶解 、定容 B. 将吸有 NaOH 溶液的长胶头滴管伸入硫酸亚铁溶液中挤出溶液,可制得Fe(OH )2 C. 向某溶液中加入 BaCl2溶液产生白色沉淀,说明原溶液中一定含有SO42- D. 向沸水中逐滴滴加 FeCl3的稀溶液并用玻璃棒搅拌,可制得 Fe(OH)3胶体 8.纳米二硫化钼 (MoS2难溶于水)是氢化反应和异构化反应的催化剂,将纳米二硫化钼与水 混合制得的分散系不具有的性质是 A. 分散质的直径为 l nm~100 nm B. 激光笔照射时,有一条光亮的通路 C. 使用半透膜过滤时,分散质能透过半透膜 D. 澄清透明 、较均匀 、较稳定的混合物 9.下列离子的检验方法合理的是 A. 向某溶液中滴入KSCN 溶液呈红色,说明溶液中一定不含 Fe2+ B. 向某溶液中加入NaOH 溶液,有红褐色沉淀生成,说明溶液中一定含有 Fe3+ C. 向某溶液中通入Cl2 , 然后再加入KSCN溶液变红色,说明原溶液中一定含有 Fe2+ D. 向某溶液中加入NaOH 溶液得白色沉淀,迅速变为灰绿色,最终变为红褐色,说明该溶液中只含有 Fe2+, 不含有 Mg2+ 10. 若x g C3H6中含有的氢原子数为 y , 则 w g CO中的分子数为 A. B. C. D. 11. 我国科学家合成了一种全新的环[ 18] 碳分子(C18 , 如图),下列说法正确的是 A.C18属于一种新型化合物 B.C18与C60 的摩尔质量相等 C.等质量的C18与C60所含的原子个数比为 1 : 1 D.等质量的C18与C60所含的分子个数比为 1:1 12. 将 5. 6 g 铁粉加到 50 mL 2 mol• L-1 FeCl3溶液中 ,完全反应后(假设溶液的体积不 变 ),下列结论不正确的是 A. 溶液中 n ( Fe2+)为0. 3 mol B向溶液中滴加无色 KSCN 溶液,不变色 C 铁有剩余,溶液呈浅绿色 ,c( Cl-) 基本不变 D氧化产物与还原产物的物质的量之比为 1:2 13. 某实验小组设计的测定 Na2SO4 和 Na2CO3混合物中各组分含量的实验如下: 下列判断不正确的是 A. 沉淀a 的主要成分为 BaSO4 和BaCO3 B. 滤液 b 中 Na+ 的物质的量为 0. 08 mol C .气体d在标准状况下的体积为 224 mL D.原混合物中Na2SO4 和 Na2CO3 的物质的量之比为 1: 3 14. 下列反应的离子方程式书写正确的是 A. 小苏打溶液中加入醋酸: H CO3- + H+ =CO2 +H2O↑ B铁锈溶于稀硫酸:Fe2O3+6 H+= 2Fe3++ 3 H2O C. 铝溶于氢氧化钠溶液: Al+ OH- + H2O = AlO2-+ H2 ↑ D. 0. 1 mol• L-1的 NaAlO2 溶液和 0. 15 mol• L-1 的H2SO4溶液等体积混合: AlO2- + 4H+ =A l3+ +2 H2O 15. 工业上提取碲(Te) 的反应之一为 3Te+ l 6 H NO3=3Te( NO3)4 + 4NO ↑ 十8 H2O, 下列说法不正确的是 A. Te( NO3)4是氧化产物,NO 是还原产物 B. 氧化剂与还原剂的物质的量之比为 16 : 3 C. 氧化性由强到弱的顺序为 HNO3>Te( NO3)4 D. 生成标准状况下 11. 2 LNO, 转移的电子数为 1. 5NA 16. 一 定条件下,密闭容器内 SO2 氧化成SO3的热化学方程式为2SO2 (g ) + O2( g) 2SO3(g) ΔH = —a kJ• mol -1,该温度下反应的平衡常数为 K。反应达到平衡后,保持温度不变 ,再通入一定量O2 ,下列说法正确的是(不考虑物质状态变化 ) A. a 增大,K 不变 B. a 不变,K 增大 C. a 增大,K 增大 D. a 不变,K 不变 17. 巳知下列热化学方程式: Fe2O3(s ) +3CO(g ) =2Fe( s) + 3CO2( g ) ΔH =-24. 8 kJ• mol-1 3Fe2O3 (s) + CO ( g) =2Fe3O4( s ) + CO2( g ) ΔH = -47. 2 kJ•mol-1 Fe3O4(s) + CO( g)= 3FeO ( s ) + CO2 ( g ) ΔH =+ 640. 5 kJ•mol-1 则1 4gCO气体 与足量FeO充分反应得到Fe 单质和CO2气体时的热量变化为 A. 放出 218 kJ B. 放出 109 kJ C. 吸收 218 kJ D. 吸收 109 kJ 18. 常温下,在下列给定条件的溶液中,一定能大量共存的离子组是 A. 能使 pH 试纸呈红色的溶液:Na+ 、NH4+ 、I-、NO3- B. c( Fe3+ ) =0. 1 mol• L-1的溶液:H+ 、Al+3、I- 、SCN C. 加入铝粉生成H2的溶液: K+、Mg2+ 、SO42- 、HCO3- D.=0. 1 mol• L-1的溶液:Na+、K+、SiO32-、NO3- 19. 下列说法正确的是 A. 将 AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是 AlCl3 B. 加热 Fe2( SO4)3溶液 ,Fe3+的水解程度和溶液的 pH 均增大 C. 锅炉中沉积的 CaSO4可用饱和碳酸钠溶液浸泡 ,再用盐酸溶解而除去 D. 在合成氨工业中,将 NH3液化并及时分离可增大正反应速率 ,提高原料转化率 20. “水煤气( CO、H2)—空气”燃料电池的工作原理如图所示,其中 a 、b 均 为惰性电极。下列叙述正确的是 A. 甲处通入的是空气,乙处通入的是水煤气 B. a 电极发生还原反应,b 电极发生氧化反应 C. a 电极的反应式包括 :CO +4OH-+ 2 e- =CO32-+2H2O D. 用该电池电镀铜,若待镀金属增重 6. 4 g, 则至少消耗标准状况下的水煤气 2. 24 L 二、非选择题(本题共 4 小题,共50 分) 21. (10 分)铁铵矾常用作测定卤素的指示剂,化学式为 ( NH4)aFeb ( SO4) c •dH2O, 为测定其组成,某化学兴趣小组进行了以下实验: I . 称取 144. 6 g 样品,灼烧至恒重时(假如只失去结晶水 ,不发生其他反应),得蒸馏水 的质量为 64. 8 g。 II. 将上述剩余固体完全溶于水,并将所得溶液分成三等份: ①往其中一份中加入足量的NaOH 浓溶液并加热,最终得到标准状况下 2. 24 L 气体。 ②往第二份中加入稀硫酸,然后向此混合溶液中逐滴加入 0.1 mol•L-1NaOH 溶液,滴加 过程中产生红褐色沉淀的质量与加入 NaO H 溶液的体积的关系如图所示: ③往第三份中加入足量的 0. 1 mol•L-1BaCl2 溶液 ,生成不溶于稀硝酸的白色沉淀 46. 6 g。 回答下列问题: ( 1 ) 操作①生成气体的离子方程式为 。 ( 2) 操作②中 OX 段反应的离子方程式为 ; XY 段反应的离子方程式为 。 ( 3) 操作③中生成的沉淀为 ,其物质的量为 。 ( 4) 铁铵矾的化学式为 。 22. ( 10 分)四氧化三锰既是磁性材料锰锌铁氧体( ZnaMnbFecO4 , Fe 元素为+3 价 ,Zn、Mn 元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如下: 回答下列问题: ( 1 ) “溶解”时需用玻璃棒,其作用为 。 ( 2 ) “碱化”时反应离子方程式为 。 ( 3 ) 滤液X 中含有的溶质为 (填化学式)。 ( 4 ) 简述“碱化”得到的沉淀是否洗涤干净的方法 : 。 ( 5 ) “ 氧化”时发生的化学反应方程式为 。 ( 6) 取 30. 2 g MnSO4经上述工艺过程后,生成 g Mn3O4(假设 Mn 元素不损失)。 23. (15 分)亚微米级 Cu0/ Fe3O4 复合物多相催化过 一 硫酸盐降解有机污染物的过程如 图所示 : 回答下列问题: (1) 基态铜原子的价层电子排布式为 ,其位于元素周期表的 区。 (2) O 、S、H 的电负性由大到小的顺序为 。 (3) SO42-的中心原子的价层电子对数为 ,其空间构型为 。 (4) 冰的晶体结构如图 1 所示,则1mol 冰中含有 mol 氢键。 ( 5 ) Cu0/ Fe3O4 复合物也是有机反应中的催化剂,如: + NH3+H2O2 +2H2O ①l mol中含有σ建的数目为 NA(NA为阿伏加德罗常数的值)。 ② NH3 的键角 (填“大于”“小于”或“等于” ) NF3的键角;理由是 。 ( 6) 铜的晶胞结构如图 2, 则铜的配位数为 ,若铜原子的半径为a pm, 则铜晶胞的密度为 g• cm-3(列出计算式)。 24. (15 分)吗氯贝胺(H) 临床上为单胺氧化酶抑制剂类药物,由芳香烃 A 合成 H 的路线如图所示: 回答下列问题: ( l ) A 的名称 , E 中的官能团名称为 。 (2) C的结构简式为 ,D→F 的反应反应类型为 。 (3) ) F + G→ H的化学方程式为 。 ( 4) C 的同分异构体中满足下列条件的有 种(不考虑立体异构)。 ①属于芳香族化合物 ②能发生银镜反应 其中核磁共振氢谱有 3 组峰且峰面积比为 2 :2 : 1 的结构简式为 。 (5)参照上述合成路线,写出以 和 CH3NH2为原料合成 的路线: (无机试剂任选)。 本溪县高中高二下学期期末考试试题•化学 参考答案、提示及评分细则 1. D 2. B 3.C 4.C 5. B 6. C 7.B 8.C 9 . B l 0. B 11. C 12. A 13.C 14.B 15.B 16.D l7. B 18. D 19. C 20. D 21. (l ) NH4++OH- NH3 ↑ +H2O (1分) (2) H+ + OH- = H2O; Fe3++3 OH-=Fe(OH)3↓(各 2 分) (3)BaSO4 (2 分); 0.2mol (1分) (4)NH4Fe(SO4)2·12H2O( 2 分) 22. (1 ) 搅拌,加快MnSO4溶解速率 (1 分) ( 2) Mn2+ + 2NH3 • H2O=Mn(OH )2↓+ 2NH4+ (2 分) (3) ( NH4)2SO4 (1分) (4) 取最后一次洗涤液少许于试管中,滴加几滴盐酸酸化的 BaCl2溶液,若无白色沉淀生成说 明沉淀洗涤干净( 2 分) (5) 3Mn(OH )2 + H2O2 =Mn3O4 + 4H2O ( 2 分) (6)15. 3( 2 分) 23. (1) 3d104s1; ds (各 1 分) (2)O > S> H (1分) (3) 4; 正四面体(各1 分) (4) 2 ( 2 分) (5) ①19( 2 分) ②大于(1 分);NH3中成键电子偏向 N, 斥力大,键角大. NF3中成键电子偏向F, 斥力小,键角小(2 分) (6) 12(1 分); ( 2 分) 24. (1) 甲苯(1分);溴原 子 、氨基( 2 分) (2) ( 2 分),取代反应(1 分) (3)+ +HBr(2分) (4)3;(各 2 分) (5) (3 分 ) 查看更多