- 2021-07-05 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学二轮复习专题强化训练10非金属元素及其化合物含解析
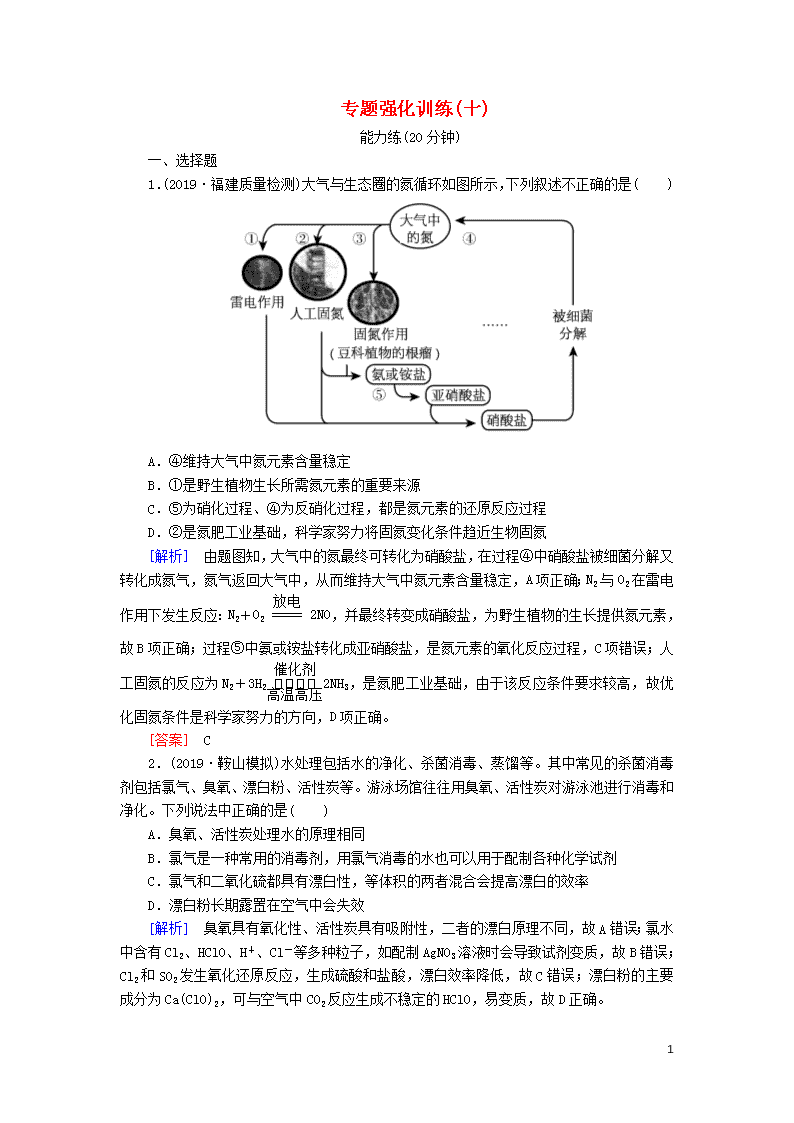
专题强化训练(十) 能力练(20分钟) 一、选择题 1.(2019·福建质量检测)大气与生态圈的氮循环如图所示,下列叙述不正确的是( ) A.④维持大气中氮元素含量稳定 B.①是野生植物生长所需氮元素的重要来源 C.⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程 D.②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮 [解析] 由题图知,大气中的氮最终可转化为硝酸盐,在过程④中硝酸盐被细菌分解又转化成氮气,氮气返回大气中,从而维持大气中氮元素含量稳定,A项正确;N2与O2在雷电作用下发生反应:N2+O22NO,并最终转变成硝酸盐,为野生植物的生长提供氮元素,故B项正确;过程⑤中氨或铵盐转化成亚硝酸盐,是氮元素的氧化反应过程,C项错误;人工固氮的反应为N2+3H22NH3,是氮肥工业基础,由于该反应条件要求较高,故优化固氮条件是科学家努力的方向,D项正确。 [答案] C 2.(2019·鞍山模拟)水处理包括水的净化、杀菌消毒、蒸馏等。其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉、活性炭等。游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。下列说法中正确的是( ) A.臭氧、活性炭处理水的原理相同 B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂 C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率 D.漂白粉长期露置在空气中会失效 [解析] 臭氧具有氧化性、活性炭具有吸附性,二者的漂白原理不同,故A错误;氯水中含有Cl2、HClO、H+、Cl-等多种粒子,如配制AgNO3溶液时会导致试剂变质,故B错误;Cl2和SO2发生氧化还原反应,生成硫酸和盐酸,漂白效率降低,故C错误;漂白粉的主要成分为Ca(ClO)2,可与空气中CO2反应生成不稳定的HClO,易变质,故D正确。 7 [答案] D 3.(2019·襄阳模拟)下列有关物质性质与用途具有对应关系的是( ) A.ClO2具有强氧化性,可用于生活用水的消毒 B.CCl4的密度比H2O大,可用于萃取Br2和I2 C.Si能与强碱反应,可用于制造半导体材料 D.Fe2O3能与Al反应,可用于油漆、橡胶的着色 [解析] ClO2具有强氧化性,可用于生活用水的消毒,A项正确;CCl4可用于萃取Br2和I2,是因为Br2和I2在CCl4中的溶解度大于在水中的溶解度,且CCl4与水互不相溶,与CCl4和水的密度大小没有关系,B项错误;硅用于制造半导体材料,是因为其导电性介于导体和绝缘体之间,与Si能与强碱反应没有关系,C项错误;Fe2O3用于油漆、橡胶的着色,是因为Fe2O3为红棕色,与Fe2O3能与Al反应没有关系,D项错误。 [答案] A 4.(2019·安徽模拟)当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下: 下列关于该“消除”过程的叙述不正确的是( ) A.部分光能转变为化学能 B.消除总反应为NOx+O2+H2O―→HNO3 C.消除反应能全天候发生 D.使用纳米TiO2的消除效率更高 [解析] 结合题图可知,紫外线在TiO2作用下能得到光生电子和光生空穴,即部分光能转化为化学能,A项正确;结合题图可写出NOx与O2、H2O的总反应为NOx+O2+H2O―→HNO3,B项正确;题述反应必须在紫外线存在时才可以发生,不能全天候发生,C项错误;纳米TiO2与汽车尾气的接触面积更大,能加快反应速率,消除汽车尾气效率会更高,D项正确。 [答案] C 二、非选择题 5.(2019·武汉调研)氧化二氯(Cl2O)是次氯酸的酸酐,用作氯化剂,其部分性质如下: 物理性质 化学性质 常温下,Cl2O是棕黄色有刺激性气味的气体 熔点:-120.6℃;沸点:2.0℃ Cl2O不稳定,接触一般有机物易爆炸;它易溶于水,同时反应生成次氯酸 实验室制备原理:2Na2CO3+H2O+2Cl22NaCl+2NaHCO3+Cl2 7 O。现用下列装置设计实验制备少量Cl2O,并探究相关物质的性质。 (1)装置A中仪器X的名称为________。 (2)若气体从左至右流动,装置连接顺序是A、________(每个装置限用一次)。 (3)装置F中盛装试剂的名称为________。 (4)A中反应的离子方程式为______________________。 (5)当D中收集适量液态物质时停止反应,设计简单实验证明B中残留固体中含有NaHCO3:____________________。 (6)实验完成后,取E中烧杯内溶液滴加品红溶液,发现溶液褪色。该课题组设计实验探究溶液褪色的原因。 ①a=________。 ②由上述实验得出的结论是_________________________。 [解析] (1)仪器X的名称为分液漏斗。(2)根据图像分析可知装置的连接顺序为A、F、B、C、D、E。(3)装置F中盛装饱和食盐水,其作用是除去氯气中的HCl杂质气体。(4)装置A中浓盐酸与MnO2在加热条件下反应生成氯气,其离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。(5)装置B中氯气与潮湿的碳酸钠在加热条件下反应生成氯化钠、碳酸氢钠和氧化二氯,为证明残留固体中含有碳酸氢钠,需先将B中固体溶于蒸馏水,滴加过量的BaCl2溶液,排除碳酸钠的干扰,然后取上层清液再滴加Ba(OH)2溶液,观察是否有白色沉淀生成,若有白色沉淀生成,则证明B中残留固体中含有碳酸氢钠。(6)①实验Ⅰ、Ⅱ、Ⅲ为对照实验,实验中溶液的总体积应相同,均为10.0 mL,故a为5.0。②由表中数据分析知,在其他条件相同时,溶液的碱性越强,次氯酸钠溶液的漂白能力越弱。 [答案] (1)分液漏斗 (2)F、B、C、D、E (3)饱和食盐水 7 (4)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O (5)取B中固体少许于试管中,加蒸馏水溶解,滴加过量BaCl2溶液,振荡静置,取上层清液于另一试管中,再滴加Ba(OH)2溶液,有白色沉淀生成(合理即可) (6)①5.0 ②其他条件相同,碱性越强,次氯酸钠溶液的漂白能力越弱(或次氯酸钠溶液中起漂白作用的是HClO) 拔高练(25分钟) 一、选择题 1.(2019·南昌第一次模拟)化学与生产、生活、社会密切相关。下列做法不正确的是( ) A.碳纳米管是一种比表面积大的有机合成纤维,可用作新型储氢材料 B.空间实验室的硅电池板将光能直接转换为电能 C.在家可用食醋代替CO2来增强漂白粉的漂白性 D.“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指乙烯 [解析] 碳纳米管的主要成分为单质碳,其不属于有机合成纤维,A项错误;空间实验室的硅电池板中单质硅为半导体材料,可将光能直接转换为电能,B项正确;酸性:醋酸>碳酸>次氯酸,故在家可用食醋代替CO2将Ca(ClO)2转化为次氯酸,提高次氯酸的浓度,从而增强漂白性,C项正确;乙烯是植物生长调节剂,可以催熟水果,D项正确。 [答案] A 2.(2019·武汉调研)某地区已探明蕴藏着丰富的赤铁矿、煤、石灰石和黏土,现拟建设大型炼铁厂和与之相关联的焦化厂、发电厂、水泥厂等。下图中工厂名称正确的是( ) A.焦化厂 B.炼铁厂 C.发电厂 D.水泥厂 [解析] 煤炭燃烧可以发电,为其他工厂提供电能,则A为发电厂;煤的干馏能够产生焦炭,而焦炭、赤铁矿、石灰石是炼铁的原料,故B为焦化厂,C为炼铁厂;石灰石和黏土是生产水泥的原料,则D为水泥厂。本题选D。 [答案] D 3.(2019·贵阳监测考试)在给定条件下,下列选项所示的物质间转化均能直接实现的是( ) 7 [解析] S燃烧生成SO2,不能直接转化为SO3,A项错误;NH3在催化剂作用下与O2反应只能转化为NO,B项错误;Fe与盐酸反应生成的是FeCl2,C项错误;AgNO3溶液与氨水反应生成银氨络合离子,该离子具有氧化性,可被醛基(葡萄糖)还原生成Ag,D项正确。 [答案] D 4.(2019·衡水模拟)Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程如下: 下列说法正确的是( ) A.反应Ⅰ中应先通入的气体是CO2 B.反应Ⅱ的离子方程式为CO+SO2===SO+CO2 C.Na2S2O5中含有Na2SO3杂质的原因可能是反应Ⅱ中通入的SO2量不足 D.1 mol Na2S2O5作脱氯剂时理论上能脱氯气1 mol [解析] 反应Ⅰ进行时应先通入NH3,利于CO2的吸收,增大HCO的浓度,便于NaHCO3析出,A项错误;反应Ⅱ中生成的物质应为Na2SO3或NaHSO3,Na2S2O5中的Na与S的物质的量之比为1∶1,根据物料守恒,推断出反应Ⅱ主要生成NaHSO3,离子方程式是CO+2SO2+H2O===2HSO+CO2,B项错误;Na2S2O5中含有Na2SO3杂质的原因可能是反应Ⅱ中通入的SO2量不足,生成了Na2SO3,C项正确;Na2S2O5与Cl2反应的离子方程式为S2O+2Cl2+3H2O===2SO+4Cl-+6H+,1 mol Na2S2O5作脱氯剂时理论上能脱氯气2 mol,D项错误。 [答案] C 二、非选择题 5.(2019·唐山二模)某化学活动小组进行如下实验探究活动。 Ⅰ.甲组同学用如图所示装置制备氨气 7 已知:加热NH4Cl和NaNO2饱和溶液可以制取N2,缓慢通入原料气有利于D中合成氨气。 (1)图示装置从左到右正确的连接顺序(填接口字母) →e→f→g→____→____→____→____。 (2)B、D处的酒精灯最先点燃的是________(填字母)。 (3)装置C的作用:均匀混合气体、__________________________、____________________。 (4)小组经过讨论认为尾气逸出存在安全隐患,可以采用下列哪种方法处理________(填选项字母)。 Ⅱ.乙组同学查阅资料:制取氮气用的亚硝酸钠外观与食盐相似,毒性较强。可以用如下装置(略去部分夹持仪器)制备。 已知:①2NO+Na2O2===2NaNO2; ②酸性条件下,NO和NO2都能与MnO反应生成NO和Mn2+。 (5)装置B中发生反应的离子方程式为______________________;_______________________。 7 (6)玻璃管a在实验过程中除了有________作用,实验结束后还可以通入空气把残存气体排入后面装置吸收,防止污染大气。NO在E中发生反应的离子方程式为________________________________。 [答案] (1)i h j k (2)B (3)干燥气体 观察气泡控制气体流速 (4)BD (5)3Cu+8H++2NO===3Cu2++2NO↑+4H2O 3NO2+H2O===2H++2NO+NO (6)平衡压强 4H++3MnO+5NO===3Mn2++5NO+2H2O 7查看更多