- 2021-07-05 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学必修一氧化还原反应第一课时优秀教学设计
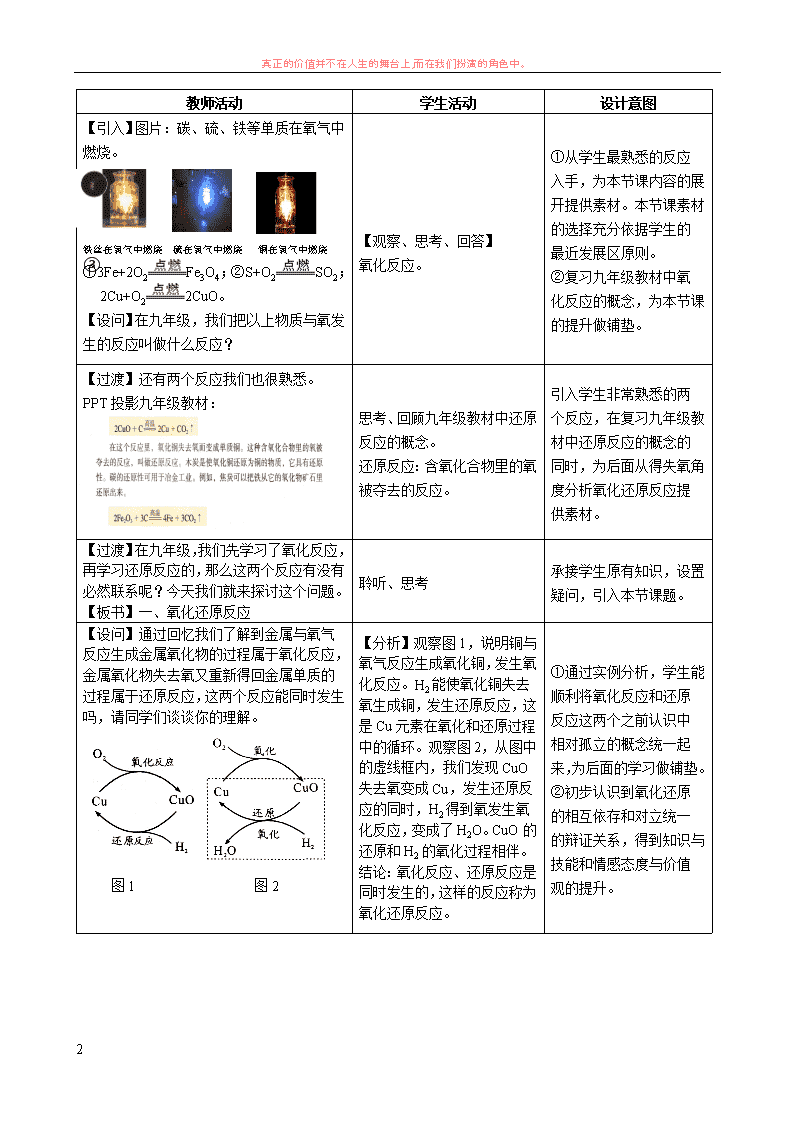
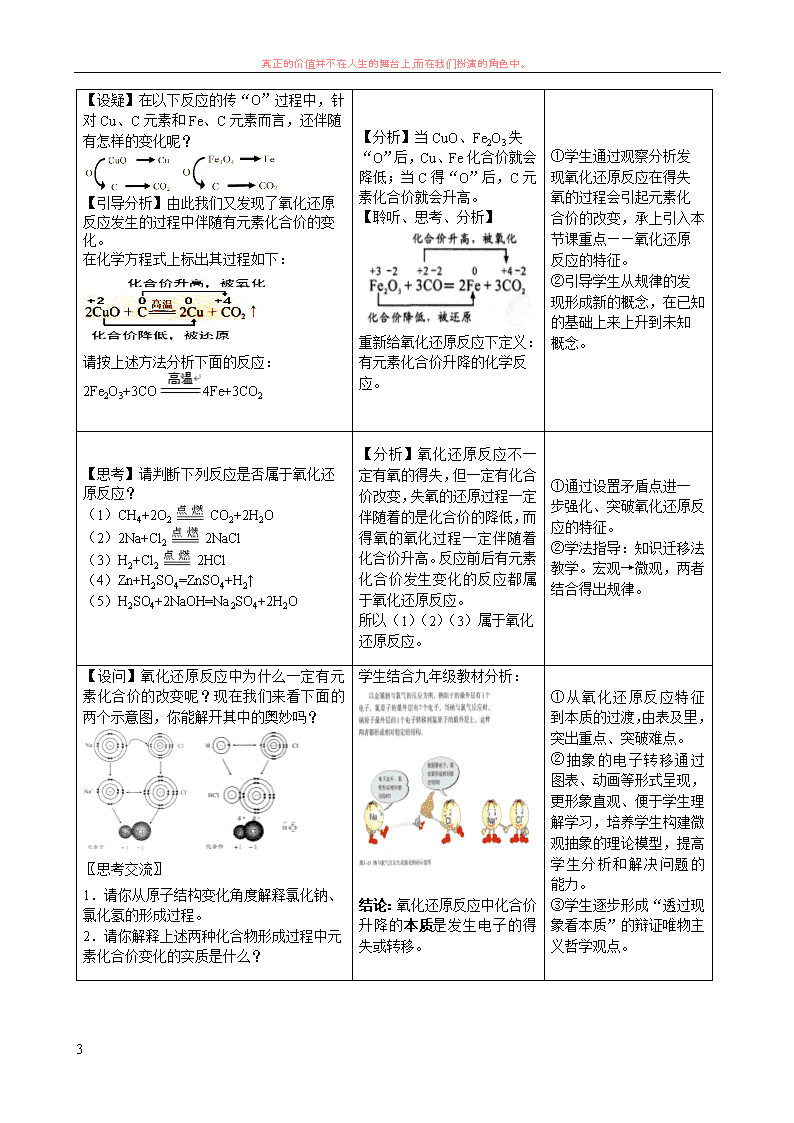
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 1 第三节 氧化还原反应 (第一课时) 【学习目标】 1.知识与技能 (1)通过探究理解氧化反应和还原反应会同时发生的原因,以及氧化还原反应前后有元素化合价的变化; 通过实验探究认识氧化还原反应过程中有电子的转移(得失或偏移),从而理解氧化还原反应的本质。 (2)能正确描述氧化还原反应的有关概念,弄清楚各概念之间的相互关系。 2.过程与方法 (1)体验氧化还原反应从得氧失氧的原始特征到化合价升降的表面现象,再到电子转移的本质原因,层 层推进,逐步深入的发展过程。 (2)通过对氧化还原反应的特征和本质的分析,学习由表及里以及逻辑推理的抽象思维方法。 3.情感态度与价值观 (1)通过氧化和还原这一对典型矛盾,它们既相反又相互依存的关系的认识,深刻体会对立统一规律在 自然现象中的体现,树立用正确的观点和方法学习化学知识。 (2)形成氧化还原反应的化学思想,知道化学概念源于生活源于社会,化学知识又服务生活服务社会, 体验化学概念从生活经验到理性规范的演变过程。 【学习理念和方法】 1.合作式学习——学生分小组进行合作学习,开展生生间、师生间教学活动。 2.探究性学习——初步体验科学探究的方法。 3.阶梯式学习——通过课题设计的“由浅到深、由低到高、由现象到本质”课堂活动,给学生搭建 “认知过程的知识自我构建”之桥。 【学习重点】用化合价升降和电子转移的观点理解氧化还原反应。 【学习难点】理解氧化还原反应的本质。 【学习主线】 【学习过程】 得失氧 化合价 升降 电子 转移 表观 认识 特征 认识 本质 认识 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 2 教师活动 学生活动 设计意图 【引入】图片:碳、硫、铁等单质在氧气中 燃烧。 铁丝在氧气中燃烧 硫在氧气中燃烧 铜在氧气中燃烧 ①3Fe+2O2 Fe3O4;②S+O2 SO2; ③2Cu+O2 2CuO。 【设问】在九年级,我们把以上物质与氧发 生的反应叫做什么反应? 【观察、思考、回答】 氧化反应。 ①从学生最熟悉的反应 入手,为本节课内容的展 开提供素材。本节课素材 的选择充分依据学生的 最近发展区原则。 ②复习九年级教材中氧 化反应的概念,为本节课 的提升做铺垫。 【过渡】还有两个反应我们也很熟悉。 PPT 投影九年级教材: 思考、回顾九年级教材中还原 反应的概念。 还原反应:含氧化合物里的氧 被夺去的反应。 引入学生非常熟悉的两 个反应,在复习九年级教 材中还原反应的概念的 同时,为后面从得失氧角 度分析氧化还原反应提 供素材。 【过渡】在九年级,我们先学习了氧化反应, 再学习还原反应的,那么这两个反应有没有 必然联系呢?今天我们就来探讨这个问题。 【板书】一、氧化还原反应 聆听、思考 承接学生原有知识,设置 疑问,引入本节课题。 【设问】通过回忆我们了解到金属与氧气反 应生成金属氧化物的过程属于氧化反应,金 属氧化物失去氧又重新得回金属单质的过 程属于还原反应,这两个反应能同时发生 吗,请同学们谈谈你的理解。 图 1 图 2 【分析】观察图 1,说明铜与 氧气反应生成氧化铜,发生氧 化反应。H2 能使氧化铜失去 氧生成铜,发生还原反应,这 是 Cu 元素在氧化和还原过程 中的循环。观察图 2,从图中 的虚线框内,我们发现 CuO 失去氧变成 Cu,发生还原反 应的同时,H2 得到氧发生氧 化反应,变成了 H2O。CuO 的 还原和 H2 的氧化过程相伴。 结论:氧化反应、还原反应是 同时发生的,这样的反应称为 氧化还原反应。 ①通过实例分析,学生能 顺利将氧化反应和还原 反应这两个之前认识中 相对孤立的概念统一起 来,为后面的学习做铺 垫。 ②初步认识到氧化还原 的相互依存和对立统一 的辩证关系,得到知识与 技能和情感态度与价值 观的提升。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 3 【设疑】在以下反应的传“O”过程中,针 对 Cu、C 元素和 Fe、C 元素而言,还伴随 有怎样的变化呢? 【引导分析】由此我们又发现了氧化还原反 应发生的过程中伴随有元素化合价的变化。 在化学方程式上标出其过程如下: 请按上述方法分析下面的反应: 2Fe2O3+3CO 4Fe+3CO2 【分析】当 CuO、Fe2O3 失“O” 后,Cu、Fe 化合价就会降低; 当 C 得“O”后,C 元素化合 价就会升高。 【聆听、思考、分析】 重新给氧化还原反应下定义: 有元素化合价升降的化学反 应。 ①学生通过观察分析发 现氧化还原反应在得失 氧的过程会引起元素化 合价的改变,承上引入本 节课重点——氧化还原 反应的特征。 ②引导学生从规律的发 现形成新的概念,在已知 的基础上来上升到未知 概念。 【思考】请判断下列反应是否属于氧化还原 反应? (1)CH4+2O2 CO2+2H2O (2)2Na+Cl2 2NaCl (3)H2+Cl2 2HCl (4)Zn+H2SO4=ZnSO4+H2↑ (5)H2SO4+2NaOH=Na2SO4+2H2O 【分析】氧化还原反应不一定 有氧的得失,但一定有化合价 改变,失氧的还原过程一定伴 随着的是化合价的降低,而得 氧的氧化过程一定伴随着化 合价升高。反应前后有元素化 合价发生变化的反应都属于 氧化还原反应。 所以(1)(2)(3)属于氧化 还原反应。 ①通过设置矛盾点进一 步强化、突破氧化还原反 应的特征。 ②学法指导:知识迁移法 教学。宏观→微观,两者 结合得出规律。 【设问】氧化还原反应中为什么一定有元素 化合价的改变呢?现在我们来看下面的两 个示意图,你能解开其中的奥妙吗? 〖思考交流〗 1.请你从原子结构变化角度解释氯化钠、 氯化氢的形成过程。 2.请你解释上述两种化合物形成过程中元 素化合价变化的实质是什么? 学生结合九年级教材分析: 结论:氧化还原反应中化合价 升降的本质是发生电子的得 失或转移。 ①从氧化还原反应特征 到本质的过渡,由表及 里,突出重点、突破难点。 ②抽象的电子转移通过 图表、动画等形式呈现, 更形象直观、便于学生理 解学习,培养学生构建微 观抽象的理论模型,提高 学生分析和解决问题的 能力。 ③学生逐步形成“透过现 象看本质”的辩证唯物主 义哲学观点。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 4 【教师】氧化还原反应中元素化合价的升高 是有电子的失去或偏离的结果,而元素化合 价的降低则说明化学变化中伴随着电子的 得到或偏向。物质守恒决定了在化学变化过 程中电子是不能自生自灭的,有电子的“失 去”就有电子的“得到”,有电子的“偏离” 就有电子的“偏向”。因而,氧还反应与还 原反应总是相伴而行。 思考、聆听 ①进一步从化合价升降、 得失电子的角度强化氧 化还原的相互依存和对 立统一的辩证关系。 ②学法指导:对氧化还原 反应反应概念认识不断 深入的过程体现了人们 对事物认识的一般规律。 【过渡】现在我们从氧化还原反应角度再一 起探究九年级实验室制取氢气的实验。 实验中我们看到锌粒表面有气泡产生,为什 么呢?能否从氧化还原反应角度分析? 【思考、交流、分析】 反应过程中,Zn 失去电子变 成 Zn2+,H+得到电子变成 H2, 结合实验现象,氢气是从锌粒 表面产生的,说明 Zn 失去的 电子立即被 H+捕获,因此我 们可以将这一过程表示如下。 承上启下。通过分析学生 熟知的实验室制取氢气 的反应一面是对前面学 习知识的应用,同时引入 后面实验论证氧化还原 反应本质的素材。 【设问】我们能设计实验更直观地证明 Zn 把电子失去给了 H+吗?请同学们动手实验 并解释观察到的现象。 【学生实验】 装置 现象 解释 结论 【演示实验】 【观察、思考、分析】 现象 解释 无明显现象 Cu 不能与稀 硫酸反应 铜丝的另一 端产生气泡 Zn 表面的电 子被引导到 铜丝的另一 端给了 H+ 氧化还原反应中有电子的 转移 ①通过探究实验的设计 和分析,学生更直观理解 氧化还原反应的本质,进 一步突破本节课的难点。 ②学法指导: 发现问题→提出假设→ 实验验证→得出结论。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 5 【小结】通过探究我们从得氧失氧对氧化 还原反应的初步认识,进一步了解了氧化还 原反应中有化合价的升降,化合价升降的本 质是氧化还原反应中电子的转移。经过这几 个阶段我们对氧化还原反应有了新的认识: 【思考】同学们能用文字将上述概念概括整 合出来吗? 【聆听、思考、总结】 ①通过概念的整合培养 学生观察、分析、总结归 纳的能力。 ②通过“发现问题、分析 论证、总结归纳”等教学 环节,完成认知过程中的 阶梯搭建。 【设疑】氧化还原反应与人类有着深厚的渊 源。黑火药是我国古代的四大发明之一,黑 火药反应的化学方程式为:S + 2KNO3+ 3C = K2S + N2 ↑+ 3CO2 ↑,你能指出其中的被氧 化元素和被还原元素吗? 【思考、分析】 被氧化的元素:C 被还原的元素:N 和 S 应该所学知识解决生活 的问题,巩固知识。 【问题】请同学们谈谈生活中应用氧化还原 反应的例子。 PPT 图片展示:我们身边的氧化还原反应 钢铁腐蚀、电池、金属冶炼、电镀等。 【思考、回答】 感受氧化还原反应的魅 力,激发学生学习化学的 热情。 【课后思考】课本 P37 <学与问> 尝试画出化合反应、分解反应、置换反应与氧化还原反应的交叉分类 示意图,并列举具体的化学反应加以说明。 通过化学反应类型分类 的练习培养学生在化学 学习中形成分类的思想。 【板书设计】 一.氧化还原反应 氧化反应:得到氧→化合价升高→失去电子 还原反应:失去氧→化合价降低→得到电子 ↓ ↓ 特征 本质 概念 从 化 合 价 升 降 角度 从 电 子 得 失 角 度 氧化 反应 还原 反应查看更多