湖南省永州市2019-2020高一化学下学期期末试题(Word版附答案)
永州市2020年上期高一期末质量监测试卷
化学
考生注意:
1.本试卷分为第I卷和第II卷,共21道小题。满分为100分,考试时量90分钟。
2.考生务必将各题的答案填写在答题卡的相应位置,在本试卷上作答无效。考试结束
后只交答题卡。
3.可能用到的相对原子质量:H1 C12 O16 S32 Fe56 I127
第I卷(选择题 共48分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
1.在“新冠肺炎战疫”中,化学知识发挥了重要作用。下列物质不能杀灭冠状病毒的是
A.双氧水 B.84消毒液 C.75%的医用酒精 D.明矾溶液
2.钇(Y)是一种重要超导材料的组成元素。下列关于89Y的说法不正确的是
A.质量数为89 B.核外电子数为39 C.中子数为128 D.钇是金属元素
3.下列物质含有离子键是
A.H2 B.Fe C.NaCl D.HCl
4.下列说法不正确的是
A.糖类都能水解 B.乙烯可用作水果催熟剂
C.可用灼烧的方法鉴别蚕丝和棉花 D.工业上利用油脂在碱性条件的水解反应制取肥皂
5.下列化学用语正确的是
A.葡萄糖的分子式:C12H22O11 B.NH3的结构式:
C.Cl-的结构示意图: D.CO2的电子式:
6.以下铜锌原电池工作原理认知模型图中,不正确的是
A.正负极标注 B.电极反应式 C.电子移动方向 D.H+的移动方向
7.2019年是“国际化学元素周期表年”。下列对元素周期表的认识正确的是
A.周期表中共有18个族
B.第一、二、三周期为短周期
C.第三周期主族元素原子半径自左向右依次增大
D.第二周期主族元素从左到右,最高正化合价从+1递增到+7
8.下列比较不正确的是
A.密度:Na>Li B.稳定性:HF
H2SO4 D.碱性:NaOH>Mg(OH)2
9.决定化学反应速率的主要因素是
A.反应温度 B.反应物的浓度 C.反应物本身的性质 D.反应物之间的接触面积
10.下列金属的冶炼方法与工业上冶炼铝的方法相同的是
A.Fe2O3+3CO2Fe+3CO2 B.2Ag2O4Ag+O2↑
C.Fe+CuSO4=FeSO4+Cu D.2NaCl(熔融)2Na+Cl2↑
11.如图所示,有关化学反应和能量变化的说法正确的是
A.图a表示的是放热反应的能量变化
B.图a中反应物的总能量高于生成物的总能量
C.图b可以表示反应HCl+NaOH=NaCl+H2O的能量变化
D.图b所示反应不需要加热就能发生
12.某有机物的结构简式如图所示。下列关于该有机物的说法不正确的是
A.分子式为C8H11O2 B.能发生酯化反应
C.能使酸性KMnO4溶液褪色 D.1 mol该有机物最多能与1 mol H2发生加成反应
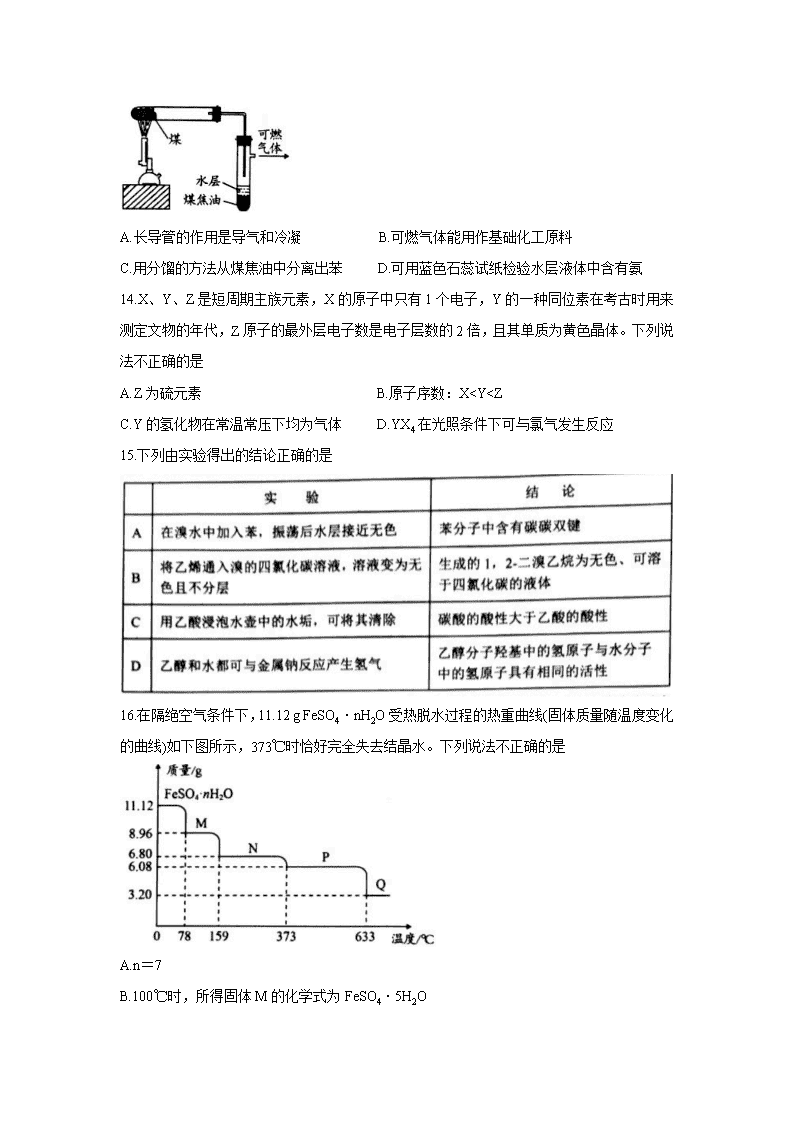
13.右图是模拟煤的干馏实验装置。下列说法不正确的是
A.长导管的作用是导气和冷凝 B.可燃气体能用作基础化工原料
C.用分馏的方法从煤焦油中分离出苯 D.可用蓝色石蕊试纸检验水层液体中含有氨
14.X、Y、Z是短周期主族元素,X的原子中只有1个电子,Y的一种同位素在考古时用来测定文物的年代,Z原子的最外层电子数是电子层数的2倍,且其单质为黄色晶体。下列说法不正确的是
A.Z为硫元素 B.原子序数:X”或“<”)。
(4)⑨的原子序数是 。
(5)元素④~⑧中,最高价氧化物属于两性氧化物的是 (填元素符号)。.
18.(10分)合成氨是人类科学技术发展史上的一项重大成就。在恒温条件下将物质的量均为1mol的N2和H2充入1 L的恒容密闭容器中,发生反应N2(g)+3H2(g)2NH3(g), X、Y为反应体系中的两种物质,其浓度随时间变化关系如图所示:
(1)Y代表的物质是 (填化学式)。
(2)0~10 min内用X的物质的量浓度变化表示的平均反应速率为 mol·L-1·min-1。
(3)下列说法不正确的是 (填标号)。
A.图中A点时:v正(X)>v逆(X)
B.图中C点时:v正(Y)=v逆(Y)=0
C.该条件下,反应达到平衡时,N2的转化率为15%
(4)利用生物燃料电池原理可在室温下合成氨,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示:
①电极a为 极(填“正”或“负”)。
②请写出N2在固氮酶的作用下生成NH3的离子方程式 。
19.(10分)乙烯是重要的基础化工原料,通过以下流程可以合成具有芳香气味的酯F。已知B是最简单的芳香烃,其摩尔质量为78 g·mol-1。请回答下列问题:
(1)B的结构简式为 ,A→E的有机反应类型为 。
(2)D分子中所含官能团的名称是 。
(3)写出D与E反应生成F的化学方程式 。
(4)下列说法不正确的是 (填标号)。
A.有机物D、E、F可以通过饱和Na2CO3溶液区分
B.E物质不能被酸性高锰酸钾溶液氧化
C.C物质可通过硝化反应得到
D.CH2=CH2通过加聚反应得到的聚乙烯可以使溴水褪色
20.(10分)乙醚是有机合成中重要的溶剂,在医药上常用作麻醉剂。实验室可用如图所示装置制备乙醚(夹持和加热装置均省略):
反应原理如下:
主反应2CH3CH2OHCH3CH2OCH2CH3+H2O
副反应CH3CH2OHCH2=CH2↑十H2O
CH3CH2OHCH3COOH
实验中可能用到的数据:
实验过程:
①在三颈烧瓶中加入12 mL质量分数为92%乙醇(相对密度为0.80 g·cm-3)和12 mL浓硫酸,再加入几粒沸石,分液漏斗中盛有25 mL质量分数为92%乙醇,按图连接好装置;
②加热,将温度迅速上升到140℃,开始向三颈烧瓶中滴加乙醇,维持反应温度在140℃,乙醇全部滴入后,继续反应一段时间,停止加热;
③将馏出液转入分液漏斗,分别用氢氧化钠溶液、饱和氯化钠溶液、饱和氯化钙溶液洗涤,得到有机粗产品;
④用无水氯化钙干燥粗产品至澄清,过滤,将滤液进行蒸馏,得到4.8 g乙醚。
请回答下列问题:
(1)仪器a的名称是 。
(2)混合浓硫酸和乙醇的实验操作是 。
(3)反应温度不超过140℃,其目的是 。
(4)提纯乙醚时氢氧化钠溶液的作用是 。
(5)本实验中乙醚的产率为 %(结果保留小数点后一位数字)。
21.(12分)海洋是巨大的化学资源宝库。以下是从海带中获取粗碘操作流程图,请回答下列问题:
(1)灼烧海带得到海带灰,经过浸取后得到海带提取液。下图所示装置可用于灼烧海带的是
(填标号)。
(2)反应①中的氧化剂是 (填化学式)。
(3)上述流程,进行操作I时加入的有机试剂为 (填“苯”或“四氯化碳”)。
(4)操作II的名称为 。
(5)反应②所得下层溶液,碘元素主要以I-和IO3-存在,写出反应③得到I2的离子方程式 。
(6)为测定某含碘废液中I2的含量,取a mL废液,调节溶液pH后,加入Na2S2O3溶液,恰好完全反应时消耗c mol/L Na2S2O3溶液b mL(已知:I2+2S2O32-=2I-+S4O62-),则废液中I2的含量为 mg/mL。
永州市2020年上期高一期末质量监测
化学参考答案及评分标准
一、选择题(每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
D
C
C
A
B
A
B
B
C
D
C
A
D
C
B
B
二、填空题(共52分)
17.(10分)
(1)硅(2分)
(2)Na(2分)
(3)<(2分)
(4)34(2分)
(5)Al (2分)
18.(10分)
(1) NH3(2分)
(2)0.045(2分)
(3)B(2分)
(4)①负(2分) ②N2+6H++6MV+=2NH3+6MV2+(2分)
19.(10分)
(1)或(2分) 加成反应或加成(2分)
(2)羧基(2分)
(3)(2分)
(4)BD(2分,选对2个得2分,选对一个得1分,选错1个得0分)
20.(10分)
(1)直形冷凝管或冷凝管(2分)
(2)在乙醇中缓慢加入浓硫酸,并用玻棒不断搅拌(2分)
(3)避免发生副反应(2分)
(4)除去乙酸、亚硫酸(2分,不写“亚硫酸”亦给分)
(5)21.9(2分)
21.(12分)
(1)B(2分)
(2)H2O2(2分)
(3)苯(2分)
(4)过滤(2分)
(5)5I-++6H+===3I2+3H2O(2分)
(6) (2分)