- 2021-07-03 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省2021版高考化学一轮复习课时规范练35原子结构与性质含解析 人教版
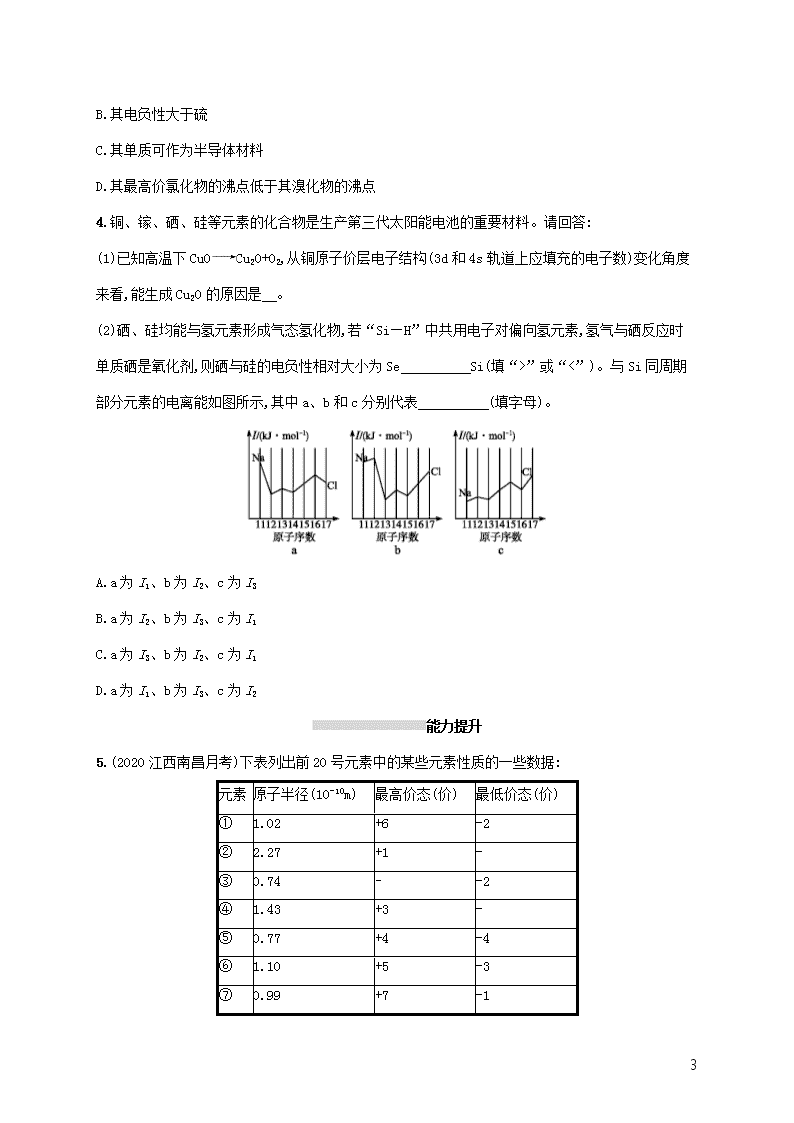
1 课时规范练 35 原子结构与性质 基础巩固 1.(2020 四川广安调研)第四周期有 14 种金属元素,其中 4 种为主族元素,10 种为过渡元素。 (1)锰元素在周期表中的位置为 ;属于 区元素(填“s”“p”“d”“ds”或 “f”)。 (2)基态铬原子的电子排布式为 ,与铬同周期的所有元素的基态原子中,最外层电子数与 铬原子相同的有 。 (3)基态 Fe 原子中,电子占据的最高能层的符号为 ,该能层具有的原子轨道数 为 ,电子数为 。 (4)As、Se、Br 元素的电负性由大到小的顺序为 ,第一电离能由大到小的顺序 为 。 (5)铜、锌两种元素的第一电离能、第二电离能如表所示: 电离能/( kJ·mol-1) I1 I2 铜 746 1 958 锌 906 1 733 铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原 因是 。 2.(2020 湖北监利质检)右表为元素周期表前三周期的一部分: (1)X 的氢化物的稳定性与 W 的氢化物的稳定性比较 > (填化学式),原因 是 。 (2)X 的基态原子的电子排布图(轨道表示式)是 (填序号), 2 另一电子排布图不能作为基态原子的电子排布图是因为它不符合 (填选项字母)。 A.能量最低原理 B.泡利原理 C.洪特规则 (3)以上五种元素中, (元素符号)元素第一电离能最大。 (4)由以上某种元素与氢元素组成的三角锥形分子 E 和由以上某种元素组成的直线形分子 G 反应, 生成两种直线形分子 L 和 M(组成 E、G、L、M 分子的元素原子序数均小于 10),反应过程如图所示, 该反应的化学方程式 为 。 3.(1)C、N、O、Al、Si、Cu 是常见的六种元素。 ①Si 位于元素周期表第 周期 族。 ②N 的基态原子核外电子排布式为 ;Cu 的基态原子最外层有 个电子。 ③用“>”或“<”填空: 原子半径 电负性 熔点 沸点 Al Si N O 金刚石 晶体硅 CH4 SiH4 (2)①N、Al、Si、Zn 四种元素中,有一种元素的电离能数据如下: 电离能 I1 I2 I3 I4 …… In/(kJ·mol-1) 578 1 817 2 745 11 578 …… 则该元素是 (填写元素符号)。 ②基态锗(Ge)原子的电子排布式是 。Ge 的最高价氯化物的分子式是 。 ③Ge 元素可能的性质或应用有 。 A.是一种活泼的金属元素 3 B.其电负性大于硫 C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点 4.铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答: (1)已知高温下 CuO Cu2O+O2,从铜原子价层电子结构(3d 和 4s 轨道上应填充的电子数)变化角度 来看,能生成 Cu2O 的原因是 。 (2)硒、硅均能与氢元素形成气态氢化物,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时 单质硒是氧化剂,则硒与硅的电负性相对大小为 Se Si(填“>”或“<”)。与 Si 同周期 部分元素的电离能如图所示,其中 a、b 和 c 分别代表 (填字母)。 A.a 为 I1、b 为 I2、c 为 I3 B.a 为 I2、b 为 I3、c 为 I1 C.a 为 I3、b 为 I2、c 为 I1 D.a 为 I1、b 为 I3、c 为 I2 能力提升 5.(2020 江西南昌月考)下表列出前 20 号元素中的某些元素性质的一些数据: 元素 原子半径(10-10m) 最高价态(价) 最低价态(价) ① 1.02 +6 -2 ② 2.27 +1 - ③ 0.74 - -2 ④ 1.43 +3 - ⑤ 0.77 +4 -4 ⑥ 1.10 +5 -3 ⑦ 0.99 +7 -1 4 ⑧ 1.86 +1 - ⑨ 0.75 +5 -3 ⑩ 1.17 +4 -4 请回答下列问题: (1)以上 10 种元素中,第一电离能最小的是 (填序号)。 (2)上述⑤⑥⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足 8 电子稳定结构的物 质可能是 (写分子式)。元素⑨和⑩形成的化合物的化学式 为 ,元素①的原子价电子排布式是 。 (3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是 (填化学式)。 (4)③和⑨两元素比较,非金属性较弱的是 (填名称),可以验证你的结论的是下列中的 (双选;填选项字母)。 A.气态氢化物的挥发性和稳定性 B.单质中的键能 C.两元素的电负性 D.含氧酸的酸性 E.氢化物中 X—H 键的键长(X 代表③和⑨两元素) F.两单质在自然界的存在形式 6.根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下面各题。 元素代号 I1 I2 I3 I4 I5 Q 800.6 2 427.1 3 659.7 25 025.8 32 826.7 R 495.8 4 562 6 910.3 9 543 13 354 S 577.5 1 816.7 2 744.8 11 577 14 842 T 1 402.3 2 856 4 578.1 7 475.0 9 444.9 U 2 080.7 3 952.3 6 122 9 371 12 177 5 (1)在这五种元素中,最可能处于同一族的两种元素是 (填元素符号),S 元素最可能是 区元素 (2)基态 Q 元素原子的价电子排布式是 。Q 和 T 同周期。化合物 QT 中 T 元素的化合 价为 ;第一电离能介于 Q、T 之间的同周期元素有 种。 (3)化合物 RT3 中化学键类型为 ,RT3 的阴离子的几何构型为 。 (4)下列元素中,化学性质和物理性质最像 U 元素的是 。 A.硼 B.铍 C.锂 D.氦 E.碳 7.下表是周期表的一部分,试回答下列问题。 族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ 4 ⑩ (1)表中元素中,第一电离能最小的元素是 (填元素符号,下同),电负性最大的 元素是 ,单质中化学性质最不活泼的是 (填化学式)。 (2)表中元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同),碱 性最强的是 ,呈两性的氢氧化物是 。 (3)表中ⅦA 族元素中最不稳定的氢化物是 (填化学式)。 (4)为什么表中④的第一电离能比⑤大? 。 8.有 A、B、C、D、E 5 种元素,它们的核电荷数依次增大,且都小于 20。其中 A 为非金属元素;A 和 E 属同一族,它们的原子最外层电子排布为 ns1,B 和 D 也属同一族,它们的原子最外层的 p 能级电子 数均是 s 能级电子数的两倍。C 原子最外层电子数等于 D 原子最外层电子数的一半。请回答下列问 题: (1)写出 5 种元素的元素符号:A 是 ,B 是 ,C 是 ,D 是 ,E 是 。 6 (2)由这五种元素组成的一种化合物是 (写化学式)。写出该 物质的一种主要用途: 。 (3)写出 C 元素基态原子的电子排布式: 。 (4)用电子排布图表示 D 元素原子的价电子排布 为 。 (5)元素 B 与 D 的电负性的大小关系是 B D(填“>”“<”或“=”,下同),C 与 E 的第一 电离能的大小关系是 C E。 拓展深化 9.现有七种元素,其中 A、B、C、D、E 为短周期主族元素,F、G 为第四周期元素,它们的原子序数依 次增大。请根据下列相关信息,回答问题。 A 元素的核外电子数和电子层数相等 B 元素原子的核外 p 电子数比 s 电子数少 1 C 原子的第一至第四电离能依次为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1 D 原子核外所有 p 轨道全满或半满 E 元素的主族序数与周期数的差为 4 F 是前四周期中电负性最小的元素 G 在元素周期表的第七列 (1)已知 BA5 为离子化合物,写出其电子式: 。 (2)B 元素基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。 (3)某同学根据上述信息,推断 C 的基态原子的核外电子排布图如下: 该同学所画的电子排布图违背了 。 (4)G 位于 族 区,该元素的价电子排布式为 。 7 (5)检验 F 元素的方法是 ,请用原子结构的知识解释产生此现象的原 因: 。 课时规范练 35 原子结构与性质 1.答案:(1)第四周期第ⅦB 族 d (2)1s22s22p63s23p63d54s1 或[Ar]3d54s1 K、Cu (3)N 16 2 (4)Br>Se>As Br>As>Se (5)Cu 失去一个电子变成电子排布为[Ar]3d10 的 Cu+,能量较低,结构稳定,所以 Cu 的第二电离 能相对较大(或 Zn 失去一个电子变成电子排布为[Ar]3d104s1 的 Zn+,易再失去一个电子,所以 Zn 的 第二电离能相对较小。或 Cu 原子失去一个电子后,核外电子排布式为[Ar]3d10,而锌原子失去 1 个 电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以 Cu 的第二电离能相对较大) 解析:(1)Mn 的原子序数为 25,Mn 原子的电子排布式为 1s22s22p63s23p63d54s2,位于第四周期ⅦB 族, 属于 d 区元素。(2)基态铬原子核外有 24 个电子,电子排布式为 1s22s22p63s23p63d54s1 或[Ar]3d54s1, 第四周期最外层电子数为 1 的原子还有 K、Cu。(3)基态 Fe 原子核外有 4 个电子层,电子占据的最 高能层为第四层,符号为 N。该能层有 s、p、d、f 四个能级,原子轨道数为 1+3+5+7=16。其价层电 子排布式为 3d64s2,故 N 层的电子数为 2。(4)同周期元素从左到右(稀有气体除外)电负性逐渐增大, 故电负性为 Br>Se>As。同周期元素从左到右第一电离能呈增大趋势,但由于 As 的 4p 能级半充满, 为稳定结构,其第一电离能大于 Se,故第一电离能为 Br>As>Se。(5)根据 Cu、Zn 失去一个电子后的 结构,分析再失去一个电子的难易,从而比较 Cu、Zn 的第二电离能。 2.答案:(1)NH3 PH3 氮元素的非金属性(或电负性)比磷强(或者是 N—H 键的键长比 P—H 键的短) (2)② C (3)Ne (4)2NH3+3F2 6HF+N2 解析:根据元素周期表的结构可知 X 为 N,Z 为 F,R 为 Ne,W 为 P,Y 为 S。 (1)X、W 的氢化物分别为 NH3 和 PH3,非金属性越强气态氢化物越稳定。 8 (2)当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋状态相同,因此 氮元素的基态原子的电子排布图为 。 (3)原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有 关。结构越稳定,失去电子所需能量越高,在所给五种元素中,氖元素最外层已达 8 电子的稳定结构, 因此失去核外第一个电子需要的能量最多,即第一电离能最大。 (4)根据题给图示可知 E 为 NH3,G 为 F2,L 为 HF,M 为 N2,反应的化学方程式为 2NH3+3F2 6HF+N2。 3.答案:(1)①三 ⅣA ②1s22s22p3 1 ③> < > < (2)①Al ②1s22s22p63s23p63d104s24p2 GeCl4 ③CD 解析:(1)①Si 是 14 号元素,位于元素周期表中第三周期ⅣA 族。②N 是 7 号元素,其基态原子核外 电子排布式为 1s22s22p3;Cu 是 29 号元素,其基态原子核外电子排布式为 1s22s22p63s23p63d104s1,故 最外层有 1 个电子。③同周期元素,原子序数越大,原子半径越小,故原子半径:Al>Si;同周期元素, 原子序数越大(稀有气体除外),电负性越大,故电负性:N查看更多