- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省2021版高考化学一轮复习课时规范练28化学实验常用仪器和基本操作含解析 人教版
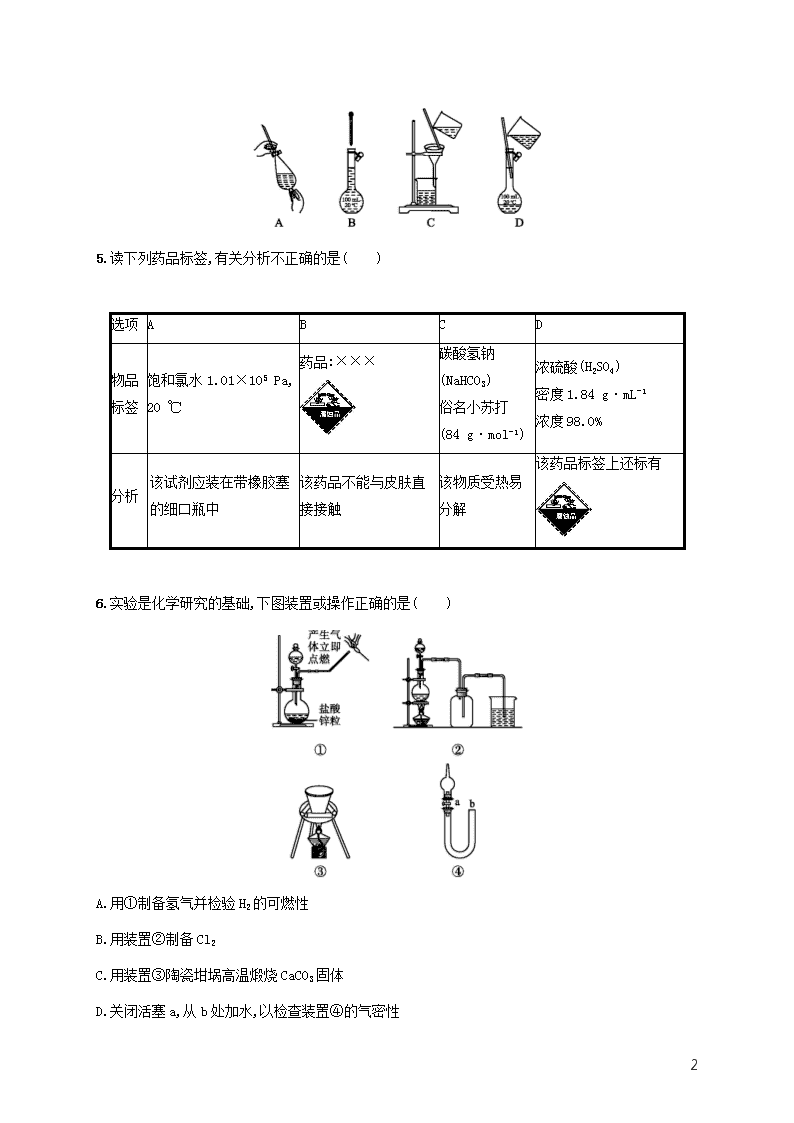
课时规范练28 化学实验常用仪器和基本操作 基础巩固 1.(2020河北张家口月考)下列选用的相关仪器、用品不符合实验要求的是( ) A B C D 准确量取19.01 mL水 新制氯水的保存 测定0.1 mol·L-1 Na2CO3溶液的pH 分离水和乙酸乙酯 25 mL酸式滴定管 带玻璃塞的棕色细口瓶 镊子、pH试纸、表面皿 分液漏斗、烧杯 2.(2020江苏镇江调研)下列有关实验的操作正确的是( ) A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 C.为观察镁条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的镁条用坩埚钳夹持,点燃后迅速投入上述集气瓶底部 D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测其pH 3.(2019全国2,10)下列实验现象与实验操作不相匹配的是( ) 实验操作 实验现象 A. 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 溶液的紫色逐渐褪去,静置后溶液分层 B. 将镁条点燃后迅速伸入集满CO2的集气瓶 集气瓶中产生浓烟并有黑色颗粒产生 C. 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 有刺激性气味气体产生,溶液变浑浊 D. 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变 4.(2019浙江4月选考,3)下列图示表示过滤的是( ) 8 5.读下列药品标签,有关分析不正确的是( ) 选项 A B C D 物品 标签 饱和氯水1.01×105 Pa, 20 ℃ 药品:××× 碳酸氢钠(NaHCO3) 俗名小苏打 (84 g·mol-1) 浓硫酸(H2SO4) 密度1.84 g·mL-1 浓度98.0% 分析 该试剂应装在带橡胶塞的细口瓶中 该药品不能与皮肤直接接触 该物质受热易分解 该药品标签上还标有 6.实验是化学研究的基础,下图装置或操作正确的是( ) A.用①制备氢气并检验H2的可燃性 B.用装置②制备Cl2 C.用装置③陶瓷坩埚高温煅烧CaCO3固体 D.关闭活塞a,从b处加水,以检查装置④的气密性 8 7.(2020湖北大冶一中月考)现有中学化学常见仪器如图所示。 请回答下列问题: (1)g仪器的名称是 。k仪器在混合物分离实验中的作用是 。 (2)分离乙醇和二甲醚(CH3OCH3)混合物的操作需要用到上述仪器中的 (填字母)。 (3)除去乙烯中少量的二氧化硫杂质,应选择仪器 (填字母),试剂名称是 。 (4)实验室需要配制0.4 mol·L-1的NaOH溶液230 mL。 ①需要用托盘天平称取NaOH g。 ②需要用到的玻璃仪器有 。 ③由于操作错误,使制得的NaOH溶液浓度偏大的是 (填字母)。 A.溶液没有冷却就转移到容量瓶中,并加水定容 B.使用容量瓶配制溶液时,俯视液面定容 C.转移完溶液后,没有用蒸馏水洗涤烧杯和玻璃棒 D.容量瓶只用蒸馏水洗净,没有烘干 E.定容时,滴加蒸馏水,先使凹液面最低处略高于刻度线,再吸出少量水使凹液面与刻度线相切 F.将配制好的溶液倒入刚用蒸馏水洗净未烘干的试剂瓶中 能力提升 8.(2019江苏化学,13)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( ) 8 选项 实验操作和现象 结论 A 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 X溶液中一定含有Fe3+ B 向浓度均为0.05 mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 Ksp(AgI)> Ksp(AgCl) C 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL 淀粉溶液,溶液显蓝色 Br2的氧化性比I2的强 D 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 HNO2电离出H+的能力比CH3COOH的强 9.(2019天津理综,4)下列实验操作或装置能达到目的的是( ) A B 混合浓硫酸和乙醇 配制一定浓度的溶液 C D 收集NO2气体 证明乙炔可使溴水褪色 10.下列有关实验装置或操作进行的相应实验,能达到实验目的的是( ) A.用图甲所示装置分离乙醇和碘的混合液 B.用图乙所示操作配制100 mL 0.1 mol·L-1硫酸溶液 C.用图丙所示装置制备氨气 8 D.用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫 拓展深化 11.(2020贵州黔东南调研)氯化亚铜(CuCl)可用作催化剂、杀菌剂、媒染剂、脱色剂。CuCl是一种白色粉末,微溶于水、不溶于乙醇,在潮湿的空气中易被氧化。实验室采用如图装置和下列步骤制备氯化亚铜。 步骤1:在三颈烧瓶中加入20%盐酸、食盐、铜屑,加热至60~70 ℃,开动搅拌器,同时从c口缓慢通入氧气,制得Na[CuCl2]溶液。 步骤2:反应完全后,冷却、过滤,滤液用适量的水稀释,析出CuCl。 步骤3:过滤,分别用盐酸、乙醇洗涤滤出的固体。 步骤4:在真空干燥器中60~70 ℃干燥2 h,冷却后得到产品。 回答下列问题: (1)质量分数为20%的盐酸密度为1.1 g·cm-3,其物质的量浓度为 ;配制20%的盐酸需要的玻璃仪器有: 、烧杯、玻璃棒、胶头滴管。 (2)步骤1中制得Na[CuCl2]的化学方程式为 。 8 (3)根据“步骤2中用水稀释滤液能得到CuCl”推测,滤液中存在的平衡是 。 (4)析出的CuCl晶体不用水而用盐酸、乙醇分别洗涤的目的是 。 (5)测定产品中氯化亚铜的质量分数,实验过程如下: 准确称取制备的氯化亚铜产品0.25 g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.10 mol·L-1的硫酸铈[Ce(SO4)2]标准溶液滴定到终点,消耗硫酸铈溶液24.50 mL,反应中Ce4+被还原为Ce3+。(已知:CuCl+FeCl3CuCl2+FeCl2) ①硫酸铈标准溶液应盛放在 (填“酸”或“碱”)式滴定管中。 ②产品中氯化亚铜的质量分数为 。 课时规范练28 化学实验常用仪器和基本操作 1.C 滴定管的测量精度为0.01mL,A项正确;新制氯水见光易分解,且易挥发,具有强氧化性,应用带玻璃塞的棕色细口瓶盛放,B项正确;测定溶液pH时,应用玻璃棒蘸取待测液,点在pH试纸上,待试纸变色后再与标准比色卡对照,缺少玻璃棒,C项错误;水和乙酸乙酯不相溶,可用分液的方法分离,故需用分液漏斗、烧杯,D项正确。 2.A 先加稀盐酸,可以排除Ag+等的干扰,再加入BaCl2溶液,产生的白色沉淀是硫酸钡,若依次加入BaCl2溶液和稀盐酸,产生的白色沉淀可能是硫酸钡,也可能是氯化银,故B错误;镁条不能投入集气瓶底部,应用坩埚钳夹持燃烧,故C错误;NaClO有强氧化性,可将pH试纸漂白,故不能用pH试纸测其pH,故D错误。 3.A 乙烯能被酸性高锰酸钾氧化为CO2,反应后气体逸出,静置后溶液不分层,A项错误;将镁条点燃后迅速伸入集满CO2的集气瓶,镁条在CO2中剧烈燃烧,反应的化学方程式为2Mg+CO22MgO+C,反应产生大量浓烟,集气瓶内壁上有黑色固体生成,B项正确;硫代硫酸钠与盐酸反应的化学方程式为Na2S2O3+2HCl2NaCl+H2O+SO2↑+S↓,SO2有刺激性气味,S不溶于水,使溶液变浑浊,C项正确;FeCl3与过量铁粉反应生成Fe2+,加KSCN后溶液不变色,D项正确。 4.C A项,该操作表示萃取,所以错误;B项,该操作表示配制一定物质的量浓度溶液时的定容操作,所以错误;C项,该操作表示过滤,所以正确;D项,该操作表示配制一定物质的量浓度溶液时的移液操作,所以错误。 8 5.A 氯水具有强氧化性,不能使用橡胶塞,A项错误;腐蚀品会腐蚀皮肤,故不能直接接触皮肤,B项正确;碳酸氢钠受热易分解:2NaHCO3Na2CO3+CO2↑+H2O,C项正确;98%的浓硫酸具有腐蚀性,D项正确。 6.D 点燃可燃性气体前必须验纯,故A项错误;氯气密度比空气大,应用向上排空气法收集,图中进气管太短,出气管太长,故B项错误;高温下碳酸钙会腐蚀陶瓷坩埚,故C项错误;关闭活塞a,从b处加水,如果U形管两侧形成液面差且在一段时间内不变化,可说明气密性良好,能达到实验目的,故D项正确。 7.答案:(1)冷凝管 搅拌、引流 (2)dghi (3)a 氢氧化钠溶液 (4)①4.0 ②烧杯、玻璃棒、250 mL容量瓶、胶头滴管 ③AB 解析:(1)玻璃棒在溶解、过滤中的作用分别是搅拌、引流。(2)分离乙醇和二甲醚的方法是蒸馏,需要用到酒精灯、蒸馏烧瓶、冷凝管、锥形瓶。(3)除去乙烯中二氧化硫需要用洗气瓶,用NaOH溶液吸收二氧化硫。(4)①实验室没有230mL的容量瓶,需要用250mL的容量瓶进行配制,计算可得需称取4.0gNaOH。②需要用到的玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管。③A、B项使制得的NaOH溶液浓度偏大,D项没有影响,C、E、F项使制得的NaOH溶液浓度偏小。 8.C 检验Fe2+时,应先向待检溶液中滴加KSCN溶液,若溶液颜色无变化,再滴加几滴新制氯水,若此时溶液变为红色,才可说明待测溶液中含有Fe2+,A项错误;B项,结论错误,应为Ksp(AgI)查看更多
相关文章
- 当前文档收益归属上传用户