- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省实验中学2019-2020学年高一下学期期中考试化学试题
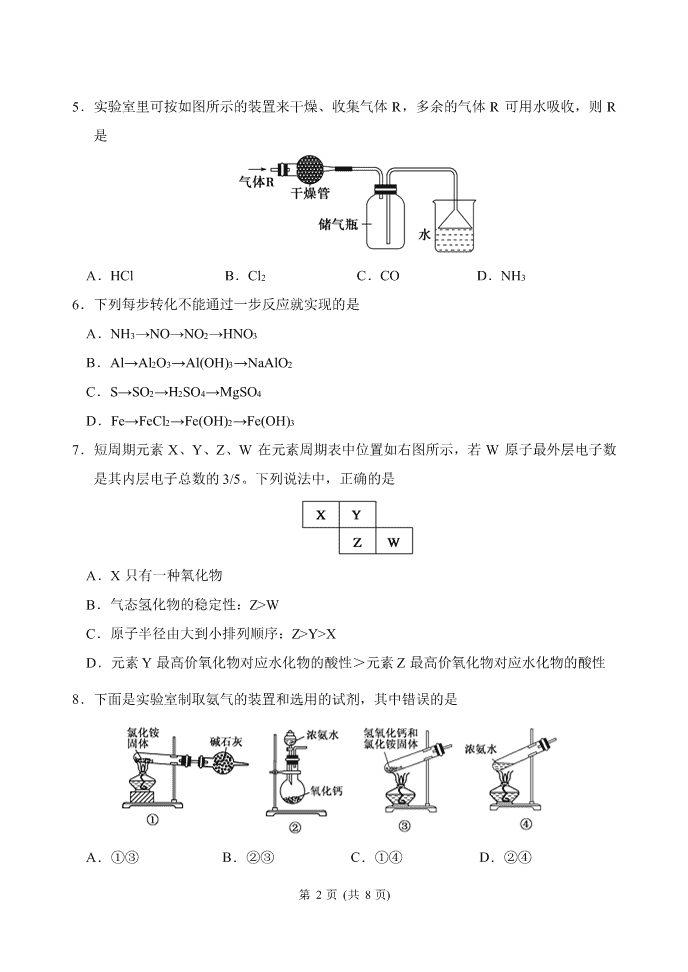
第 1 页 (共 8 页) 可能用到的相对原子质量: H—1 C—12 O—16 Na—23 S—32 Cu—64 Zn-65 Ag—108 第 I 卷(选择题,共 57 分) 一、选择题(本题包括 15 小题,每小题只有一个选项符合题意,每小题 2 分,共 30 分) 1.某元素的原子最外层只有一个电子,它与卤素结合时所形成的化学键为 A.一定是离子键 B.一定是共价键 C.可能是离子键也可能是共价键 D.以上说法都不正确 2. 下列各组物质中,化学键类型不同的是 A.NaCl 和 HNO3 B.H2O 和 NH3 C.CaF2 和 CsCl D.CCl4 和 HCl 3.以下反应属于吸热反应的是 A.锌与稀硫酸的反应 B.氯化铵与氢氧化钡晶体反应 C.煤的燃烧 D. 氢氧化钠与盐酸的反应 4.下列措施不符合节能减排的是 A.大力发展火力发电,解决城市电力紧张问题 B.在屋顶安装太阳能热水器为居民提供生活用热水 C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 吉林省实验中学 2019-2020 学年度下学期高一年级 期中考试化学试卷 出题人:张东明 审题人:李延龙 第 2 页 (共 8 页) 5.实验室里可按如图所示的装置来干燥、收集气体 R,多余的气体 R 可用水吸收,则 R 是 A.HCl B.Cl2 C.CO D.NH3 6.下列每步转化不能通过一步反应就实现的是 A.NH3→NO→NO2→HNO3 B.Al→Al2O3→Al(OH)3→NaAlO2 C.S→SO2→H2SO4→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3 7.短周期元素 X、Y、Z、W 在元素周期表中位置如右图所示,若 W 原子最外层电子数 是其内层电子总数的 3/5。下列说法中,正确的是 A.X 只有一种氧化物 B.气态氢化物的稳定性:Z>W C.原子半径由大到小排列顺序:Z>Y>X D.元素 Y 最高价氧化物对应水化物的酸性>元素 Z 最高价氧化物对应水化物的酸性 8.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 A.①③ B.②③ C.①④ D.②④ 第 3 页 (共 8 页) 9.下列结论正确的是 ① S2-、Cl、S、F 四种微粒半径逐渐减小 ② HF、HCl、HBr 水溶液酸性逐渐增强 ③ S2-、Cl-、Br-、I-四种离子的还原性逐渐减小 ④ Cl2、S、P 的氧化性逐渐减弱 ⑤ H2SO4、HClO4、H2CO3 的酸性逐渐减弱 A.②④ B.③⑤ C.①④ D.②③ 10.下列叙述不正确的是 A.NH3 易液化,液氨常用作制冷剂 B.与金属反应时,稀 HNO3 可能被还原为更低价态,则稀 HNO3 氧化性强于浓 HNO3 C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 D.稀 HNO3 和活泼金属反应时得不到氢气 11.下列关于原子序数为 87 的元素的说法正确的是 A.它位于第六周期第ⅡA 族 B.它位于第七周期第ⅡA 族 C.它位于第七周期第ⅠA 族 D.它的原子最外层有 3 个电子 12.下列描述的化学反应状态,不一定是平衡状态的是 A.H2(g)+Br2(g) 2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 B.2NO2 N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 C.CaCO3(s) CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的质量保持不变 D.3H2(g)+N2(g) 2NH3(g) 反应体系中 H2 与 N2 的物质的量之比保持 3∶1 13.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是 A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性) B.在加热条件下铜与浓硫酸反应(氧化性、酸性) C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) D.浓硫酸可用来干燥某些气体(难挥发性) 第 4 页 (共 8 页) 14.关于离子键、共价键的各种叙述中,下列说法中正确的是 A.在离子化合物里,只存在离子键,没有共价键 B.非极性键只存在于双原子的单质分子中 C.在共价化合物分子内,一定不存在离子键 D.由不同元素组成的多原子分子里,一定只存在极性键 15.下列物质的电子式正确的是 A. B. C. D. 二、选择题(本题包括 9 小题,每小题只有一个选项符合题意,每小题 3 分,共 27 分) 16.在一个容积为2L的密闭容器中,发生如下反应:3A + B 2C (A、B、C均为气体), 若最初加入的A、B都是4 mol,A的平均反应速率为0.12 mol/(L·s),则10s后容器中B的 物质的量是 A. 2.8 mol B. 1.6 mol C. 3.2 mol D. 3.6 mol 17.已知 1~18 号元素的离子 aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关 系正确的是 A.质子数:c > d B.离子的还原性:Y2-> Z- C.氢化物的稳定性:H2Y > HZ D.原子半径:X查看更多