- 2021-07-02 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点28物质的多样性学案
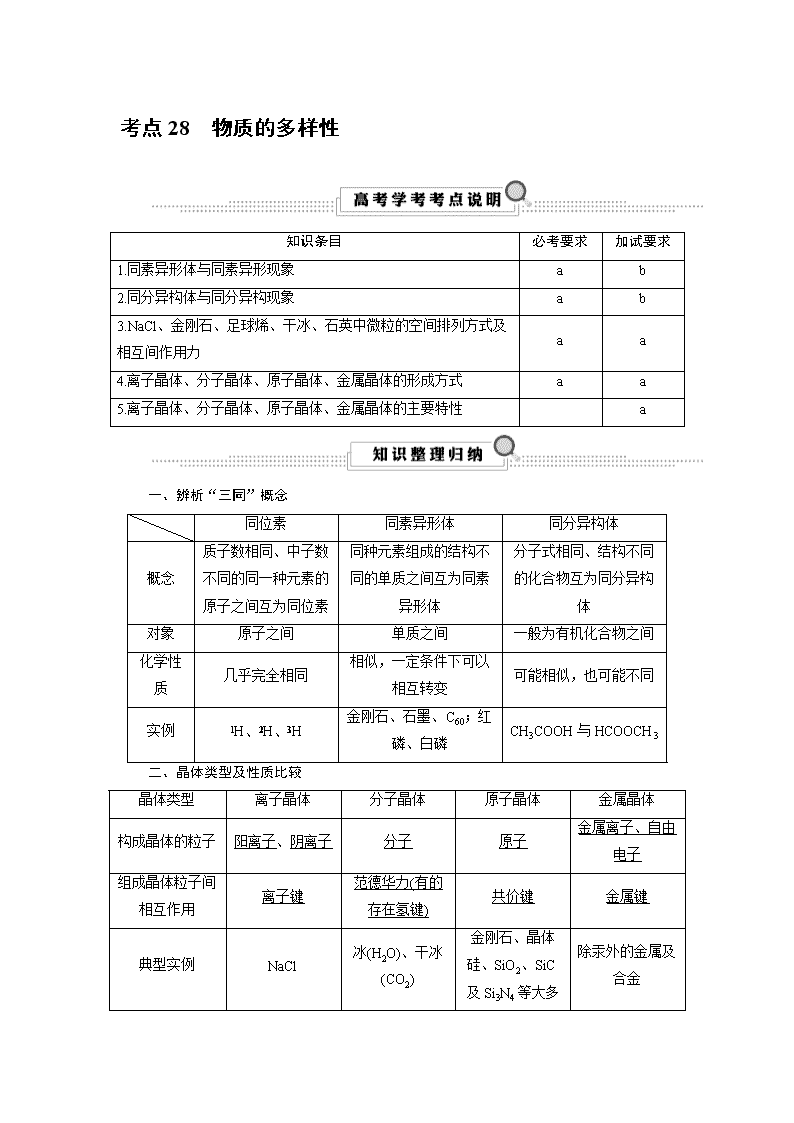
考点28 物质的多样性 知识条目 必考要求 加试要求 1.同素异形体与同素异形现象 a b 2.同分异构体与同分异构现象 a b 3.NaCl、金刚石、足球烯、干冰、石英中微粒的空间排列方式及相互间作用力 a a 4.离子晶体、分子晶体、原子晶体、金属晶体的形成方式 a a 5.离子晶体、分子晶体、原子晶体、金属晶体的主要特性 a 一、辨析“三同”概念 同位素 同素异形体 同分异构体 概念 质子数相同、中子数不同的同一种元素的原子之间互为同位素 同种元素组成的结构不同的单质之间互为同素异形体 分子式相同、结构不同的化合物互为同分异构体 对象 原子之间 单质之间 一般为有机化合物之间 化学性质 几乎完全相同 相似,一定条件下可以相互转变 可能相似,也可能不同 实例 H、H、H 金刚石、石墨、C60;红磷、白磷 CH3COOH与HCOOCH3 二、晶体类型及性质比较 晶体类型 离子晶体 分子晶体 原子晶体 金属晶体 构成晶体的粒子 阳离子、阴离子 分子 原子 金属离子、自由电子 组成晶体粒子间 相互作用 离子键 范德华力(有的存在氢键) 共价键 金属键 典型实例 NaCl 冰(H2O)、干冰(CO2) 金刚石、晶体硅、SiO2、SiC及Si3N4等大多 除汞外的金属及合金 数新型高温结构陶瓷 实例结构模型 — 晶体的物理性质 熔、沸点 熔点较高,沸点较高 熔、沸点低 熔、沸点高 易导电、易导热,大多数具有较好的延展性,密度、硬度、熔、沸点等差别较大 导热性 不良 不良 不良 导电性 固态不导电,熔化或溶于水能导电 固体、熔融不导电,部分化合物溶于水能导电 不导电(半导体) 机械加工性能 不良 不良 不良 硬度 略硬而脆 硬度低 高硬度 【例1】 下列各组中,互称为同素异形体的是( ) A.12C和14C B.水和冰 C.O2和O3 D.CO和CO2 【解析】 A项,12C和14C互为同位素;B项,水和冰为同一种物质;C项,O2和O3互为同素异形体;D项,CO和CO2是相同两种元素形成的不同化合物。故C项符合题意。 【答案】 C 【提炼】 “四同”判断的关键是抓住描述的对象: (1)同位素——原子,如H、H、H; (2)同素异形体——单质,如O2、O3; (3)同系物——有机化合物,如CH3CH3、CH3CH2CH3; (4)同分异构体——化合物,如正戊烷、新戊烷。 【例2】 下列变化需克服相同类型作用力的是( ) A.碘和干冰的升华 B.硅和C60的熔化 C.氯化氢和氯化钾的溶解 D.溴和汞的汽化 【解析】 碘和干冰升华克服的都是分子间作用力,A项正确;硅和C60 的熔化分别克服的是共价键、分子间作用力,B项错误;氯化氢和氯化钾的溶解分别克服的是共价键、离子键,C项错误;溴和汞的气化分别克服的是分子间作用力、金属键,D项错误。 【答案】 A 【提炼】 本题主要考查晶体的类型及晶体中微粒间的相互作用力。物质的三态变化,主要是微粒间的距离发生变化,所以破坏的是分子间作用力。 晶体类型及性质比较 晶体类型 离子晶体 分子晶体 原子晶体 构成晶体的粒子 阳离子、阴离子 分子 原子 组成晶体粒子间相互作用 离子键 分子间作用力 共价键 典型实例 NaCl 冰(H2O)、干冰(CO2) 金刚石、晶体硅、SiO2、SiC及Si3N4等 熔、沸点 熔、沸点较高 熔、沸点低 熔、沸点高 【例3】 关于晶体的叙述中,正确的是( ) A.原子晶体中,共价键的键能越大,熔、沸点越高 B.分子晶体中,分子间的作用力越大,该分子越稳定 C.分子晶体中,共价键的键能越大,熔、沸点越高 D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 【解析】 B项,分子的稳定性取决于分子内部的共价键强弱,与分子间作用力无关;C项,分子晶体熔、沸点高低,取决于分子间作用力的大小;D项,也可能是分子晶体,如HCl。 【答案】 A 【提炼】 原子晶体是由共价键所形成的空间网状结构,共价键的键能越大,熔、沸点越高;分子晶体中,分子间作用力对物质的熔沸点及密度会产生影响,分子间作用力越大,物质的熔沸点越高,而结构组成相似的分子晶体,其相对分子质量越大,分子间作用力越强。 【例4】 有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如下表: 序号 熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应 A 811 较大 易溶 水溶液或熔融导电 白色沉淀 B 3 500 很大 不溶 不导电 不反应 C -114.2 很小 易溶 液态不导电 白色沉淀 (1)晶体的化学式分别为:A________、B________、C________。 (2)晶体的类型分别是:A________、B________、C________。 (3)晶体中微粒间作用力分别是:A________、B________、C________。 【解析】 根据A、B、C所述晶体的性质可知,A为离子晶体,只能为NaCl,微粒间的作用力为离子键;B应为原子晶体,只能为金刚石,微粒间的作用力为共价键;C应为分子晶体,且易溶于水,只能为HCl,微粒间的作用力为分子间作用力。 【答案】 (1)NaCl C HCl (2)离子晶体 原子晶体 分子晶体 (3)离子键 共价键 分子间作用力 【提炼】 离子化合物在水溶液或熔融状态下均能导电如NaCl,而共价化合物只能在水溶液中导电,在液态时不导电,如HCl。HCl是电解质,在水溶液中能电离出Cl-,故与Ag+反应产生白色沉淀,而CCl4是非电解质,在水溶液中不能电离出Cl-,故与Ag+不反应。查看更多