- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2016-2017 学年度第二学期高一年级化学学科期中试卷
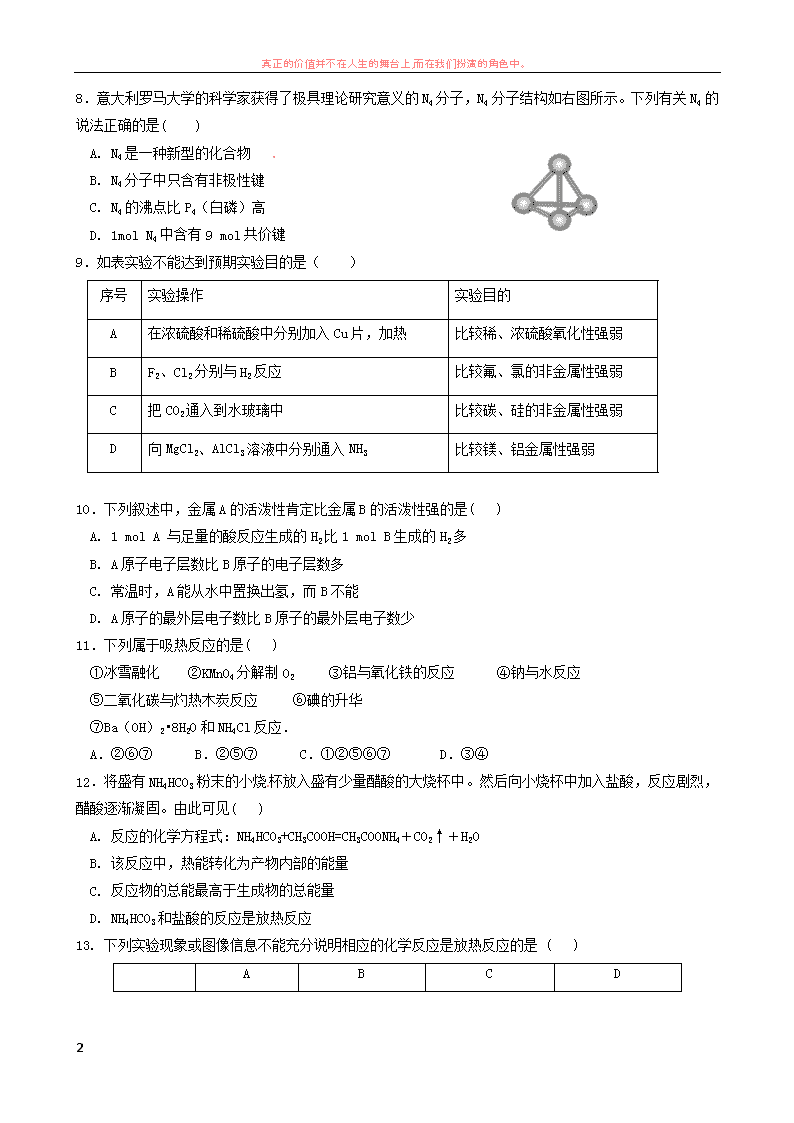
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 1 2016-2017 学年度第二学期高一年级化学学科期中试卷 (本试卷共 6 页,26 题,满分 100 分,时间 90 分钟) 第 I 卷 选择题 一、单选题(共 20 题,每题 2 分,共 40 分) 1.镭元素位于元素周期表第七周期ⅡA 族。下列关于镭的性质的说法不正确...的是( ) A. 单质的还原性比镁强 B. 单质与水反应放出氢气 C. 在化合物中呈+2 价 D. 氢氧化物呈两性 2.我国稀土资源丰富,下列有关稀土元素 Sm 与 Sm 的说法正确的是( ) A. 通过化学变化可实现 Sm 与 Sm 的相互转化 B. Sm 与 Sm 的核外电子排布方式相同 C. Sm 元素的近似相对原子质量为 150 D. Sm 与 Sm 核外电子数和中子数均为 62 3.aXn-和 bYm+ 为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( ) A. 原子半径 X<Y B. a+n=b-m C. Y 最高价氧化物的化学式为 YOm D. Xn-离子的半径大于 Ym+ 离子的半径 4.下列关于物质性质变化的比较,不正确的是( ) A. 稳定性:HI>HBr>HCl>HF B. 原子半径大小:Na>S>O C. 碱性强弱:KOH>NaOH>LiOH D. 还原性强弱:Cl﹣<Br﹣<I﹣ 5.元素 X、Y、Z 原子序数之和为 36,X、Y 在同一周期,X+与 Z2-具有相同的核外电子层结构.下列推测 正确的是 ( ) A. 同周期元素中 Z 的非金属性最强 B. 原子半径 X>Y,离子半径 X+>Z2- C. 同周期元素中 Y 的最高价含氧酸的酸性最强 D. 由 X、Y、Z 组成的化合物只有一种 6.下列物质中含有非极性共价键的离子化合物是( ) A.Cl2 B.Na2O2 C.H2O2 D.MgCl2 7.已知氮原子的质量数为 14,则在 NH3D+中,电子数、质子数、中子数之比为 A. 10∶7∶11 B. 11∶11∶8 C. 11∶10∶8 D. 10∶11∶8 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 2 8.意大利罗马大学的科学家获得了极具理论研究意义的 N4 分子,N4 分子结构如右图所示。下列有关 N4 的 说法正确的是( ) A. N4 是一种新型的化合物 B. N4 分子中只含有非极性键 C. N4 的沸点比 P4(白磷)高 D. 1mol N4 中含有 9 mol 共价键 9.如表实验不能达到预期实验目的是( ) 序号 实验操作 实验目的 A 在浓硫酸和稀硫酸中分别加入 Cu 片,加热 比较稀、浓硫酸氧化性强弱 B F2、Cl2 分别与 H2 反应 比较氟、氯的非金属性强弱 C 把 CO2 通入到水玻璃中 比较碳、硅的非金属性强弱 D 向 MgCl2、AlCl3 溶液中分别通入 NH3 比较镁、铝金属性强弱 10.下列叙述中,金属 A 的活泼性肯定比金属 B 的活泼性强的是( ) A. 1 mol A 与足量的酸反应生成的 H2 比 1 mol B 生成的 H2 多 B. A 原子电子层数比 B 原子的电子层数多 C. 常温时,A 能从水中置换出氢,而 B 不能 D. A 原子的最外层电子数比 B 原子的最外层电子数少 11.下列属于吸热反应的是( ) ①冰雪融化 ②KMnO4 分解制 O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O 和 NH4Cl 反应. A.②⑥⑦ B.②⑤⑦ C.①②⑤⑥⑦ D.③④ 12.将盛有 NH4HCO3 粉末的小烧 杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈, 醋酸逐渐凝固。由此可见( ) A. 反应的化学方程式:NH4HCO3+CH3COOH=CH3COONH4+CO2↑+H2O B. 该反应中,热能转化为产物内部的能量 C. 反应物的总能最高于生成物的总能量 D. NH4HCO3 和盐酸的反应是放热反应 13. 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 ( ) A B C D 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 3 反应 装置或 图像 实验现 象或图 像信息 温度计的 水银柱不 断上升 反应物总能 量大于生成 物总能量 反应开始后, 甲处液面低 于乙处液面 反应开始 后,针筒活 塞向右移动 14.在 2A(g) +B(g)=3C(g) +4D(g)反应中,表示该反应速率最快的是( ) A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1 C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1 15.在恒温容积为 2L 的密闭容器中进行反应 N2(g)+3H2(g) 2NH3(g),若氯气的物质的量由 0.4mol 降到 0.24mol 需 2s,那么由 0.24md 降到 0.04mol,需要的反应时间为 A. 等于 2.5s B. 等于 2.0s C. 大于 2.5s D. 小于 2.0s 16.对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是: 17.在一定条件下,对于在密闭容器中进行的反应 P(g)+Q(g) R(g)+S(g),下列说法中可以充分说 明这一反应已经达到平衡状态的是( ) A.P、Q、R、S 的浓度相等 B.P、Q、R、S 在容器中共存 C.P、Q 的反应速率相等 D.P、Q、R、S 的浓度不再变化 18.锌–空气燃料电池可作电动车动力电源,电解质 溶液为 KOH 溶液,放电时总离子方程式为 2Zn+O2+4OH–+2H2O===2Zn(OH)4 2-,放电时下列说法正确的是 A. 电解质溶液中 K+向负极移动 B. 电解质溶液中 C(OH-)逐渐增大 C. 负极电极反应:Zn+4OH–-2e–===Zn(OH)4 2- D. 转移 4mol 电子时消耗氧气 22.4L 19.有 A、B、C、D 四块金属片,进行如下实验:①A、B 用导线相连后,同时浸入稀 H2SO4 溶液中,A 极为 负极; ②C、D 用导线相连后,同时浸入稀 H2SO4 溶液中,电流由 D 导线 C ; ③ A、C 用导线相连后, 同时浸入稀 H2SO4 溶液中,C 极产生大量气泡; ④B、D 用导线相连后,同时浸入稀 H2SO4 溶液中,D 极发生 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 4 氧化反应。据此,判断四种金属的活动性顺序是 ( ) A.A > B > C > D B.A > C > D > B C.C > A > D > B D.C > B > D > A 20.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( ) A. 两烧杯中溶液的 pH 均增大 B. 甲中铜片是正极,乙中铜片是负极 C. 两烧杯中铜片表面均无气泡产生 D. 产生气泡的速度甲比乙慢 第 II 卷 填空题 二、填空题(共 6 题,共 60 分) 21.(8 分)A、B、C、D、E、F 为核电荷数依次增大且均小于 18 的同周期元素。已知 A、C、F 三原子的最 外电子层共有 11 个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。 D 元素原子的最外层电子数比次外层少 4 个,E 元素原子次外层电子数比最外层电子数多 3 个。试回答: (1)写出元素符号:D________,E________。 (2)用电子式表示 B 与 F 形成化合物的过程:___________________________________。 (3)A、C 两元素的最高价氧化物对应水化物相互反应的离子方程式为: ___________________________________。 22.(8 分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应 为生产和生活服务.回答有关问题: (1)从能量的角度看,断开化学键要__________,形成化学键要___________. (2)已知拆开 1 mol H-H 键、1 mol I-I、1 mol H-I 键分别需要吸收的能量为 436 kJ、151 kJ、 299 kJ。则由氢气和碘反应生成 1 mol HI 需要___________(填“放出”或“吸收”)________kJ 的热量。 23.(14 分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生 NH3。请回答下列问题: (1)Na3N 的电子式是_________________________,该化合物由________键形成。 (2)Na3N 与盐酸反应生成________种盐,其电子式分别是 _______________________________,______________________________。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 5 (3)Na3N 与水的反应属于________(填基本反应类型)反应。 (4)比较 Na3N 中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。 24.(8 分)某温度时,在 2 L 的密闭容器中,X、Y、Z 三种物质的量随时间的变化曲线如图所示。 (1)X 的转化率是 ( 2 ) 由 图 中 所 给 数 据 进 行 分 析 , 该 反 应 的 化 学 方 程 式 为 ; ( 3 ) 反 应 从 开 始 至 2 分 钟 末 , 用 Z 的 浓 度 变 化 表 示 的 平 均 反 应 速 率 为 v(Z)= , (4)当该反应达到平衡时。若三种物质都是气体,平衡时 Y 所占体积的百分比为______。 25.(8 分)分析下图,回答以下问题: (1)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点: ①____________________________________,②____________________________________。 (2)氢气作为理想的“绿色能源”有诸多优点,除了来源丰富,还有燃烧放热多,清洁无污染。氢氧燃 料电池是氢能源利用的一个重要方向,若电解质溶液为 KOH 溶液,写出正负极上的电极反应: 正极________________________________, 负极________________________________。 (3)如果改为甲醇(CH3OH)— O2 燃料电池,请写出在碱性条件下,负极反应上的电极反应: 负极________________________________。 26. (14 分)某研究性学习小组设计了一组实验验证元素周期律。 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性越强。他设计了右图所 示装置以验证氮、碳、硅元素的非金属性强弱。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 6 (1) 已 知 仪 器 A 中 放 一 种 块 状 固 体 , 打 开 分 液 漏 斗 的 活 塞 后 , A 中 可 观 察 到 的 现 象 是 _____________________;C 中可观察到的现象是_____________________________。 (2) 仪器 B 盛放的试剂是_______________,其作用是___________________________。 (3)分别写出 A、B、C 中发生反应的离子方程式______________________、___________________________、 __________________________。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 7 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 8查看更多