四川省乐山市2020届高三上学期第一次调查研究考试(12月)化学
乐山市高中2020届第一次调查研究考试
化学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共37题,共300分,共12页。考试时间150分钟。考试结束后,将本试题卷和答题卡一并交回。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号码填写清楚、考试科目涂写在答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,答在试题卷上无效。
3.本卷共21小题,每小题6分,共126分。
可能用到的相对原子质量:H 1 O 16 P 31 S 32 K 39 Fe 56 I 127 Ba 137
第I卷(选择题 共126分)
一、选择题(本题包括13小题,每小题6分,共78分。在每小题给出四个选项中,只有一项是符合题目要求的)
7.化学与社会、生活密切相关。下列现象或事实的解释不正确的是
选项
现象或事实
化学解释
A.
Fe3O4用于人民币票面文字等处的油墨
Fe3O4是一种红棕色物质
B.
祖国七十华诞焰火五彩缤纷
金属元素的焰色反应
C.
现代旧房拆除定向爆破用铝热剂
铝热反应放热使建筑物的钢筋熔化
D.
金属焊接前用NH4Cl溶液处理焊接处
NH4Cl溶液呈弱酸性
8.下列离子方程式或化学方程式正确的是
A.向Na2S2O3溶液中加入稀HNO3:S2O32-+2H+=SO2↑+S↓+H2O
B.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
C.“侯德榜制碱法”首先需制备碳酸氢钠:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
D.CuSO4溶液中加入过量NaHS溶液:Cu2++HS-=CuS↓+H+
9.已知气态烃A的产量是一个国家石油化工水平的重要标志,有机物A~E能发生如图所示一系列变化,则下列说法正确的是
·8·
A.A→B的反应类型为加成反应
B.常温下有机物C是一种有刺激性气味的气体
C.分子式为C4H8O2的酯有3种
D.l mol D与足量碳酸氢钠反应生成气体的体积为22.4L
10.短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法不正确的是
A.原子半径:M
Z
11.下列实验对应的实验现象和结论或解释都正确的是
选项
实验操作
实验现象
结论或解释
A.
KI淀粉溶液中通入少Cl2
溶液变蓝
Cl2能与淀粉发生显色反应
B.
向稀溴水中加入苯,充分振荡、静置
水层几乎无色
苯与溴水发生了取代反应
C.
向蔗糖溶液中加入几滴稀硫酸,水浴加热,然后加入银氨溶液,加热
无银镜出现
不能判断蔗糖是否水解
D.
向FeCl3和AlCl3混合溶液中滴加过量NaOH溶液
出现红褐色沉淀
Ksp[Fe(OH)3]c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
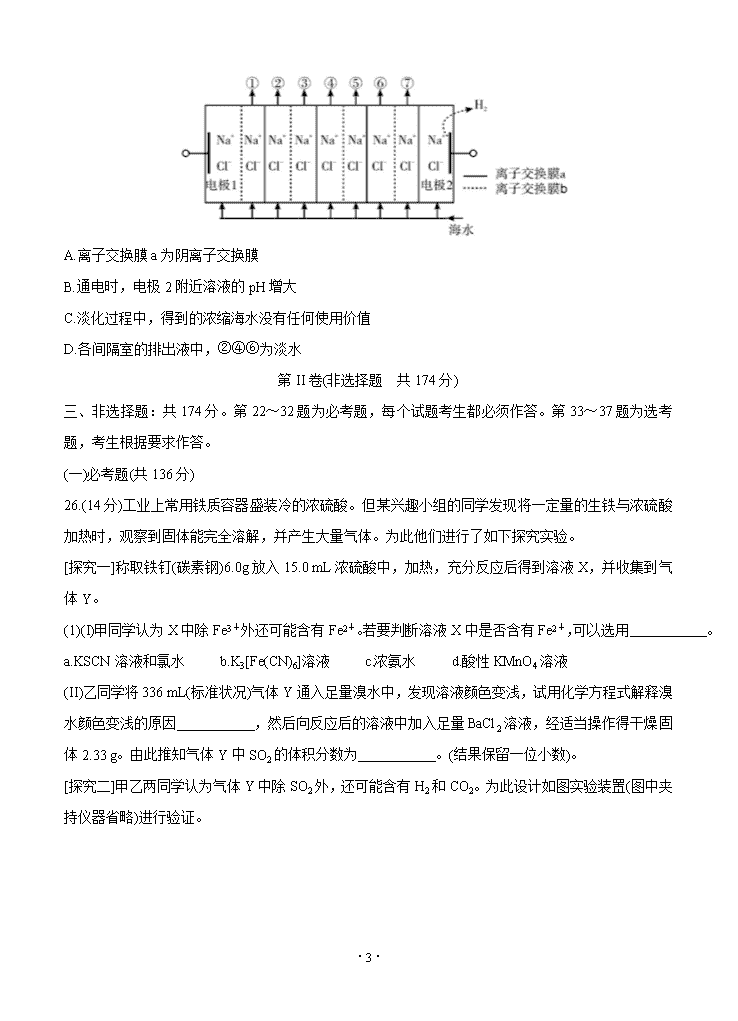
13.电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是
·8·
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
第II卷(非选择题 共174分)
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~37题为选考题,考生根据要求作答。
(一)必考题(共136分)
26.(14分)工业上常用铁质容器盛装冷的浓硫酸。但某兴趣小组的同学发现将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为此他们进行了如下探究实验。
[探究一]称取铁钉(碳素钢)6.0g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X,并收集到气体Y。
(1)(I)甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,可以选用 。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
(II)乙同学将336 mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因 ,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为 。(结果保留一位小数)。
[探究二]甲乙两同学认为气体Y中除SO2外,还可能含有H2和CO2。为此设计如图实验装置(图中夹持仪器省略)进行验证。
·8·
(2)简述该实验能产生少量H2的原因 (用化学用语结合少量文字表述)。
(3)装置B中试剂的作用是的 ,装置F的作用是 。
(4)为了进一步确认CO2的存在,需在上述装置中添加M于 (选填序号),M中所盛装的试剂可以是 。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
27.(14分)峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为 ,下列有关PH3的说法错误的是 。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式 。
(3)已知下列键能数据及P4(白磷)分子结构:
则反应4PH3(g)P4(g)+6H2(g) △H= kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)= ;下列说法能表明该反应达到平衡状态的是 。
·8·
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
(I)由图可知,富氧有利于 (选填“延长”或“缩短”)催化作用的持续时间。
(II)随着反应进行,PH3的净化效率急剧降低的原因可能为 。
28.(15分)粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
已知:
i)伯胺R-NH2能与Fe3+反应:3R一NH2+Fe3++SO42-+H2OFe(NH2一R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl一反应:Fe3++6Cl-[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是 。
(2)写出过程II加入过量H2O2发生的离子方程式 。加入伯胺-煤油对浸取液进行分离,该操作的名称是 。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理 。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-
·8·
,该反应中氧化剂与还原剂的物质的量之比为 。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-,
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为 ,纳米Fe2O3在电解过程中所起的作用是 。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为 。
(二)选考题:共38分。请考生从2道物理题,2道化学题中每科任选一题作答,如果多选,则每科按所做的第一题计分,1道生物题为必选。
35.(15分)据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为 ,原子核外有 个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是 。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是 ;H2O的VSEPR模型为 。
(II)Na2CO3中存在的作用力类型主要有 ,CO32-中C的杂化类型为 。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有 (任写一种),HCN分子中σ键和π键数目之比为 。
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏伽德罗常数为NA。则晶体中金原子的配位数为 ,金原子(或粒子)的半径r= pm(用含ρ和NA的代数式表示)。
36.(15分)2018年8月3日我国确诊首例非洲猪瘟疫情。目前某有效药物的主要成分——姜黄素(分子式为C12H20O6)的一种合成路线如图所示:
·8·
回答下列问题:
(1)A的名称为 ;试剂X为 。
(2)D中含有的官能团名称为 。
(3)反应D→E的化学方程式为 ,其反应类型是 。
(4)下列有关G(C8H8O3)的叙述不正确的是 (填正确答案编号)。
a.能与NaHCO3溶液反应 b.能与浓溴水发生取代反应
c.能与FeCl3溶液发生显色反应 d.l mol G最多能与3 mol H2发生加成反应
(5)姜黄素的结构简式为 。
(6)G(C8H8O3)的同分异构体中,写出同时符合下列条件的结构简式为 。
①苯环上的一取代物只有2种;
②核磁共振氢谱中有4组吸收峰;
③l mol该物质与烧碱溶液反应,最多消耗3 mol NaOH。
·8·
·8·