- 2021-05-14 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习第四辑考点五十七电化学定量计算含解析1
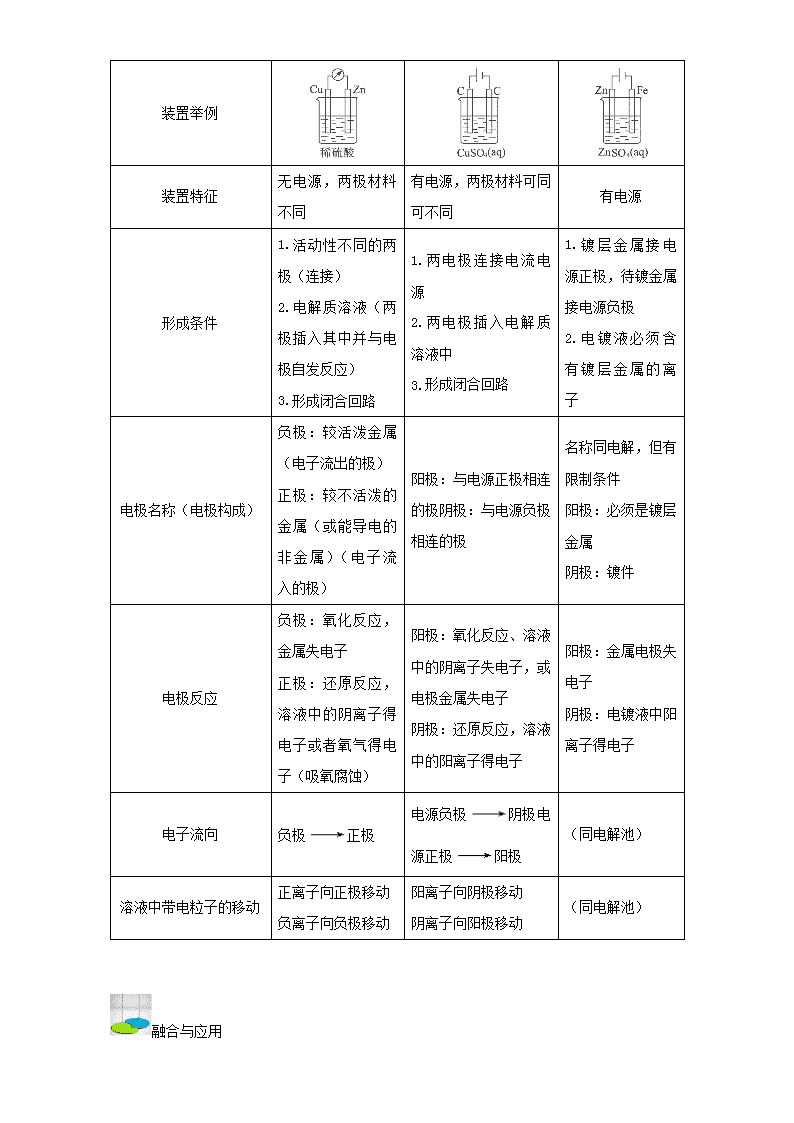
考点五十七 电化学定量计算 聚焦与凝萃 1.掌握利用守恒关系计算转移电子数及产物的用量计算; 2.掌握串联电路中计算方法。 解读与打通 常规考点 与电解有关的计算 (1)根据电子守恒法计算:用于串联电路、阴阳两极产物、相同电量等类型的计算,其依据是 电路中转移的电子数相等。 (2)根据总反应式计算:凡是总反应式中反映出的物质的量关系都可以列比例式计算。 (3)根据关系计算:由得失电子守恒定律关系建立已知量与未知量之间的桥梁,建立计算所需 的关系式, 如以通过 4 mol e-为桥梁可构建如下关系式: (式中 M 为金属,n 为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值, 熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。 (4)在电化学计算中,还常利用 Q=I·t 和 Q=n(e-)×NA×1.60×10-19C 来计算电路中通过的 电量。 隐性考点 原电池、电解池、电镀池的比较: 类别 性质 原电池 电解池 电镀池 定义(装置特点) 将化学能转变成电 能的装置 将电能转变成化学能 的装置 应 用 电 解 原 理 在 某 些 金 属 表 面 镀 上 一 层 其 他 金 属 的装置 反应特征 自发反应 非自发反应 非自发反应 装置举例 装置特征 无电源,两极材料 不同 有电源,两极材料可同 可不同 有电源 形成条件 1.活动性不同的两 极(连接) 2.电解质溶液(两 极插入其中并与电 极自发反应) 3.形成闭合回路 1.两电极连接电流电 源 2.两电极插入电解质 溶液中 3.形成闭合回路 1. 镀 层 金 属 接 电 源正极,待镀金属 接电源负极 2. 电 镀 液 必 须 含 有 镀 层 金 属 的 离 子 电极名称(电极构成) 负极:较活泼金属 (电子流出的极) 正极:较不活泼的 金属(或能导电的 非金属)(电子流入 的极) 阳极:与电源正极相连 的极阴极:与电源负极 相连的极 名称同电解,但有 限制条件 阳极:必须是镀层 金属 阴极:镀件 电极反应 负极:氧化反应, 金属失电子 正极:还原反应, 溶液中的阴离子得 电子或者氧气得电 子(吸氧腐蚀) 阳极:氧化反应、溶液 中的阴离子失电子,或 电极金属失电子 阴极:还原反应,溶液 中的阳离子得电子 阳极:金属电极失 电子 阴极:电镀液中阳 离子得电子 电子流向 负极 正极 电源负极 阴极电 源正极 阳极 (同电解池) 溶液中带电粒子的移动 正离子向正极移动 负离子向负极移动 阳离子向阴极移动 阴离子向阳极移动 (同电解池) 融合与应用 例 1.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电 一段时间后,析出钾、镁、铝的物质的量之比为 ( ) A.6∶3∶2 B.6∶3∶1 C.1∶2∶3 D.3∶2∶1 解析:串联电路通过各电解池的电子总数相等。 答案:A 例 2.在 0 ℃和 1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生 6.4 g 铜时,阳极放 出 ( ) A.1.12 L 氢气 B.1.12 L 氧气 C.2.24 L 氢气 D.2.24 L 氧气 解析:电解池中,阳极失去的电子数等于阴极得到的电子数。 答案:B 例 3.用 Pt 做电极,电解含 c(Cu2+)∶c(Na+)∶c(Cl-)=1∶2∶4 的混合溶液,在任何情况 下,阴、阳两极下不可能...同时发生的反应是 ( ) A.阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ B.阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ C.阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ D.阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ 答案:C 扫描与矫正 【正误判断】(正确的打“√”,错误的打“×”)(每个判断 2 分,共 40 分) ( )1.用石墨作电极电解氯化钠稀溶液,阴、阳两极收集到的气体物质的量之比一定为 1∶ 1 ( )2.用石墨作电极电解足量氯化钠溶液一段时间后,加入盐酸就能使溶液复原 ( )3.根据得失电子守恒可知电解精炼铜时,阳极减少的质量和阴极增加的质量相等 ( )4.电解精炼铜时,若阳极质量减少 6.4 g,则电路中转移电子数为 0.2NA ( )5.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电 一段时间后,析出钾、镁、铝的物质的量之比为 6∶3∶2 ( )6.用惰性电极电解 M(NO3)x 的水溶液,当阴极上增重 a g 时,在阳极上同时产生 b L(标 准状况)氧气,从而可知 M 的相对原子质量是5.6 ax b ( )7.在 0℃和 1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生 6.4 g 铜时,阳极放出 1.12 L 氧气 ( )8.用石墨作电极电解 CuSO4 溶液。通电一段时间后,欲使电解液恢复到起始状态,应 向溶液中加入适量的 CuO (2011·大纲全国卷,10 C) ( )9.某种氢氧燃料电池的电解液为 KOH 溶液,用该电池电解 CuCl2 溶液,产生 2.24 L Cl2(标 准状况)时,有 0.1 mol 电子转移 ( )10.用惰性电极电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为 1∶2 ( )11.用惰性电极电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为 1∶1 ( )12.在铁片上镀铜时,若铁片增重 3.2g,则电路中通过的电子的物质的量为 0.5mol ( )13.用石墨作电极电解氯化钠稀溶液,阴、阳两极收集到的气体物质的量之比一定为 1∶ 1 ( )14.用石墨作电极电解足量氯化钠溶液一段时间后,加入盐酸就能使溶液复原 ( )15.电解精炼铜时,若阴极得到 2 mol 电子,则阳极质量减少 64 g ( )16.需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀 ( )17.某溶液中含有两种溶质 NaCl 和 H2SO4,它们的物质的量之比为 3︰1,用石墨电极电 解该混合液。溶液 pH 不断增大,最后为 7 ( )18.在 100mlH2SO4 与 CuSO4 的混合液中,用石墨作电极电解一段时间,两极上均收集到 2.24L 气体(标准状况),则原溶液中 Cu2+物质的量浓度为 1molL-1 ( )19.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1mol 碱式碳酸铜 Cu2(OH)2CO3]后恰好恢复到电解前的浓度和 pH(不考虑 CO2 的溶 解)。则电解过程中共转移电子的物质的量是 0.6 mol ( )20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定 的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 充电 放电 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,放电时每转移 3 mol 电子,则正极有 1mol K2FeO4 被氧化 实训与超越 【7+1 模式】 一、单选(7×6 分=42 分) 1.两个惰性电极插入 500 mL AgNO3 溶液中,通电电解。当电解液的 pH 从 6.0 变为 3.0 时(设 电解过程中阴极没有 H2 放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的 质量最大为 ( ) A.27 mg B.54 mg C.106 mg D.216 mg 2.将两个铂电极插入 500 mL CuSO4 溶液中进行电解,通电一定时间后,某一电极增重 0.064 g(设 电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为 ( ) A.4×10-3 mol·L-1 B.2×10-3 mol·L-1 C.1×10-3 mol·L-1 D.1×10-7 mol·L -1 3.500 mL KNO3 和 Cu(NO3)2 的混合溶液中 c(NO- 3 )=0.6 mol·L-1,用石墨作电极电解此溶液,当 通电一段时间后,两极均收集到 2.24 L 气体(标准状况下),假定电解后溶液体积仍为 500 mL, 下列说法正确的是 ( ) A.原混合溶液中 c(K+)为 0.2 mol·L-1 B.上述电解过程中共转移 0.2 mol 电子 C.电解得到的 Cu 的物质的量为 0.05 mol D.电解后溶液中 c(H+)为 0.2 mol·L-1 4.用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集 B 和 C 逸出的气体。1 min 后测得 B 口的气体体积为 C 口处的一半,下列说法不正确的是 ( ) A.电源左侧为正极 B.电解槽左侧的电极反应方程式为 2H2O-4e-=O2+4H+ C.D 口导出的溶液为 KOH 溶液,且浓度比刚加入电解槽右侧时的浓度大 D.在标准状况下,若 1 min 后从 C 口处收集到的气体比 B 口处收集到的气体多 2.24 L,则 有 0.1NA 个 SO 2- 4 通过阴离子膜 5.用惰性电极电解 100 mL 4 mol·L-1 的 CuSO4 溶液,一定时间后在阳极收集到 1.12 L 气体,向 电解后的溶液中加入足量的铁粉,充分作用后溶液中的 Fe2+浓度为(设溶液的体积不变,反应前 后均为标准状况)( ) A.2.7 mol·L-1 B.3 mol·L-1 C.4 mol·L-1 D.1 mol·L-1 6.【2013·天津,6】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以 Al 作阳极、Pb 作阴极, 电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+ 2H2SO4(aq)=2PbSO4(s)+ 2H2O(l) 电解池:2Al+3H2O===== 电解 Al2O3+3H2↑ 电解过程中,以下判 断正确的是 ( ) 电池 电解池 A H+移向 Pb 电极 H+移向 Pb 电极 B 每消耗 3 mol Pb 生成 2 mol Al2O3 C 正极:PbO2+4H++2e-=Pb2++2H2O 阳极:2Al+3H2O-6e-=Al2O3+6H+ D 7.用酸性氢氧燃料电池电解苦卤水(含 Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b 为石墨电 极)。下列说法中,正确的是 ( ) A.电池工作时,正极反应式为:O2+2H2O+4e-=4OH- B.电解时,a 电极周围首先放电的是 Br-而不是 Cl-,说明当其他条件相同时前者的还原性 强于后者 C.电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极 D.忽略能量损耗,当电池中消耗 0.02 g H2 时,a 极周围会产生 0.71 g Cl2 二、填空(18 分) 8.如图表示一个电解池,装有电解液 a;X、Y 是两块电极板,通过导线与直流电源相连。请回 答以下问题: (1)若 X、Y 是惰性电极,a 是饱和 NaCl 溶液,实验开始时,同时在两边各滴入几滴酚酞, 则: ①电解池中 X 极上的电极反应式是 ,X 极附近观察到的现象 是 。 ②Y 电极上的电极反应式是 ,检验该电极反应产物的方法 是 。 (2)若用电解方法精炼粗铜,电解液 a 选用 CuSO4 溶液,则: ①X 电极的材料是 ,电极反应式是 。 ②Y 电极的材料是 ,电极反应式是 (说明:杂质发生的电极反应 不必写出)。 ③当电路中有 0.04 mol 电子通过时,阴极增重 g。 考点五十七 电化学定量计算 【正误判断】 题号 正误 解析 1 × 电解氯化钠稀溶液开始 2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH,后来 2H2O=====电解2H2↑+O2↑,故阴、阳两极收集到的气体物质的量之比不一定为 1∶1。 2 × 电解饱和食盐水时从溶液中析出的是氢气和氯气,且物质的量之比是 1∶1,故可 向溶液中通入氯化氢气体,但不能加盐酸,如果加入一定浓度的盐酸,可能使浓 度复原,但是溶液的体积不能“复原”。 3 × 电解精炼铜时,阴极析出的只有 Cu,而阳极减少的有活泼的 Zn、Fe、Ni 等形成 阳离子存在于溶液中,不活泼的 Ag、Au 等形成阳极泥沉在底部,故两极的质量 变化不相等。 4 × 错误电解精炼铜时,阳极除了铜被电解,Fe、Ni 等也被电解,所以转移电子数无 法判断 5 × 串联电路通过各电解池的电子总数相等 6 √ 7 √ 略 8 √ 依据 2CuSO4+2H2O 2Cu+O2↑+2H2SO4,欲使电解质溶液恢复到起始状态,应向 溶液中加入适量的 CuO。 9 √ 略 10 × 电解 Na2SO4 溶液时,在阳极发生反应:4OH--4e-→H2O+O2↑,在阴极发生反应: 4H++4e-→2H2↑,由于两电极通过的电量相等,故析出 H2 与 O2 的物质的量之比 为 2∶1,C 不正确; 11 √ 电解 CuCl2 溶液时,阴极反应为 Cu2++2e-→Cu,阳极反应为 2Cl--2e-→Cl2↑, 两极通过电量相等时,Cu 和 Cl2 的物质的量之比为 1∶1。 12 × 在铁片上镀铜时,若铁片增重 3.2g,则电路中通过的电子的物质的量为 0.1mol 13 × 电解氯化钠稀溶液开始 2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH,后来 2H2O=====电解2H2↑+O2↑,故阴、阳两极收集到的气体物质的量之比不一定为 1∶1。 【7+1 模式】 题号 答案 解 析 1 B 首先结合离子放电顺序,弄清楚两极的反应:阳极 4OH- -4e-=O2↑+2H2O;阴极 4Ag++4e-=4Ag,电解的总反应式 为 4AgNO3+2H2O=====电解4Ag+O2↑+4HNO3。由电解的总反应 式可知,电解过程中生成的 n(Ag)=n(HNO3)=n(H+)=(10 -3 mol·L-1-10-6 mol·L-1)×0.5 L≈5×10-4 mol,m(Ag) =5×10-4 mol×108 g·mol-1=0.054 g=54 mg。 2 A 根据 2CuSO4+2H2O=====电解2Cu+2H2SO4+O2↑,得:n(H+)= 2n(H2SO4)=2n(Cu)=2× 0.064 g 64 g·mol-1=0.002 mol,c(H+) 14 × 电解饱和食盐水时从溶液中析出的是氢气和氯气,且物质的量之比是 1∶1,故可 向溶液中通入氯化氢气体,但不能加盐酸,如果加入一定浓度的盐酸,可能使浓 度复原,但是溶液的体积不能“复原”。 15 × 精炼铜时,阳极失电子的有 Zn、Fe、Cu 等,当转移 2 mol 电子时,阳极消耗的 质量不一定为 64 g。 16 × 电离和电化学腐蚀不需要通电就可进行。 17 × 电解质溶液中 n(Na+):n(Cl-):n(H+):n(SO4 2-)=3:3:2:1,电解过程明显分为三个阶 段: 第一阶段相当于电解盐酸:2HCl=====电解Cl2↑+H2↑ 第二阶段相当于电解氯化钠溶液:2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH 第三阶段相当于电解水:2H2O=====电解2H2↑+O2↑,可见不正确。 18 √ 阳极电极反应式为:4OH- - 4e- = 2H2O + O2↑ 阴极电极反应式为:(开始)Cu2+ + 2e- = Cu (最后)2H+ + 2e- = H2↑ 根据电子得失守恒: 21.0)(2 4.22 24.24 4.22 24.2 2 11 LCuc Lmol L Lmol L 12 1)( molLCuc 。 19 √ 加入 0.1 mol 碱式碳酸铜 Cu2(OH) 2CO3]恢复原状,可将 0.1 molCu2(OH) 2CO3]分 解成 0.2 mol CuO、0.1 mol H2O、0.1 mol CO2(因它可从溶液中跑掉,可忽略), 由此说明有 0.2 mol 硫酸铜电解完成后,又有 0.1 mol H2O 发生电解,故电子转 移的物质的量应为电解 CuSO4 和电解水电子转移的量之和:0.4 mol+0.2 mol=0.6 mol。 20 × K2FeO4 被还原。 =0.002 mol 0.5 L =4×10-3 mol·L-1。 3 A 石墨作电极电解 KNO3 和 Cu(NO3)2 的混合溶液,阳极反应式 为 4OH--4e-=2H2O+O2↑,阴极先后发生两个反应:Cu2+ +2e-=Cu,2H++2e-=H2↑。从收集到 O2 为 2.24 L 这个事 实可推知上述电解过程中共转移 0.4 mol 电子,而在生 成 2.24 L H2 的过程中转移 0.2 mol 电子,所以 Cu2+共得 到 0.4 mol-0.2 mol=0.2 mol 电子,电解前 Cu2+的物质 的量和电解得到的 Cu 的物质的量都为 0.1 mol。电解前 后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(NO- 3 ),c(K+) +c(H+)=c(NO- 3 ),不难算出:电解前 c(K+)=0.2 mol·L -1,电解后 c(H+)=0.4 mol·L-1。 4 D 5 C 惰性电极电解硫酸铜,生成物是氧气、硫酸和铜。加入铁 粉后发生氧化还原反应,生成硫酸亚铁,所以根据 S 原子 守恒可知,硫酸亚铁的物质的量浓度与原硫酸铜的物质的 量浓度应该是相等的,所以反应后溶液中 Fe2+浓度为 4 mol·L-1。 6 D 原电池中,Pb 为负极:Pb-2e-+SO2- 4 =PbSO4,PbO2 为正极: PbO2+2e-+SO2- 4 +4H+=PbSO4+2H2O,所以 H+向 PbO2 极移动。 电解池中,Pb 为阴极:2H++2e-=H2↑,Al 为阳极:3H2O +2Al-6e-=Al2O3+6H+,所以 H+向 Pb 电极移动,A 错。每 消耗 3 mol Pb 时转移 6 mol e-,每生成 2 mol Al2O3 时, 转移 12 mol e-,B 错。根据 A 项分析,可知电池的正极 反应式书写错误,C 错。原电池中随时间增长,Pb 变为 PbSO4,质量增加,电解池中 Pb 极产生 H2,Pb 电极质量不 变,D 正确。 7 B A 项忽视了在酸性环境中不可能生成 OH-;电解时阳极发 生失电子氧化反应,还原性强的离子优先失电子,a 极产 物应首先得到 Br2,其次才能得到 Cl2,故 B 项正确,而 D 项错误;电解时,电子不是通过溶液转移,而是通过溶液 中的离子放电(阴离子失电子或阳离子得电子)转移的,C 项错误。 8 (1)①2H++2e-=H2↑ 有气 泡产生,溶液变红色 ②2Cl--2e-=Cl2↑ 将湿润 的 KI淀粉试纸置于 c 口处, 试纸变蓝 (2) ①纯铜 Cu2++2e-=Cu ②粗铜 Cu-2e-=Cu2+ ③1.28查看更多