- 2021-05-14 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考理综化学模拟试题
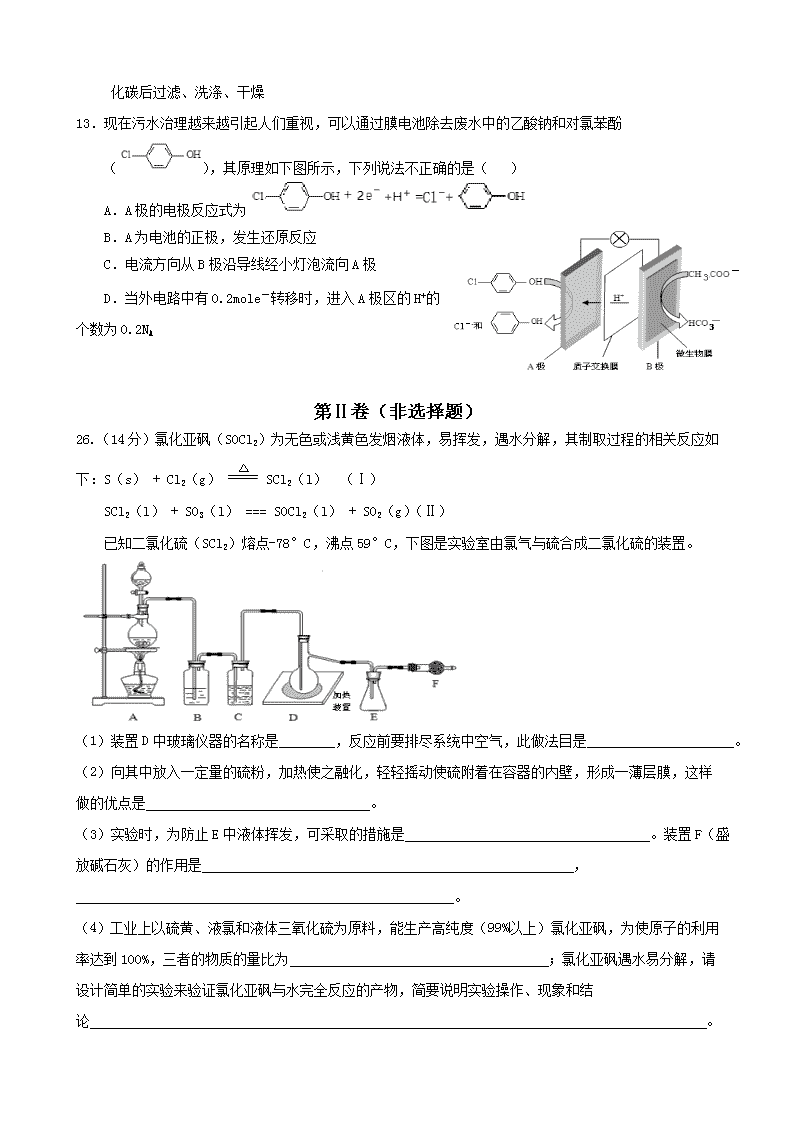
2016届高考理综化学模拟试题 相对原子质量(原子量):H 1 C 12 N 14 O16 Na 23 Al 27 Fe 56 一、选择题(本题共7小题。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.化学与生产、生活、社会密切相关,下列说法正确的是 ( ) A.绚丽缤纷的烟花中了含钾、钠、铁、铜等金属元素的化合物 B.“地沟油”禁止食用,但可以用来制皂 C.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 D.吸烟不会造成室内PM 2.5污染 8.能正确表示下列反应的离子方程式的是( ) A.石灰石溶于醋酸: CaCO3 + 2CH3COOH = 2CH3COO-+ Ca2+ + CO2↑+ H2O B.Na2CO3溶液显碱性:CO32-+H2O=HCO3-+OH- C.铁屑溶于过量稀硝酸:3Fe + 8H+ + 2NO3-=3Fe2+ + 2NO↑+ 4H2O D.FeI2溶液中通入少量氯气:2Fe2+ + Cl2= 2Fe3+ + 2Cl- 9.分子式为C5H10Cl2的有机物中,所含有的甲基数不可能为( ) A.1个 B. 2个 C.3个 D.4个 10.NA为阿伏加德罗常数的值,下列叙述正确的是( ) A.1.0 L 1.0 mol•L﹣1 的NaAlO2水溶液中含有的氧原子数为2NA B.标准状况下,11.2L 18O2中所含中子数为8NA C.常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1NA D.6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.7NA 11.下列说法正确的是析( ) A.常温下,向AgCl悬浊液中加入少量NaC1固体后振荡,c(Cl-)增大,Ksp(AgCl)增大 B.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4C1、③CH3COONH4、④NH3·H20, c(NH4+)由大到小的顺序是:①>②>③>④ C.某溶液中由水电离出的c( H+)=1 xl0-amol/L,若a>7时,则该溶液的pH一定为14-a D.常温下,pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则 反应后的混合液:c(R2-) +c(HR-)=c(Na+) 12.下列说法中正确的是( ) A.分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 B.用过量氨水除去Fe3+溶液中的少量Al3+ C.将Mg(OH)2放入表面皿中,加入足量盐酸,加热蒸干得无水MgCl2 D.Al(OH)3中混有Mg(OH)2,加入足量烧碱溶液,充分反应过滤,向滤液中通入足量二氧 化碳后过滤、洗涤、干燥 13.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(),其原理如下图所示,下列说法不正确的是( ) A.A极的电极反应式为 B.A为电池的正极,发生还原反应 C.电流方向从B极沿导线经小灯泡流向A极 D.当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA 第Ⅱ卷(非选择题) 26.(14分)氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:S(s) + Cl2(g) SCl2(l) (Ⅰ) SCl2(l) + SO3(l) === SOCl2(l) + SO2(g)(Ⅱ) 已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。 (1)装置D中玻璃仪器的名称是 ,反应前要排尽系统中空气,此做法目是 。 (2)向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 。 (3) 实验时,为防止E中液体挥发,可采取的措施是 。装置F(盛 放碱石灰)的作用是 , 。 (4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使原子的利用率达到100%,三者的物质的量比为 ;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论 。 已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O 供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液 27.(15分)某工业废水含有K+ Fe2+ Na+ NH Al3+ CO NO SO离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。 甲同学欲探究废水的组成,进行了如下实验: Ⅰ.取该溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。 Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。 Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。 Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。 请推断: (1)溶液中一定含有的离子是 。 (2)Ⅲ中加入盐酸生成无色气体的离子方程式是 (3)甲同学最终推测原溶液应该呈 性,原因是 (请用离子方程式说明)。 (4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为 。 充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。 28.(14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。 (1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。 写出CO与H2反应生成CH4和H2O的热化学方程式 已知: CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-Q1 kJ·mol-1 C(s)+2H2 (g)CH4(g) ΔH=-Q2 kJ·mol-1 2CO(g)C(s)+CO2(g) ΔH=-Q3 kJ·mol-1 (2) 天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空 气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 (3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g) 。 在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1______P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字) (4) 以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4 和CO2直接转化成乙酸。 ①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。 ②为了提高该反应中CH4的转化率,可以采取的措施是 。 38.【化学—选修5有机化学基础】(15分) 38.(15分)姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下: 已知: i.1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。 ii. iii.(R1、R2、R3为烃基或氢原子) 请回答: (1)B→C的反应类型是 。 (2)C→D反应的化学方程式是 。 (3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是 。 E→G反应的化学方程式是 。 (4)下列有关香兰醛的叙述不正确的是 。 a.香兰醛能与NaHCO3溶液反应 b.香兰醛能与浓溴水发生取代反应 c.1 mol香兰醛最多能与3 molH2发生加成反应 (5)写出一种符合下列条件的香兰醛的同分异构体的结构简式 。 ①苯环上的一硝基取代物有2种 ②1 mol该物质水解,最多消耗3 molNaOH (6)姜黄素的分子中有2个甲基,其结构简式是 。 (7)可采用电解氧化法由G生产有机物 J,则电解时的阳极反应式是 。 答案 BADCBDC 26. (14分)(1)蒸馏烧瓶、防止加热硫粉时硫与氧气反应 (2)增大反应物的接触面积(反应更充分) (3)将锥形瓶放入冷水(冰水)中冷却、 一是防止空气中水蒸气进入,二是吸收多余氯气 (4)2:3:1、 分别取少量试液于两支试管中,一支加入硝酸银溶液,若产生白色沉淀,说明含有HCl,另一支试管加入品红,若褪色,说明有SO2生成。 27.(15分)(1)Fe2+ Na+ NO3- SO42- (2)3 Fe2++4H++ NO3- =3Fe3++NO+2H2O (3)酸 Fe2++2H2O Fe(OH)2+2H+ (4)Fe2++ 2OH-= Fe(OH)2 4Fe(OH)2+O2+2H2O=4 Fe(OH)3 0.8 28.(14分,每空2分) (1)CO (g)+3H2(g) CH4(g)+ H2O(g) ΔH=-(Q2+Q3-Q1)kJ·mol-1 (2)2NH4HS+O2=2NH3·H2O+2S↓ (3)小于 大于 1.6mol2/L2 (4) ①温度超过250oC时,催化剂的催化效率降低 ②增大反应压强或增大二氧化碳浓度 38.(15分) (1)取代反应 (2)HOCH2-CH2OH + O2OHC-CHO + 2H2O (3)醛基、羧基(各1分) (4)ac(漏选得1分,错选不得分) (5) (6) (7)查看更多