近六年高考化学试题汇编化学平衡
近六年高考化学试题汇编
-----化学反应速率 化学平衡
(2000全国13)在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b
(2000全国16)已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
(2000广东20)同温同压下,当反应物分解了8%时,总体积也增加8%的是
A.2NH3(g) N2(g)+3H2(g)
B.2NO(g) N2(g)+O2(g)
C.2NO3(g) 4NO2(g)+O2(g)
D.2NO2(g) 2NO(g)+O2(g)
(2000上海19)对于反应2SO2+O2 2SO3,下列判断正确的是
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
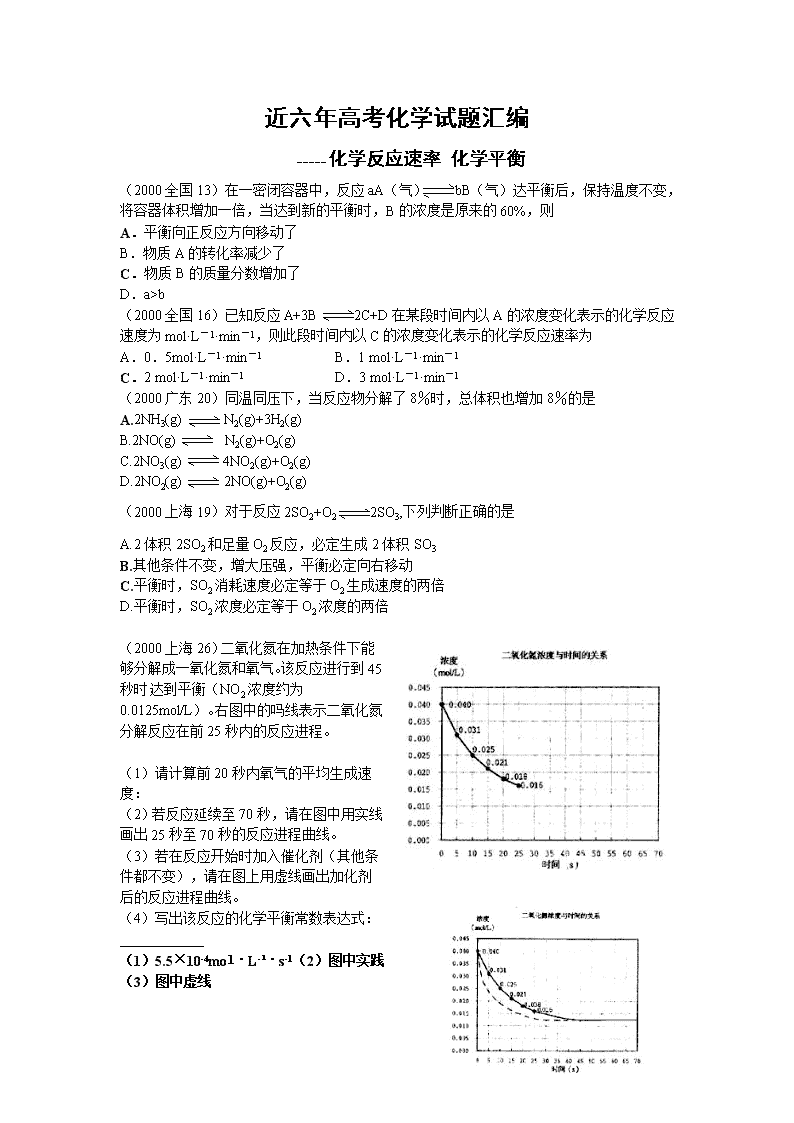
(2000上海26)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的吗线表示二氧化氮分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均生成速度:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:____________
(1)5.5×10-4mol·L-1·s-1(2)图中实践
(3)图中虚线
(4)k=
(2001天津16)将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(气)+B(气)=2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
(2001上海24)某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
(1)0.013 (2)1.0 催化剂 (3)> > (4)由吸热温度升高时,平衡向右移动
(2001上海27.利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
(1)3H2S+2Fe(OH)3→Fe2S3+6H2O (2)27n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
(5)
(2001广东13)反应:L(固)+aG(气)bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a<b
(2001江西9)压强变化不会使下列化学反应的平衡发生移动的是
A.H2(g)+ I2(g) 2 HI(g) B.3H2(g)+N2(g) 2NH3(g)
C.2SO2(g)+O2(g) 2SO3(g) D.C(s)+ CO2(g) 2CO(g)
(2001江西13)放热反应CO(g)+H2O(g) CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2 和K1的单位均为mol/L B.K2
c2(CO)
(2001江西14.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2 MN B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
(2002天津10)对已达化学平衡的下列反应 2X(g)+Y(g)2Z(g)
减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
(2002广东11)在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1mol X同时生成0.2mol Z
(2002广东15)1mol X气体跟a rnol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g) b Z(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=1,b=1 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
(2002广东20.(8分)将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)2H2+O2 2CO+O22CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为 n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。(用含a、b的代数式表示)
(1)H2O H2, CO CO2 (2)(2-2a-b) mol
(2002上海24)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(1) (2)吸热 (3)b、c (4)830
(2003春季12)反应:A(气)+3B(气)2C(气)+Q达平衡后,将气体混和物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
(2003江苏理综15)在0.lmol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应力向移动
C.滴加少量0.lmol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
(2003广东大综28)恒温恒压下,在容积可变的器血中,反应2NO2(气) N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.不变 B.增大 C.减小 D.无法判断
(2003全国11)某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
(2003江苏26)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
(1)(1-a) (2)3a (3)2 3-3a 丁
若3a>1,B的物质的量小于2mol;若,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
(2003上海11)可逆反应N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
(2003上海24)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l)NaCl(l)+K(g)一Q
该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见右表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高900℃时,该反应的平衡常数可表示为:K=
(1)770℃ 890℃ (2)降低压强或移去钾蒸气 适当升高温度
(3)K=c(K)/c(Na)
(2004北京 14)在一定温度下,一定体积的密闭容器中有如下平衡:
已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.2mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
(2004理综(新老)12)反应2SO2+O2 2SO2经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
A.0.1s B.2.5s C.5s D.10s
(2004理综(新老13)某温度下在密闭容器中发生如下反应:
2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为
A.20% B.40% C.60% D.80%
(2004全国1-29)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g) 2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16
解法二:N2 + 3H2 2NH3
开始时 a b 0
t时13 6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) = 716.8L -1 ×25% = 32mol×25% = 8mol
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(2004全国3-9)在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
(2004天津13)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
(2004广东5)在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g),达平衡是,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
A.不变 B.增大 C.减小 D.无法判断
(2004广东9)一定温度下,反应2SO2+O22SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
(2004广东18)右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
(2004江苏18)在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
(2004上海 8)将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A)B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( C)
(2004上海 24)在一定条件下,二氧化碳和氧气发生如下反应: 2SO2(g)+ O2 (g) 2SO3(g) (△H< 0)
(1)写出该反应的化学平衡常数表达式 K=_________________________________
(2)降低温度,该反应K值______________ ,二氧化碳转化率_________,化学反应速度____________________________________(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是___________________________ 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是���������������������_____________________________________________
(用文字表达)
10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(1) (2)增大 增大 减小
(3)15—20min和25—30min (4)增加了O2的最 a b
(05广东)17、对可逆反应4NH3(g) + 5O2 (g) 4NO(g) + 6H2O(g),下列叙述正确的是
A、达到化学平稳时,4υ正(O2)= 5υ逆(NO )
B、若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平稳状态
C、达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大
D、化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
0 x
y
(05广东)14、在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示温度时,Y表示NO2的物质的量
B、当X表示压强时,Y表示NO2的转化率
C、当X表示反应时间时,Y表示混合气体的密度
D、当X表示NO2的物质的量时,Y表示O2的物质的量
(05全国卷Ⅱ)11.已知反应A2(g)+2B2(g)2AB2(g)的△H<0,下列说法正确的
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
(05全国卷I)12.右图是温度和压强对X + Y 2Z 反应影响的示
意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
(05江苏)15.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A 达到化学平衡时,N2将完全转化为NH3
B 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D 达到化学平衡时,正反应和逆反应的速率都为零
(05江苏)18.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
(05北京)7.在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应
混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 (B)
(05天津)9.在密闭容器中,在一定条件下,进行下列反应:
NO(g) + CO(g) 1/2N2(g) + CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该
反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(05广东)7、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
323~353K
453~473K
Ni(s) + 4CO(g)
Ni(CO)4(g)
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
(05上海)25、在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) ⇌ 2HI(g) + Q (Q>0)
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变)
HI浓度的变化正确的是 (用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答)
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况
25、(本题共8分)
(1)K =
(2)0.167mol/L·min
(3)① 减小 c
② f
(4)见右图
(05广东)23、(9分)
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(己知气体的分压之比等于物质的量之比)。
温度/K
平
衡
体
系
的
分
压
/KPa
800
700
600
500
400
300
200
100
340
400
500
600
7000
800
900
1000
(1)420K时,发生反应的化学方程式为:____________________________;若反应中消耗l mol Xe,则转移电子______________mol。
(2)600~800K时,会发生反应:
XeF6(g)XeF4(g)+ F2(g),
其反应热△H _______0(填“>”“=”或“<”)。理由是____________________________________。
(3)900K时,容器中存在的组分有________________________________
23.(1) Xe + 3 F2 === Xe F6
6
(2) >
随着温度的升高,Xe F6(g) Xe F4 (g) + F2 (g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的ΔH>0。
(3) Xe F6 、Xe F4 、Xe F2 、Xe 、F2