三年高考20142016化学试题分项版解析——专题17 离子浓大小比较 Word版含解析
专题 17 离子浓度大小比较
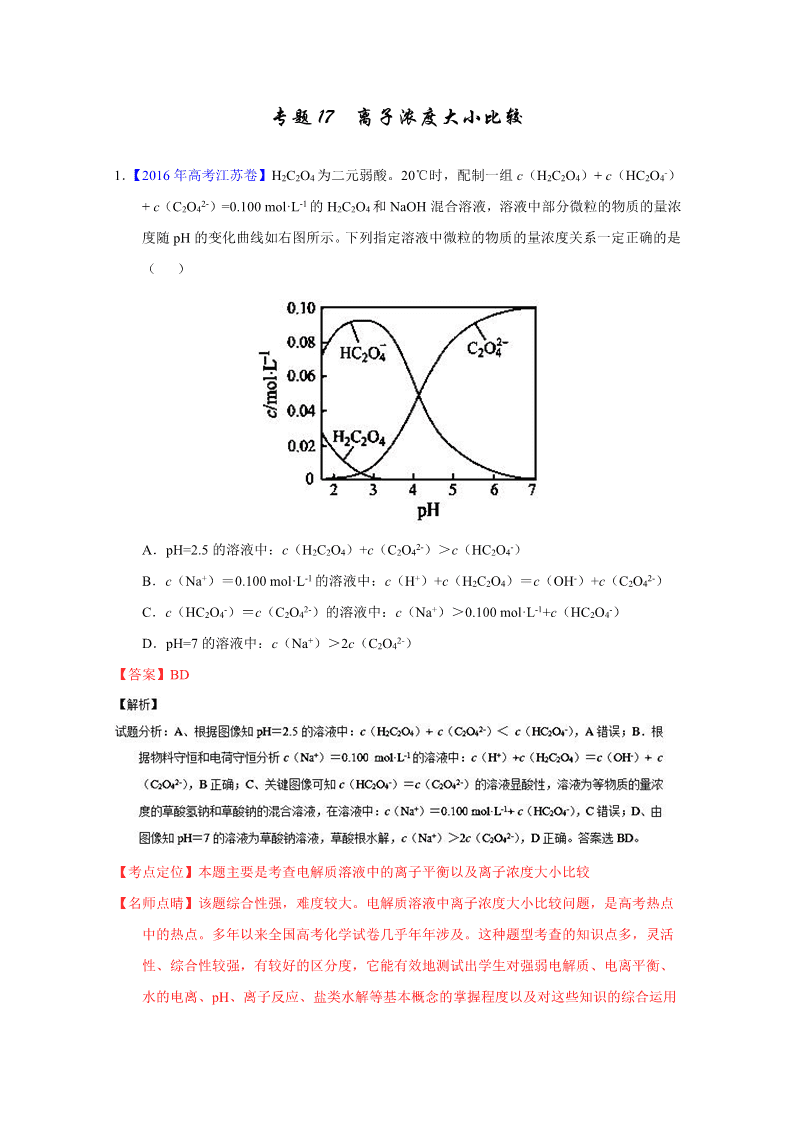
1.【2016 年高考江苏卷】H2C2O4 为二元弱酸。20℃时,配制一组 c(H2C2O4)+ c(HC2O4-)
+ c(C2O42-)=0.100 mol·L-1 的 H2C2O4 和 NaOH 混合溶液,溶液中部分微粒的物质的量浓
度随 pH 的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
( )
A.pH=2.5 的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.c(Na+)=0.100 mol·L-1 的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O4-)
D.pH=7 的溶液中:c(Na+)>2c(C2O42-)
【答案】BD
【考点定位】本题主要是考查电解质溶液中的离子平衡以及离子浓度大小比较
【名师点晴】该题综合性强,难度较大。电解质溶液中离子浓度大小比较问题,是高考热点
中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活
性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、
水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用
能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌
握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水
解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求
解。解题的关键是运用物料守恒、电荷守恒和质子守恒原理计算相关离子浓度大小。
2.【2016 年高考四川卷】向 1L 含 0.01molNaAlO2 和 0.02molNaOH 的溶液中缓慢通入二氧化
碳,随 n(CO2)增大,先后发生三个不同的反应,当 0.01mol
c(AlO2-)+c(OH-)
B 0.01 c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C 0.015 c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D 0.03 c(Na+)> c(HCO3-)> c(OH-)>c(H+)
【答案】D
【解析】
试题分析:向 1L 含 0.01molNaAlO2 和 0.02molNaOH 的溶液中缓慢通入二氧化碳,首先进行的
反应为氢氧化钠和二氧化碳反应生成碳酸钠和水,0.02mol 氢氧化钠消耗 0.01mol 二氧化
碳,生成 0.01mol 碳酸钠;然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01mol
偏铝酸钠消耗 0.005mol 二氧化碳,生成 0.005mol 碳酸钠;再通入二氧化碳,二氧化碳和
碳酸钠反应生成碳酸氢钠,消耗 0.015mol 二氧化碳,生成 0.03mol 碳酸氢钠。A、未通入
二 氧 化 碳 时 , 根 据 溶 液 中 的 电 荷 守 恒 有 c(Na+)+ c(H+)=c(AlO2-)+c(OH-) , c(Na+) <
c(AlO2-)+c(OH-),错误;B、当通入的二氧化碳为 0.01mol 时,则溶液为含有 0.01mol 碳酸
钠和 0.01mol 偏铝酸钠的混合液,因为碳酸酸性强于氢氧化铝,所以偏铝酸根离子水解程
度比碳酸根离子强,则偏铝酸根离子浓度小于碳酸根离子浓度,错误;C、当通入的二氧
化碳为 0.015mol 时溶液中含有 0.015mol 碳酸钠,离子浓度的关系为 c(Na+)> c(CO32-) >
c(OH-) c(HCO3-),故错误;D、当通入二氧化碳的量为 0.03mol 时,溶液为碳酸氢钠溶液,
溶液显碱性,离子浓度关系为 c(Na+)> c(HCO3-)> c(OH-)>c(H+),故正确。
【考点定位】考查电解质溶液中的离子平衡,钠、铝及其化合物的性质
【名师点睛】本题将元素化合物知识与电解质溶液中离子浓度大小比较综合在一起考查,熟
练掌握相关元素化合物知识,理清反应过程,结合相关物质的用量正确判断相关选项中
溶液的成分是解题的关键。电解质溶液中微粒浓度大小比较要抓住两个平衡:电离平衡
和盐类的水解平衡,抓两个微弱:弱电解质的电离和盐类的水解是微弱的,正确判断溶
液的酸碱性,进行比较。涉及等式关系要注意电荷守恒式、物料守恒式和质子守恒式的
灵活运用。
3.【2016 年高考天津卷】室温下,用相同浓度的 NaOH 溶液,分别滴定浓度均为 0.1mol·L-1
的三种酸(HA、HB 和 HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至 P 点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达 100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】C
【解析】
【考点定位】考查中和滴定图像、弱电解质的电离平衡、离子浓度大小比较
【名师点晴】本题考查了酸碱混合时的定性判断、弱电解质的电离平衡、离子浓度大小比较
等。在判断溶液中微粒浓度大小的比较时,要重点从三个守恒关系出发,分析思考。(1)
两个理论依据:①弱电解质电离理论:电离微粒的浓度大于电离生成微粒的浓度。例如,
H2CO3 溶液中:c(H2CO3)>c(HCO3
-)≫c(CO32-)(多元弱酸第一步电离程度远远大于第二步
电离)。②水解理论:水解离子的浓度大于水解生成微粒的浓度。例如,Na2CO3 溶液中:
c(CO32-)>c(HCO3
-)≫c(H2CO3)(多元弱酸根离子的水解以第一步为主)。(2)三个守恒关
系:①电荷守恒:电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓
度等于所有阴离子的电荷总浓度。例如,NaHCO3 溶液中:c(Na+)+c(H+)=c(HCO3
-)+
2c(CO32-)+c(OH-)。②物料守恒:物料守恒也就是原子守恒,变化前后某种元素的原子
个数守恒。例如,0.1 mol·L-1 NaHCO3 溶液中:c(Na+)=c(HCO3
-)+c(CO32-)+c(H2CO3)
=0.1 mol·L-1。③质子守恒:由水电离出的 c(H+)等于由水电离出的 c(OH-),在碱性盐溶
液中 OH-守恒,在酸性盐溶液中 H+守恒。例如,纯碱溶液中 c(OH-)=c(H+)+c(HCO3
-)
+2c(H2CO3)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。解答本题
时,能够从图像的起始点得出三种酸的相对强弱是解题的关键。
4.【2015 浙江理综化学】40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下
图所示。下列说法不正确...的是( )
A.在 pH=9.0 时,c(NH4
+)>c(HCO
ˉ
3)>c(NH2COOˉ)>c(CO32-)
B.不同 pH 的溶液中存在关系:c(NH4
+)+c(H+)=2c(CO32-)+c(HCO3
-)+c(NH2COOˉ)
+c(OHˉ)
C.随着 CO2 的通入, OHˉ
NH3·H2O不断增大
D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成
【答案】C
【解析】A、在 pH=9.0 时,作直线垂直于横坐标,从图上可直接看得出:c(NH4
+)>c(HCO
ˉ
3)
>c(NH2COOˉ)>c(CO32-),A 正确;B、根据电荷守恒可得:c(NH4
+)+c(H+)=2c(CO32
-)+c(HCO3
-)+c(NH2COOˉ)+c(OHˉ),B 正确;C、
OHˉ
NH3·H2O= ,Kb 不变,c(NH4
+)不断增大,则比值
不断减小,C 不正确;D、从图上看,pH 降低过程中,有含 NH2COOˉ的中间产物生成,
D 正确。答案选 C。
【考点定位】本题主要是考查电解质溶液中离子浓度大小关系,电荷守恒关系,图像分析应
用等。
【名师点晴】本题从知识上考查了电解质溶液。涉及弱电解质的电离和盐类的水解、离子浓
度的大小比较、外加各类物质对电离平衡、水解平衡的影响。在比较离子浓度的大小关
系时经常要用到物料守恒、电荷守恒、质子守恒这三大守恒关系。考察了学生对知识理
解、综合运用能力,对离子浓度大小的比较的方法积三大守恒的掌握情况。这道高考题
为一道中档题,创新性较强。
5.【2015 四川理综化学】常温下,将等体积,等物质的量浓度的 NH4HCO3 与 NaCl 溶液混合,
析出部分 NaHCO3 晶体,过滤,所得滤液 pH<7。下列关于滤液中的离子浓度关系不正确...
的是( )
A.Kw
H+ <1.0×10-7mol/L
B.c(Na+)= c(HCO3
-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3
-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3
-)> c(CO32-)
【答案】C
【考点定位】电解质溶液
【名师点睛】电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高
考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的
区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、
盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型
和规律的应用试题在高考中常有涉及。考查的重点内容有:1、弱电解质的电离平衡(主
要考查:电解质、非电解质的判断;某些物质的导电能力大小比较;外界条件对电离平
衡的影响及电离平衡的移动;将电离平衡理论用于解释某些化学问题;同浓度(或同 pH)
强、弱电解质溶液的比较等等。);2、水的电离程度影响的定性判断与定量计算;3、盐
溶液蒸干灼烧后产物的判断;4、溶液中离子浓度大小的比较等。
6.【2015 山东理综化学】室温下向 10mL0.1 mol·L-1NaOH 溶液中加入 0.1 mol·L-1 的一元酸
HA 溶液 pH 的变化曲线如图所示。下列说法正确的是( )
A.a 点所示溶液中 c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相同
C.pH=7 时,c(Na+)= c(A—)+ c(HA)
D.b 点所示溶液中 c(A—)> c(HA)
【答案】D
【考点定位】本题通过分析图像的分析、酸碱中和反应进行的程度,结合弱电解质的电离平
衡和盐类的水解规律,考查了离子浓度比较、水的电离程度的比较。
【名师点睛】本题难度较大,综合性较强,涉及到电解质水溶液中离子浓度的等量关系、大
小关系以及水的电离程度等知识和规律。解答本题时应正确分析图像,根据酸碱中和反
应,分析出溶液的溶质,根据酸碱性和弱电解质的电离平衡和盐类的水解规律,考查了
考生灵活运用所学知识解决实际问题的能力。
7.【2015 安徽理综化学】25℃时,在 10mL 浓度均为 0.1mol/LNaOH 和 NH3·H2O 混合溶液中,
滴加 0.1mol/L 的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入 10mL 盐酸时:c(NH4
+) +c(H+) = c(OH-)
C.加入盐酸至溶液 pH=7 时:c(Cl-) = c(Na+)
D.加入 20mL 盐酸时:c(Cl-) =c(NH4
+) +c(Na+)
【答案】B
【考点定位】本题重点考查溶液中水的电离和离子的水解,比较溶液中离子浓度的大小,物
料守恒,电荷守恒和质子守恒原理的应用。
【名师点睛】溶液中离子浓度大小比较,是全国高考的热点题型之一,重复率达 100%,因为这类
题目涉及的知
识点多,难度大,区分度高。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及
其电离,盐类的
水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学
计算,甚至还要
用到"守恒"来求解。解题的关键是运用物料守恒、电荷守恒和质子守恒原理计算相关离子
浓度大小。
8.【2015 江苏化学】室温下,向下列溶液中通入相应的气体至溶液 pH=7(通入气体对溶液体
积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向 0.10mol·L-1NH4HCO3 溶液中通入 CO2:c(NH4
+)=c(HCO3
-)+c(CO32-)
B.向 0.10mol·L-1NaHSO3 溶液中通入 NH3:c(Na+)>c(NH4
+)>c(SO32-)
C.0.10mol·L-1Na2SO3 溶液通入 SO2:c(Na+)=2[c(SO32-)+c(HSO3
-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa 溶液中通入 HCl:c(Na+)>c(CH3COOH)=c(Cl-)
【答案】D
【解析】A、两者不反应,根据溶液呈现电中性,c(NH4
+)+c(H+)=c(OH-)+c(HCO3
-)+2c(CO32
-),因为 pH=7,c(H+)=c(OH-),即 c(NH4
+)=c(HCO3
-)+2c(CO32-),故错误;B、HSO3
- H
++SO32-,NH3 和 H+反应,生成亚硫酸钠和亚硫酸铵,水解的程度是微弱的,c(Na+)>c(SO32
-)=c(NH4
+),故错误;C、Na2SO3+SO2+H2O=2NaHSO3,pH=7,反应后溶液的溶质 Na2SO3、
NaHSO3,根据物料守恒:2c(Na + )=3[c(SO32 - )+c(HSO3
-)+c(H2SO3)],故错误;D、
CH3COONa+HCl=CH3COOH+NaCl,溶液 pH=7,反应后的溶质:NaCl、CH3COOH、
CH3COONa,电离和水解相等,即:c(Na+)>c(CH3COOH)=c(Cl-),故正确。
【考点定位】考查离子浓度大小比较中电荷守恒、物料守恒等知识。
【名师点睛】涉及离子浓度大小比较,常用规律:电荷守恒、质子守恒、物料守恒、水解程
度和弱电解质电离程度微弱,然后分析反应后溶液中溶质有哪些物质,分析是电离为主
还是水解为主,这需要根据题目所给信息进行判断,此类题中等难度,要求学生学会分
析问题的能力。
9.【2014 年高考海南卷】室温下,用 0.l00mol/L NaOH 溶液分别滴定 20.00 mL 0.100 mol/L 的
盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
A.II 表示的是滴定醋酸的曲线
B.pH=7 时,滴定醋酸消耗的 V(NaOH)小于 20 mL
C.V(NaOH)= 20.00 mL 时,两份溶液中 c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL 时,醋酸溶液中 c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
【答案】B
【解析】A、相同浓度的盐酸和醋酸,由于盐酸是一元强酸,在水溶液中完全电离,醋酸是一
元弱酸,在水溶液中部分电离。所以溶液的 pH 醋酸的大,盐酸小。因此 I 表示的是醋酸,
II 表示的是盐酸。错误。B、NaOH 是强碱,HCl 是强酸,当 pH=7 时,二者恰好反应,
物质的量相等,所以 n(NaOH)=20ml。若与醋酸反应的 NaOH 的体积也是 20ml.则得到的
是醋酸钠。醋酸钠是强碱弱酸盐,水解是溶液显碱性,因此若要使 pH=7 时,则滴加的体
积就要少于 20ml。因此滴定消耗的 V(NaOH),酸小醋于 20 mL。正确。C、任何溶液都符
合电荷守恒。、质子守恒、物料守恒。在醋酸溶液中加入 20mlNaOH 溶液时,醋酸根离子
会发生水解反应,所以除了存在醋酸分子外,还存在醋酸根离子。根据物料守恒,可得
c(Cl-)=c(Na+)= C(CH3COO-)+ C(CH3COOH)。错误。D、V(NaOH) =10.00 mL 时,得到是
醋酸和醋酸钠等浓度的混合溶液。由于在等浓度、等体积的醋酸与醋酸钠的混合溶液中,
醋酸分子的电离作用大于醋酸钠盐的水解作用,所以根据物料守恒和电荷守恒可得:溶
液中 C(CH3COO-)>c(Na+)> c(H+)> c(OH-)。错误。
【考点定位】本题以常见的酸:盐酸、醋酸与常用的强碱溶液混合时溶液中微粒的浓度变化
来通过图像的展示来考查三大守恒、盐的水解作用。考查了学生的知识掌握、综合分析、
灵活应用能力,综合性很强。
【名师点睛】本题考查图像法在酸碱中和滴定中的应用;考查了盐的水解、酸的电离、比较
溶液中微粒浓度的大小的三个守恒知识。解答本题,首先应该掌握物质酸的相对强弱,
了解在浓度相同时电离产生的离子浓度的大小。然后看其与与碱混合发生反应时,酸碱
相对物质的量的多少、溶液中的溶质的种类、电解质的电离程度与产生的盐的水解程度
的相对大小。最后对选项中的问题根据题意进行解答。
10.【2014 年高考安徽卷第 11 题】室温下,下列溶液中粒子浓度大小关系正确的是( )
A.Na2S 溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4 溶液中:c(OH-)=c(H+)+c(HC2O4
-)+2c(H2C2O4)
C.Na2CO3 溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa 和 CaCl2 混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
【答案】B
【考点定位】本题主要是考查电解质溶液,涉及盐类水解,三大守恒关系的应用
【名师点晴】本题是高考中的热点题型和高频点,侧重对学生灵活应用基础知识解决实际问
题的能力培养。意在考查学生分析问题、解决问题的能力,属于中等难度试题的考查,
答题的关键是灵活应用电荷守恒、物料守恒以及质子守恒,题目难度中等。
11.【2014 年高考江苏卷第 14 题】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的
是( )
A.0.1mol/LCH3COONa 与 0.1mol/LHCl 溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)
>c(OH-)
B.0.1mol/LNH4Cl 与 0.1mol/L 氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4
+)>c(Cl-)
>c(OH-)
C.0.1mol/LNa2CO3 与 0.1mol/L NaHCO3 溶液等体积混合:2
3c(Na+)=c(CO32-)+c(HCO3
-)
+c(H2CO3)
D.0.1mol/LNa2C2O4 与 0.1mol/LHCl 溶液等体积混合(H2C2O4 为二元弱酸):
2c(C2O42-)+c(HC2O4
-)+c(OH-)=c(Na+)+c(H+)
【答案】AC
【解析】A、0.1mol/LCH3COONa 与 0.1mol/LHCl 溶液等体积恰好反应混合生成醋酸和氯化钠,
醋酸电离溶液显酸性,则 c(Na+)=c(Cl-)>cCH3COO-)>c(OH-),正确;B、0.1mol/LNH4Cl
与 0.1mol/L 氨水等体积混合(pH>7),这说明溶液显碱性,因此氨水的电离程度大于铵
根的水解程度,则 c(NH4
+)>c(Cl-)>c(NH3·H2O)>c(OH-),不正确;C、0.1mol/LNa2CO3
与 0.1mol/L NaHCO3 溶液等体积混合,则根据物料守恒可知 2
3c(Na+)=c(CO32-)+c(HCO3
-)+c(H2CO3),正确;D、0.1mol/LNa2C2O4 与 0.1mol/LHCl 溶液等体积混合(H2C2O4 为二
元弱酸),二者恰好反应生成草酸酸氢钠和氯化钠,则根据电荷守恒可知溶液中 2c(C2O42
-)+c(HC2O4
-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),不正确。
【考点定位】本题主要是考查溶液中离子浓度的关系判断
【名师点晴】本题以微粒浓度大小的比较、微粒浓度的等式关系判断为载体。考察学生对溶
液中各种平衡的理解和对电荷守恒、物料守恒、质子守恒等等式的应用,考察学生的理
论应用能力。本题的解题要点为溶液中微粒浓度的关系,首先要明确溶液的溶质,存在
哪些微粒,存在哪些平衡,多平衡存在时以哪个平衡为主等,然后明确溶液中的电荷守
恒、物料守恒、质子守恒等三个等式。关键是判断溶液中的平衡。
12.【2014 年高考四川卷第 6 题】下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LNaHCO3 溶液与 0.1mol/LNaOH 溶液等体积混合,所得溶液中:
c(Na+)>c(CO32-)>c(HCO3
-)>c(OH-)
B.20ml0.1mol/LCH3COONa 溶液与 10ml0.1mol/LHCl 溶液混合后呈酸性,所得溶液中:
c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2 的盐酸与 pH=12 的氨水等体积混合,所得溶液中:
c(Cl-)>c(H+)>c(NH4
+)>c(OH-)
D.0.1mol/LCH3COOH 溶液与 0.1mol/LNaOH 溶液等体积混合,所得溶液中:
c(OH-)>c(H+)+c(CH3COOH)
【答案】B
【考点地位】本题主要是考查水溶液中的离子平衡以及溶液中离子浓度大小比较
【名师点晴】本题属于溶液中离子平衡方面的考查,侧重于弱电解质的电离及盐类水解,题
目难度较大。该类试题重点考查了学生对知识理解、综合运用能力,对离子浓度大小的
比较的方法及三大守恒的掌握情况。意在考查学生分析、归纳、总结问题的能力。选项 C
是易错点,注意反应后酸碱过量问题的判断。
13.【2014 年高考天津卷第 5 题】下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO42-)十 c(OH-)
B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2 的水溶液:c(H+)>c (HCO3-)=2c(CO32-)
D . 含 等 物 质 的 量 的 NaHC2O4 和 Na2C2O4 的 溶 液 : 3c(Na+)=2[c(HC2O4-)+
c(C2O42-)+c(H2C2O4)]
【答案】A
【解析】
试题分析:根据电解质溶液中的电荷守恒、物料守恒、弱电解质的电离平衡和沉淀溶解平衡
规律分析离子浓度关系。A、根据电荷守恒,pH=1 的 NaHSO4 溶液存在:c(Na+)+c(H+)
=2c(SO42‾)+c(OH‾),因为 c(Na+)=c(SO42‾),所以 c(H+)=c(SO42‾)+c(OH‾),
正确;B、含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)> c(Cl‾)>c(Br‾),错误;C、H2CO3
的第一步电离大于第二步电离,所以 c(H+) > c(HCO3‾) >c(CO32‾),但 c(HCO3‾)不等于
c(CO32‾),错误;D、NaHC2O4 和 Na2C2O4 的物质的量的相等,NaHC2O4 根据物料守恒可
得 : c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) , Na2C2O4 根 据 物 料 守 恒 可 得 :
c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] , 所 以 溶 液 中 2c(Na+)=3[c(HC2O4-)+
c(C2O42-)+c(H2C2O4)],错误。理解、运用各种守恒规律分析、判断,如 NaHC2O4 和 Na2C2O4
分别根据物料守恒得出守恒关系,然后得出正确的结论。
【考点地位】本题主要是考查溶液中离子浓度大小比较,涉及弱电解质的电离、盐类水解、
溶解平衡等
【名师点晴】本题通过 NaHSO4 溶液、AgCl 和 AgI、CO2 的水溶液和含等物质的量的 NaHC2O4
和 Na2C2O4 的溶液考查了电荷守恒、物料守恒、弱电解质的电离平衡和沉淀溶解平衡,根
据守恒规律进行离子浓度比较,考查了学生运用所学规律解决问题的能力。选项 D 是易
错点。
14.【2013 年高考四川卷第 5 题】室温下,将一元酸 HA 的溶液和 KOH 溶液等体积混合(忽
略体积变化),实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的 pH
c(HA) c(KOH)
① 0.1 0.1 9
② x 0.2 7
下列判断不正确...的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
Kw
1×10-9mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)= c(A-)>c(OH-) =c(H+)
【答案】B
【考点定位】本题考查中和反应及离子浓度比较。
【名师点睛】解得本题的关键是室温下,将等体积等浓度的 HA 和 KOH 混合(忽略体积变化),
溶液呈碱性,说明该酸是弱酸;①根据盐的类型确定溶液中离子浓度的相对大小;②根
据电荷守恒计算氢氧根离子浓度;③当等物质的量的酸和碱恰好反应时,溶液呈碱性,
要使等体积的酸和碱混合后溶液呈中性,则酸的浓度应大于碱的浓度;④根据电荷守恒
确定离子浓度关系,本题考查了离子浓度大小的比较,根据电荷守恒和微粒守恒来分析
解答即可。