- 2021-05-14 发布 |
- 37.5 KB |
- 38页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
最新最全广东高考化学知识网络
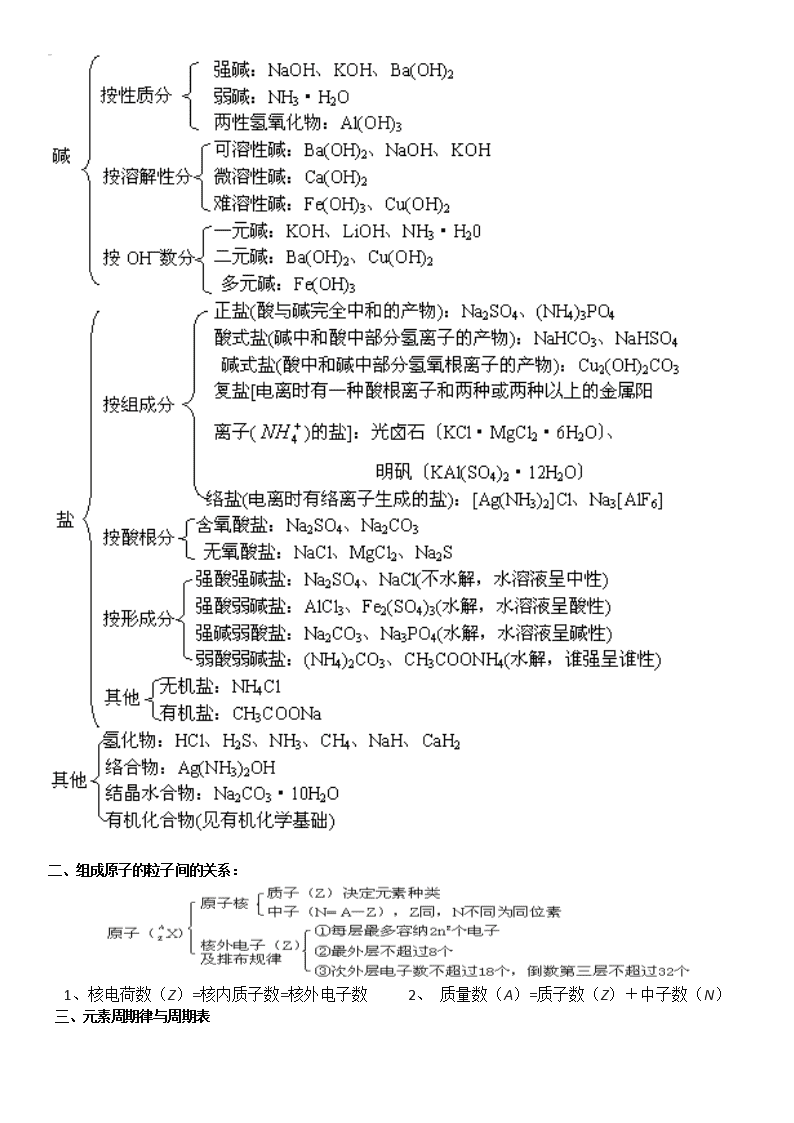
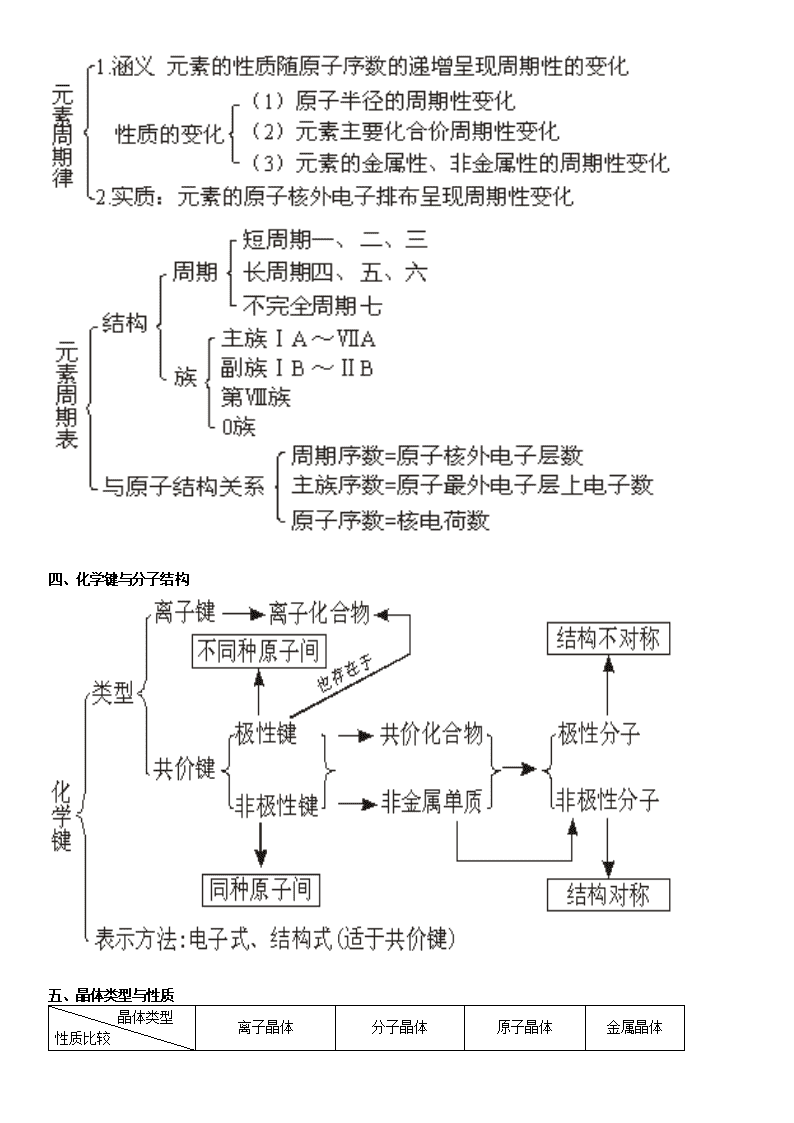
化学知识网络 化学基本概念和基本理论 元素与化合物 有机化学基础 化学计算 化学实验 化学工业知识 化学基本概念和基本理论 一、物质的分类 二、组成原子的粒子间的关系: 1、核电荷数(Z)=核内质子数=核外电子数 2、 质量数(A)=质子数(Z)+中子数(N) 三、元素周期律与周期表 四、化学键与分子结构 五、晶体类型与性质 晶体类型 性质比较 离子晶体 分子晶体 原子晶体 金属晶体 组成粒子 阴、阳离子 分子 原子 金属阳离子和 自由电子结构 粒子间作用 离子键 范德瓦耳斯力 共价键 金属键 熔沸点 较高 低 很高 有高有低 硬度 硬而脆 小 大 有大有小、有 延展性 溶解性 易溶于极性溶剂,难 溶于非极性溶剂 极性分子 易溶于极性溶剂 不溶于任何溶剂 难溶(钠等与 水反应) 物理 性质 导电性 晶体不导电; 能溶于水的其水溶 液导电;熔化导电 晶体不导电,溶于 水后能电离的,其 水溶液可导电;熔 化不导电 不良(半导体 Si) 良导体(导电 传热) 典型实例 NaCl、NaOH Na2O、CaCO3 干冰、白磷 冰、硫磺 金刚石、SiO2 晶体硅、SiC Na、Mg、Al Fe、Cu、Zn 六、化学反应类型 七、离子反应 八、氧化还原反应的有关概念的相互关系 九、化学反应中的能量变化 十、溶液与胶体 十一、化学反应速率 十二、化学平衡 十三、弱电解质的电离平衡 十四、溶液的酸碱性 十五、盐类的水解 十六、酸碱中和滴定 十七、电化学 元素与化合物 钠及其化合物 碱金属 氯及其化合物 卤素 氧族元素 硫的重要化合物 碳及其化合物 硅及其化合物 材料 氮族元素 氮和磷 氨 硝酸 镁和铝 铁及其化合物 铜及其化合物 返回页顶 有机化学基础 烃 不饱和链烃 芳香烃 分 类 通式 结构特点 化学性质 物理性质 同分异构 烷 烃 CnH2n+2 (n≥1) ①C-C 单键 ②链烃 ① 与 卤 素 取 代 反 应 (光照) ②燃烧 ③裂化反应 碳链异构 烯 烃 CnH2n (n≥2) ① 含 一 个 C C 键 ②链烃 ①与卤素、H:、H2O 等发生加成反应 ②加聚反应 ③氧化反应:燃烧, 被 KMnO4 酸 性 溶 液 氧化 碳链异构 位置异构 炔 烃 CnH2n-2 (n≥2) ① 含 一 个 C C 键 ②链烃 ①加成反应 ②氧化反应:燃烧, 被 KMnO4 酸性溶液 氧化 一般随分子 中碳原子数 的增多,沸 点升高,液 态时密度增 大。气态碳 原 子 数 为 1~4。不溶 于水,液态 烃密度比水 的小 碳链异构 位置异构 苯 及 其 同 系 物 CnH2n-6 (n≥6) ①含一个苯环 ②侧链为烷烃基 ①取代反应:卤代、 硝化、磺化 ②加成反应 ③氧化反应:燃烧, 苯 的 同 系 物 能 被 KMnO4 酸性溶液氧化 简单的同系 物常温下为 液态;不溶 于水,密度 比水的小 侧 链 大 小 及 相 对 位 置 产 生的异构 烃的衍生物 ≡ ≡ 烃的衍生物结构、通式、化学性质鉴别 类 别 官能团 结构特点 通式 化学性质 卤 代 烃 -X(卤素原子) C-X 键在一定条件 下断裂 CnH2n+1O2 (饱和一元) (1)NaOH 水溶液加热,取代反应 (2)NaOH 醇溶液加热,消去反应 醇 -OH(羟基) (1)—OH 与烃基直 接相连 (2)—OH 上氢原子 活泼 CnH2n+2O2 (饱和一元) (1)取代:脱水成醚,醇钠,醇与羧 酸成酯,卤化成卤代烃 (2)氧化成醛(—CH2OH) (3)消去成烯 醛 (1) 醛 基 上 有 碳 氧 双键 (2) 醛 基 只 能 连 在 烃基链端 CnH2nO2 (饱和一元) (1)加成:加 H2 成醇 (2)氧化:成羧酸 羧 (1)—COOH 可电离 出 H+ (2)—COOH 难加成 CnH2nO (饱和一元) (1)酸性:具有酸的通性 (2)酯化:可看作取代 酯 , 必 须 是烃基 CnH2nO2 (饱和一元) 水解成醇和羧酸 酚 (1) 羟 基 与 苯 环 直 接相连 (2)—OH 上的 H 比 醇活泼 (3)苯环上的 H 比 苯活泼 (1)易取代:与溴水生成 2,4,6-三 溴苯酚 (2)显酸性 (3)显色:遇 Fe3+变紫色 代表物质转化关系 R′ 糖类 类别 葡萄糖 蔗糖 淀粉 纤维素 分子式 (C6H12O6) (C12H22O11) (C6H10O5) (C6H10O5) 结构特点 多羟基醛 分子中无醛基, 非还原性糖 由几百到几千个 葡萄糖单元构成 的天然高分子化 合物 由几千个葡萄糖 单元构成的天然 高分子化合物 主要性质 白色晶体,溶于 水有甜味。既有 氧化性,又有还 原性,还可发生 酯化反应,并能 发酵生成乙 无色晶体,溶于 水有甜味。无还 原性,能水解生 成葡萄糖和果糖 白色粉末,不溶 于冷水,部分溶 于热水。能水解 最终生成葡萄糖; 遇淀粉变蓝色; 无还原性 无 色 无 味 固 体 . 不溶于水及有机 溶剂。能水解生 成 葡 萄 糖 . 能 发 生酯化反应,无 还原性 重要用途 营养物质、制糖 果、作还原剂 食品 食品、制葡萄糖、 乙醇 造纸、制炸药、 人造纤维 油脂 通式 物理性质 化学性质 密度比水小,不溶于水,易 溶于汽油、乙醚、苯等多种 有机溶剂中。 1.水解: 酸性条件 碱性条件——皂化反应 2.氢化(硬化) 蛋白质和氨基酸 类别 氨基酸 蛋白质 结构特点 分子中既有酸性基(羧基)又有碱 性基(氨基),是两性物质 由不同的氨基酸相互结合而形成的 高分子化合物。分子中有羧基和氨基, 也是两性物质 主要性质 ①既能和酸反应,又能和碱反应 ②分子间能相互结合而形成高分 子化合物 ①具有两性 ②在酸或碱或酶作用下水解,最终得 多种。—氨基酸 ③盐析 ④变性 ⑤有些蛋白质遇浓 HNO3 呈黄色 ⑥燃烧产生烧焦羽毛的气味 ⑦蛋白质溶液为胶体 合成材料(有机高分子化合物) 基本概念 基本概念 单体 结构单元(链节) 聚合度 高聚物 含义 能 合 成 高 分 子 化 合 物 的 小 分 子,一般是不饱 和 的 或 含 有 两 个 或 更 多 官 能 团的小分子 高聚物分子中具 有代表性的、重复 出现的最小部分 每 个 高 分 子 里 链 节 的 重 复 次 数 由单体聚合而成的 相对分子质量较大 的化合物,相对分 子质量高达数千至 数万以上 实例(以聚 乙烯为例) CH2=CH2 —CH2—CH2— n 结构与性质 线型高分子 体型(网状)高分子 结 构 分子中的原子以共价键相 互联结成一条很长的卷曲 状态的“链” 分子链与分子链之间还有许多共价键交联起来,形成 三度空间的网状结构 溶 解 性 能缓慢溶解于适当溶剂 很难溶解,但往往有一定程度的胀大 性 能 具热塑性,无固定熔点 具热固性,受热不熔化 特 性 强度大、可拉丝、吹薄膜、 绝缘性好 强度大、绝缘性好,有可塑性 合成有机高分子化合物的常见反应类型 反 应 类 型 概念 示例 加 聚 反 应 由相对分子质量小 的化合物分子互相 结合成相对分子质 量大的化合物分子 的反应。 均 聚 反 应 发生加聚反应的单 体只有一种。 共 聚 反 应 发生加聚反应的单 体有两种或多种 nCH2=CH2+nCH2=CH—CH2 缩 聚 反 应 有两个或两个以上 官能团的单体相互 结合,生成高分子 化合物,同时生成 小分子(如 H2O、 ①以某分子中碳氧双键中的氧原子与另一个基团中的活泼氢 原子结合成水而进行的缩聚反应。 HX、NH3 和醇等)。 +nH2O ②以醇羟基中的氢原子和酸分子中的羟基结合成水的方式而 进行的缩聚反应。 nHOOC—COOH+nHOCH2CH2OH +2nH2O ③以羧基中的羟基与氨基中的氢原子结合成 H2O 的方式而进 行的缩聚反应。 nH2O-(CH2)5-NH2+nHOOC-(CH2)6-COOH +2H2O 返回页顶 →一定条件下 →一定条件下 化学计算 物质的量及气体摩尔体积的计算 (1)n= n= n= n= (标准状况) n=c·V n= (2)M= m=M·n V= Vm= cB= c1V1=c2V2 (浓溶液稀释) 相对原子质量、相对分子质量及确定化学式的计算 AN N M m mV V 1molL22.4 −⋅ V M ρV ω⋅⋅ n m ρ m n V V nB 物质溶解度、溶液浓度的计算 pH 及有关氢离子浓度、氢氧根离子浓度的计算 化学反应方程式的有关计算 返回页顶 化学实验 化学实验基本操作 常见气体及其他物质的实验室制备 气体发生装置 固体+固体·加热 固体+液体·不加热 固(或液)体+液体·加热 图 4-1 图 4-2 图 4-3 常见气体的制备 制取气体 反应原理(反应条件、化学方程式) 装置类型 收集方法 注意事项 O2 2KClO3 2KCl+3O2↑或 2KMnO4 K2MnO4+MnO2+O2↑ 排 水 法 NH3 2NH4Cl+Ca(OH)2 CaCl2 +2NH3↑+2H2O 固体 + 固体 · 加热 向下 排气法 ①检查装置气密性。 ②装固体的试管口要略向下倾斜。 ③先均匀加热,后固定在放药品 处加热。 ④用排水法收集,停止加热前, 应先把导气管撤离水面,才能熄 灭酒精灯 Cl2 MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O 向上 排气法 NO 3Cu+8HNO3(稀) 3Cu(NO3)2 +2NO↑+4H2O C2H4 CH3CH2OH CH2==CH2↑ +H2O 固 液 体 体 + + 液 液 体 体 · 加 热 排 水 法 ①同上①、③、④条内容。②液 体与液体加热,反应器内应添加 碎瓷片以防暴沸。 ③氯气有毒,尾气要用碱液吸收。 ④制取乙烯温度应控制在 170℃ 左右 H2 Zn+H2SO4(稀)==ZnSO4+H2↑ C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑ 向下排 气法或 排水法 CO2 CaCO3+2HCl==CaCl2+CO2↑+H2O NO2 Cu+4HNO3(浓)==Cu(NO3)2+ 2NO2↑+2H2O H2S FeS+H2SO4(稀)==FeSO4+H2S↑ 固体 + 液体 · 不 加 热 向上 排气法 ①检查装置气密性。 ②使用长颈漏斗时,要把漏斗颈 插入液面以下。 ③使用启普发生器时,反应物固 体应是块状,且不溶于水(H2、CO2、 H2S 可用)。 ④制取乙炔要用分液漏斗,以控 制反应速率。 ⑤H2S 剧毒,应在通风橱中制备, 或用碱液吸收尾气。不可用浓 H2SO4 气体的干燥 干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。常用装置有干燥管(内装固体干燥剂)、洗气瓶(内装 液体干燥剂)。 所选用的干燥剂不能与所要保留的气体发生反应。常用干燥剂及可被干燥的气体如下: (1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2 等(不可干燥还原 性或碱性气体)。 (2)P2O5(酸性干燥剂):可干燥 H2S、HBr、HI 及浓硫酸能干燥的气体(不可干燥 NH3 等)。 (3)无水 CaCl2(中性干燥剂):可干燥除 NH3 以外的其他气体(NH3 能与 CaCl2 反应生成络合物 CaCl2·8NH3)。 (4)碱石灰(碱性干燥剂):可干燥 NH3 及中性气体(N2、O2、H2、CO、NO、CH4、C2H4、C2H2 等)。不能干燥酸性气 体。 (5)硅胶(酸性干燥剂):可干燥 Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其他极性分子,只 能干燥非极性分子气体)。 (6)其他:如生石灰、NaOH 也可用于干燥 NH3 及中性气体(不可干燥有酸性或能与之作用的气体)。 物质的分离提纯 物理分离提纯法 方法 适用范围 主要仪器 举例 注意事项 过滤 固体与液体分离 漏斗、烧杯、玻璃棒、 铁架台(带铁圈)、滤纸 粗盐提纯时,把粗盐溶于 水,经过过滤,把不溶于水 的固体杂质除去 ①要“一贴二低三靠” ②必要时要洗涤沉淀物(在过 滤器中进行) ③定量实验的过滤要“无损” 结晶 重结晶 混合物中各组分在溶 剂中的溶解度随温度 变化不同 烧杯及过滤仪器 硝酸钾溶解度随温度变化 大,氯化钠溶解度随温度变 化小,可用该法从氯化钠和 硝酸钾的混合物中提纯硝 酸钾 ①一般先配较高温度的饱和 溶液,然后降温结晶 ②结晶后过滤,分离出晶体 升华 混合物中某一成分在 一定温度下可直接变 为气体,再冷却成固体 酒精灯、大烧杯、圆底 烧瓶、铁架台(带铁圈)、 石棉网 粗碘中碘与钾、钠、钙、镁 的碘化物混杂,利用碘易升 华的特性,可将碘与杂质分 离 (升华物质的集取方法不作要 求) 蒸发 分离溶于溶剂中的溶 质 蒸发皿、三角架、酒精 灯、玻璃棒 从食盐水溶液中提取食盐 晶体 ①溶质须不易分解、不易水 解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸 干 蒸馏 分馏 利用沸点不同以分离 互溶液体混合物 蒸馏烧瓶、冷凝管、酒 精灯、锥形瓶、牛角管、 温度计、铁架台(带铁 圈、铁夹)、石棉网等 制取蒸馏水,除去水中杂 质。除酒精中水(加生石灰), 乙醇和乙酸(先加 NaOH 蒸 馏,后加浓 H2SO4 蒸馏); 石油分馏 ①温度计水银球在蒸馏烧瓶 支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下 进上出 ④不可蒸干 分液 两种互不相溶的液体 的分离 分液漏斗(有圆筒形、 圆球形、圆锥形) 除溴乙烷中乙醇(先水洗), 水、苯的分离,除乙酸乙酯 中乙酸(加饱和 Na2CO3 洗) 上层液体从上口倒出,下层 液体从下口放出 萃取 利用溶质在两种互不 相溶的溶剂中的溶解 度不同,用一种溶剂把 溶质从它与另一种溶 剂所组成的溶液里提 取出来 可在烧杯、试管等中进 行,一般在分液漏斗中 (为便于萃取后分液) CCl4 把溶于水里的 Br2 萃取 出来 ①萃取后要再进行分液 ②对萃取剂的要求:与原溶 剂互不混溶、不反应;溶质 在其中的溶解度比在原溶剂 中大;溶质不与萃取剂反应; 两溶剂密度差别大 ③萃取后得到的仍是溶液, 一般再通过分馏等方法进一 步分离 渗析 用半透膜使离子或小 分子从胶体中分离出 来(提纯胶体) 半透膜、烧杯等 除去 Fe(OH)3 胶体中的 HCl 要不断更换烧杯中的水或改 用流水,以提高渗析效果 溶解 杂质与被提纯的物质 在溶解性上有明显差 异的混合物 分液装置或洗气装置 或过滤装置 溴乙烷中的乙醇;Cl2 中的 HCl;CaCO3 中的 NaCl ①固体先研细 ②搅拌或振荡 ③易溶气体溶解要防倒吸 ④必要吋加热 ⑤注意后续操作 盐析 利用某些物质在加某 些无机盐时,其溶解度 降低而凝聚的性质来 分离物质 烧杯、玻璃棒以及过滤 仪器 从皂化液中分离肥皂、甘油; 蛋白质的盐析 ①注意无机盐的选用 ②少量盐能促进蛋白质的溶 解,重金属盐使蛋白质变性 ③盐析后过滤 化学分离提纯 化学法要同时考虑到各组成成分及杂质的化学性质和特点,利用它们之间的差别加以分离提纯。一般原则是:① 引入试剂一般只跟杂质反应;②后续试剂应能除去过量的前一试剂;③不引进新杂质;④杂质与试剂生成的物质易 与被提纯物分离(状态类型不同);⑤过程简单,现象明显,纯度要高;⑥尽可能将杂质转化为所需物质;⑦除去多 种杂质时应考虑加入试剂的合理顺序;⑧如遇到极易溶解于水的气体时,应防止倒吸现象发生。在进行化学分离提 纯时,进行完必要的化学处理后,要适时实施某些物理法操作(如过滤、分液等)。 试剂的选择或采取的措施是最为关键的,它要根据除杂的一般原则,分析杂质的状态类型来确定。①原物质和 杂质均为气体时,一般不选用气体作为除杂的试剂,而选用固体或液体试剂;②原物质和杂质均为可溶于水的固体 (或溶液)时,杂质的除去,要根据原物质与杂质中阴阳离子的异同,选择适当试剂,把杂质中与原物质不相同的阳 离子或阴离子转变成沉淀、气体、水或原物质。试剂一般选用可溶于水的固体物质或溶液,也可选用气体或不溶于 水的物质;③原物质和杂质至少有一种不溶物时,杂质的除去一般不选用固体试剂,而是选用气体或液体试剂,也 可采用直接加热、灼烧等方法除去杂质。 (1)加热分解法:如 NaCl 中混有少量 NH4HCO3,加热使 NH4HCO3 分解。 (2)氧化还原法:利用氧化还原反应将杂质或氧化或还原,转化为易分离物质。如除去苯中的少量甲苯,就可利 用甲苯与酸性高锰酸钾反应,生成苯甲酸,再加碱生成水溶性苯甲酸钠,从而与苯分离;又如,除去 CO2 中的少量 O2,可将气体通过热的铜网。 (3)沉淀法:将杂质转变为沉淀除去的方法。如除去 CO2 中的 H2S 气体,可将混合气体通入到 CuSO4 溶液中,除 去 H2S 气体。 (4)汽化法:将杂质转变为气体使之除去的方法。如除去 NaCl 固体中的 Na2CO3 固体,可加入 HCl 将其中的 转变为 CO2 气体。 (5)酸、碱法:利用杂质和酸或碱的反应,将不溶物转变成可溶物;将气体杂质也可转入酸、碱中吸收来进行提 纯。如除去 CuS 中的 FeS 就可采用加入盐酸,使之充分溶解,利用 FeS 和盐酸反应而不与 CuS 反应的特点来使两者 分离。 (6)络合法:有些物质可将其转化为络合物达到分离目的。如 BaSO4 中的 AgCl 可通过加入浓氨水,使 AgCl 转化 为可溶的[Ag(NH3)2]Cl 除去。 (7)转化法:利用某些化学反应原理,将杂质转化为所需物质,如 NaHCO3 溶液中含 Na2CO3 可通足量 CO2 转化, CaO 中含 CaCO3,可加热使之转化等。有机物的分离一般不用此法,如除去乙酸乙酯中混有的乙酸,如果采用加入 乙醇及催化剂(稀硫酸)并加热的方法,试图将乙酸转化为乙酸乙酯,这是适得其反的。其一是加入的试剂难以除去; 其二是有机反应缓慢、复杂,副反应多,该反应又是可逆反应,不可能反应到底将乙酸除尽。 (8)水解法:当溶液中的杂质存在水解平衡,而用其他方法难以除之,可用加入合适试剂以破坏水解平衡,使杂 质转化为沉淀或气体而除去。如:MgCl2 中的 FeCl3,可用加 MgO、Mg(OH)2、MgCO3 等,降低 H+浓度,促进 Fe3+水 解为 Fe(OH)3↓,而不能加 NaOH 和 NH3·H2O 等。 (9)其他:如 AlCl3 溶液中混有的 FeCl3,可利用 Al(OH)3 的两性,先加过量氢氧化钠溶液,过滤,在滤液中通足量 CO2,再过滤,在滤渣[Al(OH)3]中加盐酸使其溶解。此外还有电解法精炼铜;离子交换法软化硬水等。 多数物质的分离提纯采用物理——化学综合法。 物质的检验 −2 3CO 化学工业知识 合成氨 石油化工 氯碱工业 硫酸的工业制法查看更多